質譜成像技術及其在乳腺癌研究中的應用
張夢婷, 張育露, 王浩江, 李 寧, 李 波, 肖 虹, 卞 偉*, 蔡宗葦
(1. 山西醫科大學基礎醫學院生物化學與分子生物學教研室, 山西 太原 030001; 2. 山西醫科大學第一醫院病理科, 山西 太原 030001; 3. 香港浸會大學化學系環境與生物分析國家重點實驗室, 香港 999077)
乳腺癌是導致婦女因癌癥死亡的主要原因之一,它是一種高度異質性疾病,包括幾種亞型[1]。目前,早期乳腺癌的死亡率已大大降低,遠低于40年前的水平,治愈率為90%,但是面對晚期乳腺癌的治療和治愈后的復發仍然存在挑戰[2]。基于分子亞型的不同,乳腺癌表現出不同的基因表達模式,主要由雌激素受體、孕激素受體和人表皮生長因子受體-2的狀態表達情況決定[3]。乳腺癌的早期診治中需要更精確地評估敏感的生物標記物,在分子水平上對乳腺癌進行精確的診斷和分型,提高乳腺癌的診斷和預后情況,指導分子靶向治療。
質譜成像(mass spectrometry imaging, MSI)作為一種免標記的分子成像技術,可直接獲取藥物及其代謝物以及脂質、多肽、蛋白質等內源性代謝物在組織中的分子信息和空間分布信息,在生物、醫學等領域表現出良好的應用前景。基于電離方式不同,常見的質譜成像技術可分為基質輔助激光解吸電離質譜成像(matrix-assisted laser desorption/ionization mass spectrometry imaging, MALDI-MSI)[4],解吸電噴霧離子化質譜成像(desorption electrospray ionization mass spectrometry imaging, DESI-MSI)[5]和二次離子質譜成像(secondary ion mass spectrometry mass spectrometry imaging, SIMS-MSI)[6]。

表 1 不同電離方式在檢測小分子時的難點及解決方法
質譜成像分析的一般流程為組織獲取、切片制備、質譜電離、圖譜獲取和數據分析。樣品前處理是影響MSI結果的關鍵步驟,處理方法與待測物性質和樣品類型密切相關,正確的樣品制備可以保持分子的來源、分布和豐度,獲得高質量的信號和足夠的空間分辨率[7]。在MALDI-MSI中,基質的選擇和噴涂方式同樣決定了成像分析的結果。本綜述介紹了質譜成像技術中對于不同類型樣品的處理及其在乳腺癌不同研究模型的應用進展,為開展乳腺癌的精準診斷和分型提供依據。
1 MSI樣品處理
MSI樣品處理的方法與樣品類型、待測物自身的性質相關,基本過程包括收集樣品、儲存、切片、組織預處理、基質噴涂等方面。樣品制備對于實驗結果的可靠性和可重復性至關重要,顯著影響MSI的分辨率、靈敏度和數據的準確性。
1.1 小分子
內源性代謝物,包括低相對分子質量代謝物(m/z<500)和脂質,是細胞結構的重要組成部分,它們在細胞信號傳導,氧化應激反應和能量代謝中起著至關重要的作用。小分子代謝物的成像可以采用DESI、nano-DESI、MALDI等離子源或者不同的電離方式(見表1)。使用DESI和nano-DESI對生物樣品進行成像時只需要很少的樣品預處理步驟甚至不需要進行處理。Nguyen等[13]使用甲醇和水組成的常用脂質萃取溶劑對小鼠肺部組織中的脂質進行了nano-DESI-MSI分析,實現了對小鼠肺組織中20個脂質亞類中的265種獨特脂質和19種代謝物(共284種)的鑒定,覆蓋率達到40%。實驗中未檢測到的脂質可能是由于該類脂質的含量低、萃取劑對其萃取效率低或脂質的離子化程度低。在萃取劑中添加陽離子試劑可以增強特定脂質的離子化程度,例如Duncan等[8]在萃取溶劑中添加Ag+,實現了對含量較低的前列腺素的nano-DESI-MSI分析。組織基質中的離子抑制效應對藥物的質譜成像有較大的影響,是MSI在臨床藥物研究中所面臨的難點和重點問題。Song等[14]開發了一種原位水凝膠調節方法,來增強空氣輔助解吸電噴霧電離質譜成像(Air-flow-assisted desorption electrospray ionization-mass spectrometry imaging, AFADESI-MSI)的靈敏度。該方法使用固相水凝膠“沖洗”組織切片代替在溶劑中對其進行沖洗或消化處理。并檢驗了此方法對各種不同理化性質藥物(如紫杉醇、羅紅霉素、利血平、雙氯芬酸等)的適用性。結果表明,該方法可以顯著降低水溶性季銨鹽和無機鹽對離子的抑制作用,將藥物信號增強2到25倍。

表 2 新基質及其優勢
使用MALDI-MSI對小分子進行成像時,會存在多種與基質相關的離子信號,干擾成像的結果和質量。為了解決這個問題,研究人員找到了新的基質用于MALDI-MSI(見表2)。Sun等[9]應用背景干擾小、靈敏度高、可同時應用于正離子和負離子模式檢測的1,1′-聯萘-2,2′-二胺(BNDM)作為基質,實現了對大鼠大腦中氨基酸、有機酸、核苷、核苷酸、含氮堿基、膽固醇、多肽、脂肪酸、磷脂酰乙醇胺等301個負代謝物離子和膽堿、肉堿、多胺、肌酸、磷脂酰膽堿等175個正代謝物離子的成像,通過探索整體脂質的變化來發現與病理狀態相關的功能分子。圖1為用BNDM作為MALDI-MSI的新基質檢測大鼠大腦中代謝物的示意圖。Guan等[15]使用聚乙烯吡咯烷酮包被的銀納米顆粒(AgNPs)作為MALDI-MSI的基質,實現了對腦組織中脂肪酸、甘油酯、甘油磷脂、鞘脂和固醇的同時成像。
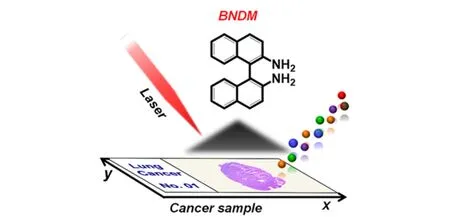
圖 1 BNDM作為MALDI-MSI的新基質檢測代謝物的示意圖[9]Fig. 1 Schematic diagram of BNDM as a new matrix of MALDI-MSI for detection of metabolites[9]
研究發現非傳統基質和基質添加劑可為分析中性脂質提供優勢。Dufresne等[17]提出了一種用MALDI-MSI檢測中性脂質的樣品制備方法,使用Na2CO3或Na3PO4向組織切片中摻入鈉,然后進行2,5-二羥基苯甲酸(DHB)升華。此方法能夠檢測幾種中性脂質,例如膽固醇酯類、羊毛甾醇酯、甘油二酯、腦苷脂和甘油三酯。這種方法已成功應用于腦、腎、肝和腎上腺的MALDI-MSI實驗。相較于之前報道的中性脂質的檢測方法,這種方法能夠以5 μm的空間分辨率使中性脂質可視化。
脂質組中含有較多的碳碳雙鍵位置異構,這給脂質的精確結構分析和定量分析帶來挑戰。Bednarik等[11]利用Paternò-Büchi(PB)反應,使用苯甲醛作為衍生化試劑,將脂質分子中的碳碳雙鍵選擇性衍生化,實現了對高不飽和磷脂和糖脂中碳碳雙鍵的定位分析。游離脂肪酸(FFAs)參與信號分子的構成,這些分子對體內的許多代謝活動如脂質和葡萄糖代謝至關重要,但由于其相對分子質量小,在組織中豐度低,電離效率差,給其檢測帶來困難。Wang等[12]使用易于合成的試劑N,N-二甲基哌嗪碘化物(DMPI)建立了組織原位FFAs衍生化方法,該試劑可以在溫和條件下與脂肪酸反應,圖2為DMPI與脂肪酸反應的示意圖,衍生的FFAs適用于以正離子模式檢測。通過使用這種衍生化試劑和已建立的衍生化方法,可以同時檢測和成像甲狀腺組織中的FFAs和磷脂(PLs),同時提高了檢出目標分子的數量和方法靈敏度。

圖 2 脂肪酸與衍生試劑反應示意圖[12]Fig. 2 Schematic diagram of the reaction between fatty acid and derivatization reagent[12] HATU: 2-(7-azabenzotrizol-1-yl)-N,N,N′,N′-tetramethyluronium hexafluorophosphate.
1.2 大分子
常見的生物大分子物質包括蛋白質、多糖和核酸等,其相對分子質量從幾萬到幾百萬不等,在生物體內存在量變和空間定位的變化,它們在疾病甚至癌癥發展過程中發揮重要功能。對大分子進行檢測的離子源有MALDI、SIMS、DESI等。Nunez-Naveira等[18]用MALDI-TOF MSI對9例肺癌患者呼出氣冷凝物(EBC)中的蛋白質分布進行探究,發現EBC中含較高濃度的皮離蛋白和S100A9; Mochiji等[19]使用氬氣團簇離子源,通過SIMS-MSI檢測到了細胞色素C(12 327 Da)和糜蛋白酶(25 000 Da); Hsu等[20]通過nano-DESI檢測出質量達到15 kDa的蛋白質。

表 3 大分子成像前的切片洗滌方案
通過MALDI-MSI檢測組織樣品中高相對分子質量蛋白質(>25 kDa)分布的一般方法需要先進行原位酶解。原位酶解是將較大的蛋白質水解為多肽,然后對生成的肽段進行原位成像分析,常用的酶為胰蛋白酶[21]。組織切片清洗用于去除對測量靈敏度產生不利影響的脂質、鹽和其他小分子。清洗方案需要根據目標分析物進行評估選擇,表3列舉了不同實驗目的的洗滌方案。Bastrup等[25]將DHB和2-羥基-5-甲氧基苯甲酸混合,并添加磷酸,減少了背景信號的干擾,對阿爾茲海默癥病人大腦和淀粉樣前體蛋白轉基因小鼠的淀粉樣蛋白(Aβ)進行MALDI成像,增強了對Aβ蛋白,特別是Aβ1-42的檢測效果。Piga等[26]以產生的質譜峰數和平均信噪比為標準,評估了不同的洗滌步驟,以及SunChrom自動噴涂機不同的噴涂方式,使用MALDI-FTICR-MSI(matrix-assisted laser desorption/ionization-fourier transform ion cyclotron resonance-mass spectrometry imaging)分析小鼠和人胰腺組織中的完整蛋白,結果表明,在乙醇-水的基礎洗滌步驟中加入芥子酸,在噴涂時提高噴嘴的速度可以獲得較高質量的圖譜。
1.3 基質噴涂
在MALDI-MSI研究中,常用的基質噴涂方法包括噴槍法、自動噴霧法、升華法。噴槍法屬手動方法,受人為因素影響,重現性較差。自動噴霧法可以提供更均勻的基質層,提高了重現性。用升華法噴涂基質可以制備均勻的基質結晶薄層,但是升華法會降低蛋白質的提取效率。Yang等[27]發現基質沉積后的重結晶可以提高蛋白質的電離效率。Lin等[28]在基質升華和水合作用之后,加入了超聲處理,發現m/z>10 000的蛋白質信號顯著增強。通過升華進行的基質沉積一般使用標準玻璃升華器,根據實驗要求可以進行改進:Fernandez等[29]設計了一種不銹鋼升華器,可以更好地控制升華過程中的樣品溫度和室內真空,使基質沉積的可重復性達到5%。Nakashima等[30]將基質均勻地涂覆在膠帶上,并通過導電膠帶附著在導電載玻片(indium-tin-oxide coated slide, ITO載玻片)上,然后將大鼠腦組織黏附到載玻片上。圖3為該方法制備的示意圖。與傳統方法相比,這種方法可以減少基質沉積的時間和工作量,但是其得到的信號強度較低。

圖 3 基質沉積方法示意圖[30]Fig. 3 Schematic diagram of matrix deposition method[30]
通過解吸電噴霧電離質譜(DESI-MS)進行蛋白質分析時,靈敏度會隨蛋白質質量增加而下降。為了克服此困難,Maser等[31]在DESI分析期間,使用潤濕筆將預潤濕的溶劑(含有乙腈和甲酸)噴涂到樣品上,增加了蛋白質溶解時間,改善相對分子質量較大的蛋白質(如牛血清白蛋白)的成像分析。采用該方法可以直接從稀釋的山羊血清中檢測到白蛋白和相對分子質量更大的蛋白質。
1.4 石蠟包埋樣品的處理
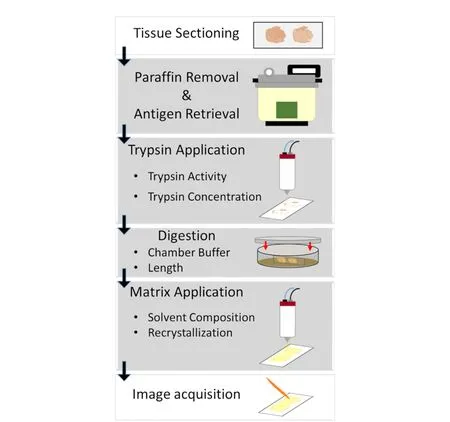
圖 4 對FFPE組織進行MALDI MSI肽分析的工作流程[33]Fig. 4 Workflow of MALDI MSI peptide analysis for FFPE tissue[33]
與新鮮腫瘤樣品相比,石蠟包埋組織被廣泛應用于人體腫瘤組織的保存,導致了在MSI研究中需要進行脫蠟等前處理。用于MALDI-MSI的福爾馬林固定石蠟包埋(formalin-fixed and paraffin-embedded, FFPE)組織切片制備的一般步驟包括:組織分離、固定、脫水、石蠟包埋、切片、脫蠟、清洗、抗原回收、胰蛋白酶消化、基質噴涂[32]。圖4為對FFPE組織進行MALDI MSI肽分析的工作流程[33]。Hermann等[34]優化了溶解胰蛋白酶的溶劑條件、胰蛋白酶的濃度、脫蠟后的清洗過程、胰蛋白酶和基質的噴涂等步驟,用于腎臟、心臟和血管組織的FFPE切片,標準化的操作程序可以提高從不同實驗室獲得數據的可靠性。
Paine等[35]開發了一種能夠從FFPE組織中檢測內源肽的方法。他們通過MALDI-MSI分析了30年前用福爾馬林固定包埋石蠟中的美洲蟑螂的神經內分泌組織,揭示了20多種肽的組織學定位。該方案的樣品前處理使用二甲苯和乙醇進行脫蠟處理,省略了清洗、抗原回收以及會干擾MSI對低豐度內源肽檢測的酶消化步驟,實現了對內源性肽的高通量質譜成像分析。膠原蛋白和彈性蛋白是所有組織和器官的基本框架,它們的表達和翻譯后修飾在生命活動中受到嚴格的調控。Angel等[36]使用膠原酶和基質金屬蛋白酶代替常見的胰蛋白酶來消化FFPE組織中的膠原蛋白和彈性蛋白,并使用MALDI-MSI檢測消化產物,獲取膠原蛋白和彈性蛋白的空間定位。
2 質譜成像在乳腺癌中的應用
乳腺癌是女性最常見的惡性腫瘤,發病率在世界范圍內呈明顯上升趨勢[37]。因此,建立早期診斷和有效篩查方法能提高乳腺癌患者的生存率。隨著分子生物學的發展,質譜成像技術為腫瘤的研究和診斷提供了新的思路,它是一種研究生物組織或細胞中分子組成及分布的新型分析技術,此方法可在無需標記的前提下同時檢測腫瘤組織中多種物質的分布。近年來,研究者們為了更好地探索質譜成像在乳腺癌中的應用,主要分為3種模型來進行研究:以乳腺癌細胞為模型的研究,以乳腺癌動物為模型的研究,以臨床腫瘤樣本為模型的研究。
2.1 細胞模型
3D細胞微球是腫瘤研究中不可或缺的體外研究工具,此模型在評估抗腫瘤藥物的滲透和代謝方面有很好的應用前景。多項研究成果表明2D和3D細胞體系存在微環境間的差別。Yue等[38]利用納升液相色譜-質譜聯用技術對2D和3D結腸癌細胞培養模型的蛋白組進行比較,結果表明細胞在3D培養狀態下體內的增殖和擴張速度不如2D培養快,3D培養能更好地反映體內條件。Vidaysky等[39]采用液相色譜-質譜聯用技術,在2D和3D培養模型中評估乳腺癌細胞的脂質分子代謝情況。研究發現與2D細胞培養相比,3D細胞培養的腫瘤細胞總脂質含量顯著下降,酰基甘油與膜脂的比值增加。此外,在惡性程度不同的3D細胞微球體中也存在顯著差異。因此,3D細胞體外培養技術更能反映細胞惡性轉化和微環境的改變,通過這些脂質分子的空間分布差異可以更好地了解脂質代謝和癌癥之間的關系。

圖 5 MALDI-MSI檢測西妥昔單抗的示意圖[41]Fig. 5 Schematic illustration of cetuximab detection using MALDI-MSI[41]

表 4 不同離子源質譜、3D模型及其檢測內容
Hummon等[40]把MALDI-MSI技術應用于HCT116結腸癌多細胞球狀體中,他們發現藥物對結腸癌多細胞球狀體的滲透隨時間增加而增加,并且繪制出了藥物處理后3種代謝物(SN-38、SN-38葡糖醛酸苷、脫羧代謝物)在細胞球中的定位圖。他們還通過組織還原和MALDI-MSI分析,成功地繪制了西妥昔單抗在兩種不同結腸癌細胞(HT-29和DLD-1)微球中的時間依賴性滲透和空間分布[41],圖5為該實驗的機理圖。此外,Tucker等[42]利用傅里葉變換離子回旋共振(FT-ICR)、MALDI-MSI來探究乳腺癌細胞MCF-7球狀體和正常細胞的內源性代謝物差異。他們可以根據代謝物標記來判斷這些細胞培養模型的中心區域經歷了缺氧加劇或者是氧化應激。
質譜成像技術在新藥開發方面有很大的應用前景。Feist等[43]利用多細胞腫瘤球狀體(multicellular tumor spheroids, MCTS)的空間異質性來檢驗藥物的分布,通過MALDI-MSI,利用HCT116結腸癌MCTS模型來評價表觀遺傳藥物UNC1999的作用。Theiner等[44]用了一種先進的激光灼燒-電感耦合等離子體質譜(LA-ICPMS)裝置,用于MCTS的高空間分辨率元素成像,他們測定了人結腸癌細胞HCT116中的磷和鉑元素,即此方法可用于篩選金屬抗癌藥物。表4列舉了不同離子源質譜和3D模型在不同癌癥中的檢測。
2.2 動物模型
腫瘤的發生發展一直是醫學領域的重點和難點問題,人類對腫瘤的起因、浸潤、轉移等方面的分子機理尚不清楚。在腫瘤研究中,建立人腫瘤動物模型是研究腫瘤細胞生長、侵襲和轉移的重要手段。因此,合適的腫瘤動物模型對于評價抗癌藥物及抗腫瘤免疫治療的療效至關重要。為了了解腫瘤的空間異質性,Jiang等[45]對來自乳腺腫瘤異種移植的MDA-MB-231-HRE-tdTomato細胞的三維MALDI-MSI數據進行線性判別分析,他們發現低氧調節蛋白在以下幾個途徑中表達上調,如葡萄糖代謝、肌動蛋白細胞骨架調節、蛋白質折疊和翻譯等過程。此外,還發現一些特定的磷脂酰膽堿和鞘磷脂定位在腫瘤的缺氧區,這些脂質和蛋白質可能會轉化為缺氧的潛在生物標志物,可能會是潛在的治療乳腺癌的靶點。
同樣,為了了解缺氧帶來的腫瘤變化,Mascini等[46]以小鼠乳腺癌異種移植為模型,使用MALDI-MSI來研究哌莫硝唑及其代謝,他們證明了哌莫硝唑確實可以作為低氧標記,這些標記在臨床診斷和放化療方面有很大前景。Sun等[47]利用MSI方法來研究異種移植小鼠模型腫瘤組織中肉堿的空間分布變化,對17種左旋肉堿進行成像,他們發現參與肉堿系統介導的脂肪酸氧化途徑的CPT 1A(carnitine palmitoyltransferase 1A)、CPT 2(carnitine palmitoyltransferase 2)和CRAT(carnitine acetyltransferase)在乳腺癌中異常表達。這也是人們首次發現CPT 2和CRAT在乳腺癌的表達中發生了變化。Reyzer等[48]以erbB受體抑制劑OSI-774和Herceptin處理后的HER2轉基因鼠為模型,采用MALDI-MSI進行分析,發現當胸腺素β4和泛素下降超過80%時,會出現腫瘤細胞增殖抑制,并誘導細胞凋亡,此效應具有時間和劑量依賴性。此外,他們還預測了OSI-774和Herceptin的協同治療效果以及耐藥作用,表明了基于MALDI-MSI的乳腺癌早期的蛋白質組學變化可用于預測其臨床治療。Johnson等[49]以MCF-7乳腺癌異種移植小鼠為模型,采用UPLC-ESI-QTOF-MS(ultra-performance liquid chromatography-electrospray ionization-quadrupole time-of-flight mass spectrometry)對其尿液進行代謝組學分析,發現了酯葡萄糖醛酸、牛磺酸、香豆酸硫酸酯、癸酸葡糖苷酸等5種與乳腺癌相關的代謝物,其在腸道內存在顯著性差異表達,這些代謝產物的變化揭示了脂肪酸合成和腸道微生物與抗腫瘤增殖作用之間的相關性。Tanaka等[50]用定量質譜成像技術分析了伊帕替尼在小鼠腦轉移區的濃度,發現熒光標記的右旋糖苷在腦轉移區和腦實質中熒光強度相當,表明血腫瘤屏障保持完整,伊帕替尼有望成為HER2陽性乳腺癌腦轉移的治療藥物。
2.3 臨床腫瘤樣本
隨著應用分子診斷技術的發展,研究者們根據乳腺癌的基因表達譜不同,將其分為不同亞型[51]。目前基于雌激素受體(ER)、孕激素受體(PR)、人類表皮生長因子受體2(HER2)和ki-67等分子受體的表達將乳腺癌分為5種亞型,即管腔A型(luminal A)、管腔B型(luminal B)、HER2陽性型、基底樣型/三陰性型以及其他類型。乳腺癌分子分型的研究對乳腺癌的個體治療和靶向治療有重要依據。
Kim等[52]采用MALDI-MSI鑒定臨床樣本中的內源性雌激素,并成功檢測了芳香酶抑制劑處理的MCF-7細胞系中雌酮代謝表達水平的變化。因此,定量的MALDI-MSI方法有望成為含酮代謝物的靶向代謝組學的通用方法。Rauser等[53]利用MSI技術來探究HER2陽性乳腺癌組織中的蛋白標記物,對48例乳腺癌組織進行質譜成像分析,表明HER2狀態與特異性多肽/蛋白的表達相關,其中一個富含半胱氨酸的小腸蛋白1(CRIP1)被認為是與HER2過度表達密切相關的蛋白之一,因此,它可以作為判斷HER2陽性乳腺癌的特異性的標記物之一。Scott等[54]采用MALDI-MSI方法,對人乳腺癌組織相關的N-glycan分布進行評估。他們發現特定的聚糖結構分布在基質區、壞死區和腫瘤區,一系列高甘露糖、分枝糖和巖藻糖基乳糖主要分布在腫瘤區域。此外,在晚期HER2陽性、三陰性和轉移性乳腺癌組織中檢測到一系列乳糖胺聚糖。這些聚糖的發現為臨床的診療提供了新的思路,并可作為潛在的預后生物標志物進行進一步的評估。Prentice等[55]采用MALDI成像的胰蛋白酶肽來比較10個三陰性乳腺癌腫瘤組織的癌變區域和良性組織區域。通過分析編碼這14種蛋白的基因表達與三陰性乳腺癌患者無復發生存率的關系,發現其中9個基因的高表達與較低的無復發生存率相關。相反,在雌激素受體陽性的腫瘤中,這些基因的高表達與這些基因無相關性。該研究為三陰性乳腺癌相關生物標記物的探索提供了新的認識,為乳腺癌的預后和治療提供了新的方向。
常壓敞開式離子化質譜可以在開放環境下對樣品進行解吸和離子化,且不需要復雜的樣品前處理。Calligaris等[56]發現DESI-MSI可以獲得具有代謝特征譜圖的分子圖像,并用來鑒別腫瘤組織和正常組織,有望將DESI-MSI應用在保乳手術中,從而快速檢測殘余的癌組織。Santoro等[57]利用DESI-MSI識別出浸潤性乳腺癌(IBC)、原位導管癌(DCIS)和相鄰的良性組織(ABT)之間以及乳腺癌分子亞型之間不同的脂質成分。Robison等[58]利用DESI-MSI方法來鑒定乳腺癌細胞單層和懸浮培養(轉移性)中HER2/p53表達、轉移潛能和疾病狀態(即癌癥與非癌癥)的脂質生物標記物。此外,他們還利用DESI-MSI方法來繪制轉移性球狀體中脂質的空間分布(MDA-MB-231),發現12種脂類與單層細胞培養的轉移潛能變化相關,其中3種定位于球形壞死的核心,表明其在營養缺乏的環境中有促進癌細胞存活的潛在作用。在單層MDA-MB-231培養中未檢測到的一種脂類物質被定位到球體的外周,這表明它在浸潤或增殖中發揮潛在作用。Mao等[59]利用AFAI-MSI (air flow assisted ionization-mass spectrometry imaging)通過分析脂質來區分乳腺浸潤性導管癌(IDC)和原位乳腺導管癌(DCIS)。他們發現多種亞型和組織結構IDC和DCIS可以用AFAI-MSI進行區分:IDC中磷脂含量高于DCIS,而DCIS中脂肪酸含量高于IDC,標本的分類與組織病理學診斷的吻合度較高,證明此方法有望為臨床治療提供輔助診斷。
3 展望
乳腺癌作為女性最常見的腫瘤,受到人們廣泛的關注,不同亞型的乳腺癌一般具有不同的病情發展和結局,而如何區分不同的亞型一直以來是臨床上需要面對的難題。通過質譜成像技術對乳腺癌進行診斷為其提供了新的研究方向,但目前質譜成像并未廣泛應用到臨床診斷中,仍然處于起步階段。在實驗過程中,樣品制備、儀器控制、數據分析等仍然存在一定的改善空間。此外,采集大量樣品,開展大范圍的實驗,才能為乳腺癌的診斷和治療帶來新的突破。