非體外循環主動脈縮窄根治術治療兒童主動脈縮窄的療效分析
章 堅 吳 春 潘征夏 李勇剛 馮 川 熊 玲 金 鑫 冉啟仁
主動脈縮窄(coarctation of the aorta,CoA)是指先天性主動脈弓的局限性狹窄,發病率約為0.4‰,病變部位絕大多數位于主動脈峽部、動脈導管或動脈韌帶附近[1]。該病可單獨存在,也可合并其他心內畸形,如室間隔缺損、瓣膜發育異常等。未經治療的主動脈縮窄患者自然預后差,平均壽命32~40歲,死亡原因包括充血性心力衰竭、主動脈破裂、感染性心內膜炎、腦出血等致命性并發癥[2]。主動脈縮窄手術方式的選擇受多種因素影響,如合并心內畸形,主動脈縮窄段的長度、直徑,患者術前一般情況等。對于單純型主動脈縮窄,大多數中心傾向于采用左后外側入路非體外循環下行主動脈縮窄根治術[3,4];對于主動脈縮窄合并其他心內畸形且該心內畸形有自愈可能者,也可經側開胸手術;對于低體重、術前反復肺炎、心力衰竭等原因不能耐受體外循環的患者,可一期側開胸行主動脈縮窄根治術;必要時行肺動脈環縮,二期手術矯正心內畸形[5]。本研究總結了重慶醫科大學附屬兒童醫院收治的69例經左后外側入路非體外循環下行主動脈縮窄根治術患者的臨床資料,現將治療效果報道如下。
材料與方法
一、臨床資料
1. 研究對象:收集重慶醫科大學附屬兒童醫院2010年2月至2019年8月收治的經左后外側入路非體外循環下行主動脈縮窄矯治術的69例患者作為研究對象,病例納入標準:術前心臟彩超或心臟大血管增強CT及三維重建診斷為主動脈縮窄且手術在非體外循環下進行。主動脈縮窄診斷標準為主動脈狹窄處直徑/降主動脈直徑<0.5[6]。排除標準:經胸骨正中入路手術或經左后外側入路但僅行主動脈松解未切斷主動脈。收集患者術前的臨床資料、手術相關臨床資料及隨訪資料,通過門診隨訪、電話隨訪及查詢患者門診復查心臟彩超的結果完成隨訪,以末次隨訪時的臨床資料為準。69例中男38例,女31例,年齡為2天至14歲,年齡中位數和四分位間距為10.4(4.4,53.2)個月,包括新生兒5例(7.2%)。體重2.0~47.0 kg,體重中位數和四分位間距為8.0(5.0,14.5)kg。根據手術時年齡分為低齡組(≤ 1歲)39例和高齡組(1~18歲)30例。術前經心臟彩超診斷為主動脈縮窄的患者均行心臟大血管增強CT及三維重建檢查確診,多普勒超聲心動圖測得術前縮窄段平均收縮期壓差(60.9±20.5)mmHg。導管前型主動脈縮窄36例,導管旁型18例,導管后型15例。合并的心內畸形包括房間隔缺損13例、卵圓孔未閉13例、室間隔缺損5例、主動脈瓣發育異常12例、二尖瓣發育異常6例、三尖瓣發育異常1例。合并其他畸形包括雞胸4例、脊柱側彎2例、膈膨升1例、膈疝1例、馬蹄腎1例。22例術前胸部CT氣道三維重建提示合并氣道狹窄,以左主支氣管為主,考慮為增大的左房及左室壓迫所致。
2. 相關定義:出院后通過導管介入或外科手術方式治療主動脈再縮窄稱為再干預。高血壓定義為收縮壓和(或)舒張壓位于同性別、年齡、身高兒童血壓水平的第95百分位以上。
二、手術方法
在氣管插管全身麻醉后選擇右側橈動脈和右側股動脈監測上下肢血壓。采用約80°右側臥位,手術入路選擇左后外側第三或第四肋間。充分游離導管周圍組織,游離保護左側喉返神經。經動脈導管或導管韌帶后方放置絲線,予以縫扎切斷并切除導管周圍組織。術中充分游離主動脈弓、無名動脈、左頸總動脈和左鎖骨下動脈及降主動脈,如有迷走左鎖骨下動脈則予結扎切斷。控制性降溫至34℃,阻斷主動脈縮窄近端及遠端,其間有意升壓使下肢獲得更好的血供。切除縮窄段主動脈,根據患者主動脈縮窄程度及張力大小選擇6-0或7-0Prolene線行主動脈端端吻合術、擴大端端或端側吻合術。若合并主動脈弓發育不良或吻合口張力過大,可用心包補片或Gore-Tex補片擴大。吻合完成后開放主動脈、復溫,如非補片手術常規不予生物膠、止血紗處理吻合口。于左側腋中線第6或第7肋間置入胸腔引流管,隨后使肺復張,逐層關胸,手術結束。術后患者均送入ICU,予以呼吸機輔助通氣,持續監測上下肢血壓,維持水電解質及酸堿平衡,對血壓過高者予硝普納或硝酸甘油降壓。對合并肺炎或長時間呼吸機輔助通氣的患者使用抗生素抗感染治療。所有患者在術后24 h內復查床旁心臟彩超,出院前復查專科心臟彩超。
三、統計學分析
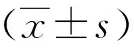
結 果
一、手術相關情況
所有患者經左后外側入路非體外循環下進行手術,大多數采用端端吻合術(52%),或擴大端端/端側吻合術(41%),自體心包補片及Gore-Tex人工補片擴大成形術各有2例,1例采用左鎖骨下動脈翻轉術。平均手術時間(141.3±37.3)min,主動脈阻斷時間10~62 min,主動脈平均阻斷時間(25.6±8.6)min。本組患者合并的心內畸形大多數為小型卵圓孔未閉、繼發孔型房間隔缺損或肌部室間隔缺損,缺損面積較小有自愈可能,多不予同期干預,并告知患者家長有行介入封堵手術的可能。1例4歲男性患者合并膜周部室間隔缺損、重度肺動脈高壓,術前右心導管檢查提示肺動脈收縮壓92 mmHg,且術前存在肺部感染,與家長充分溝通后決定分期手術。
二、術后早期結果
全組術后ICU平均停留時間(6.2±4.6)d,術后機械通氣時間的中位數與四分位間距為16.0(6.0,37.5)h,術后胸腔引流平均時間(5.4±3.9)d。全組術后早期無死亡病例,術后并發癥包括嚴重低心排血量綜合征4例,經強心、擴容、腹膜透析等治療后好轉;術后異常出血1例,急診行開胸探查止血;癲癇發作1例,頭顱CT檢查提示雙側大腦半球灰白質分界欠清、腦室豐滿,考慮與缺血缺氧所致皮層功能障礙有關,予以營養神經及康復治療后好轉;術后乳糜胸6例,經低脂飲食治療后痊愈拔管。全組患者出院前末次復查專科心臟彩超測得吻合口收縮期壓差(27.9±12.0)mmHg,較術前縮窄段收縮期壓差降低,差異有統計學意義(P<0.05)。與低齡組比較,高齡組患者手術時間、動脈阻斷時間、術后胸腔引流時間較長(P<0.05),術后ICU停留時間、術后呼吸機輔助通氣時間較短(P<0.05),見表1。

表1 兩組患者圍術期臨床資料對比Table 1 Comparison of perioperative clinical data of two groups項目例數手術時間[min,(x±s)]主動脈阻斷時間[min,(x±s)]術后ICU停留時間[d,(x±s)]術后機械通氣時間[h,M(P25,P75)]術后胸腔引流時間[d,(x±s)]出院前吻合口收縮期壓差[mmHg,(x±s)]低齡組39130.7±31.423.3±5.17.9±5.422.0(10.0,65.0)4.3±2.228.0±12.4高齡組30155.0±40.428.5±11.04.1±1.87.0(5.0,16.0)6.8±5.127.8±11.7t/Z值-2.8162.4054.1073.8852.5160.059P值-<0.05<0.05<0.05<0.05<0.05>0.05
三、隨訪結果
全組可查詢到出院后門診復查記錄的患者共63例,電話隨訪到59例,隨訪時間2~118個月,平均隨訪(49.9±31.8)個月,隨訪期間無一例死亡病例。末次隨訪吻合口收縮期壓差(21.4±10.0)mmHg。末次隨訪吻合口壓差>20 mmHg的患者19例,其中低年齡組11例(28.2%),高年齡組8例(26.7%),差異無統計學意義(χ2=0.02,P>0.05)。有14例壓差為20~40 mmHg,無明顯臨床癥狀,且左心功能未見明顯異常,股動脈搏動可,建議暫不處理繼續隨訪;5例吻合口壓差>40 mmHg,其中2例有明顯生長發育遲緩,行球囊擴張手術,再干預率為3.4%。其余3例無明顯臨床癥狀,門診密切隨訪。隨訪期間有3例發生高血壓且服用降壓藥物治療,門診繼續隨訪中。
討 論
自Crafoord 1945年首次報道主動脈縮窄手術以來,主動脈縮窄的治療已經取得了重大進展,然而其手術入路的選擇仍然存在爭論[7,8]。對于單純型主動脈縮窄,許多中心傾向于側開胸非體外循環下進行手術。而對于主動脈縮窄合并復雜心內畸形或主動脈弓發育不良,經胸骨正中入路在體外循環下進行手術仍為首選方式[9],因為經胸骨正中入路能夠很好地矯正主動脈弓發育不良及合并的其他心內畸形。然而胸骨正中手術需要在體外循環下進行,雖然手術及體外循環技術不斷發展,選擇性腦灌注在主動脈縮窄手術中已得到較廣泛應用,但仍給患者帶來神經系統損傷的風險[3]。側開胸手術避免了體外循環和深低溫停循環對患者的影響,能夠減少神經系統并發癥,這一點對新生兒和嬰兒尤為重要[10]。Mery等[11]對343例側開胸行主動脈縮窄根治術患者的回顧性研究顯示,圍術期病死率為1%,隨訪期間14例因再縮窄接受進一步治療,再干預率為4%。同樣,Farag等[3]對292例側開胸治療主動脈縮窄患者進行回顧性研究,發現圍術期病死率2%,術后再干預率為9.9%。本組患者圍術期無死亡病例,術后考慮再縮窄5例,再干預率3.4%,較既往研究的病死率和再干預率低。有研究表明術前合并主動脈弓發育不良可能會增加側開胸治療單純型主動脈縮窄術后發生再縮窄的風險,然而適用于側開胸治療的主動脈縮窄合并主動脈弓發育不良的主動脈具體測量值尚無統一標準[12,13]。
本組隨訪期間吻合口壓差>40 mmHg考慮再縮窄的5例中有1例合并遠端主動脈弓發育不良,1例合并全弓發育不良,手術均采用擴大端端吻合術。對于不涉及近端主動脈弓發育不良的患者可通過側開胸擴大端端吻合的方法來解決,對于合并全弓發育不良的患者側開胸手術可能會因為遺留發育不良的近端主動脈弓或吻合口張力過高增加術后再縮窄的風險,因此對此類患者更傾向于胸骨正中入路手術。本中心主動脈縮窄患者手術方式的選擇考慮到了伴隨的心內畸形的種類、主動脈縮窄的部位、嚴重程度、是否合并主動脈弓發育不良以及患者術前一般情況等因素。本組僅有7例術前合并主動脈弓發育不良,且合并的心內畸形均為較小的卵圓孔未閉、房間隔缺損或較小的肌部室間隔缺損,沒有引起血流動力學顯著改變的復雜心內畸形,這可能是本組患者術后死亡率及再干預率較低的原因。
本組患者的主要手術方式為主動脈端端吻合術、擴大端端或端側吻合術。主動脈端端吻合術是1944年Crafoord首次進行主動脈縮窄手術時使用的術式[7]。這種手術方式切除了狹窄段和導管組織,有利于降低術后再縮窄的發生率,且主動脈吻合過程中未使用人工合成材料完全為自體組織,具有生長潛能,但這種手術方式吻合口張力偏高,對縫合技術要求較高[14]。擴大端端或端側吻合術在自體組織基礎上進行修復,并擴充了主動脈橫弓,可很好地解決主動脈弓發育不良并減輕了吻合口張力。如今主動脈縮窄首選擴大端端吻合或端側吻合術,其再縮窄率較其他手術方式低,為4%~11%[15]。本組各有2例使用自體心包補片和Gore-Tex人工補片,這兩種補片技術可以應用于較長的縮窄段,避免了環狀吻合口,降低了術后再縮窄的發生率,但Gore-Tex補片為人工合成的聚四氟乙烯材料,沒有生長潛能且易發生假性動脈瘤。自體心包補片則避免了使用人工材料,彈性好,具有生長潛能且不易形成假性動脈瘤,為較理想的補片材料[16]。左鎖骨下動脈翻轉術雖然使用自體組織,但需要犧牲左鎖骨下動脈,易出現鎖骨下動脈盜血現象,可能影響左上肢的正常發育和功能,且該術式沒有完全切除狹窄段組織,術后再縮窄的可能性仍較大,本中心現已少用[15]。
本組患者男女比例約1.3∶1,男性患病率高于女性,與此前的研究相似[3]。組間比較顯示高齡組患者手術時間、主動脈阻斷時間、術后胸腔引流時間較低齡組長(P<0.05)。與低齡組患者相比,高齡組患者主動脈彈性較差,縮窄段較長,增加了主動脈吻合的難度,且隨著患者體重的增加,手術視野暴露困難,主動脈游離難度更大,手術范圍及創傷相應增加,因此手術時間、主動脈阻斷時間、術后胸腔引流時間明顯延長。由于本院1歲以下主動脈縮窄患者多為限期手術,如亞急診手術的新生兒或主動脈縮窄引起肺動脈高壓內科治療不能改善,生后反復肺部感染入院,因此術后呼吸機輔助通氣及ICU停留時間較高齡組長(P<0.05),但早期手術沒有增加患者術后病死率。嬰兒期主動脈縮窄患者容易發生嚴重的心力衰竭,有研究認為早期手術并不會增加術后發生高血壓及再縮窄的風險,術前是否合并主動脈弓發育不良對術后再縮窄的發生有更大的影響,因此年齡和體重不應作為早期手術的禁忌證[17,18]。本組中1例合并膜周部室間隔缺損、重度肺動脈高壓的患者術前存在肺部感染,將手術風險與家長充分溝通后選擇一期側開胸非體外循環下行主動脈縮窄根治術,出院后9個月于本院經胸骨正中切口體外循環下行室間隔缺損修補術,術后恢復良好,出院前復查心臟彩超吻合口壓差及肺動脈壓力較術前均明顯下降。對于主動脈縮窄合并其他心內畸形,目前普遍認為一期經胸骨正中切口體外循環下處理主動脈縮窄和心內畸形可達到滿意的治療效果,分期手術需要承擔兩次手術的風險,增加了住院時間,加重了家庭的經濟及心理負擔,且兩處切口對外觀也會有一定影響。然而對于術前一般情況差、手術和麻醉風險較高的患者,一期手術可能會給患者帶來更加嚴重的并發癥,因此術前需要醫生充分評估與溝通,選擇更適宜的手術方案。主動脈縮窄手術的主要目標是降低術后再縮窄及遠期高血壓的發生率。縮窄部位管腔直徑減少超過50%和(或)壓力階差超過20 mmHg常被作為手術和介入治療的指征[2]。本組有14例末次隨訪壓差在20~40 mmHg,心臟彩超顯示4例出現二尖瓣輕-中度反流,3例出現室間隔及左室后壁增厚,左心功能均未見明顯異常。壓差>40 mmHg的5例患者均存在不同程度的左心室肥厚及瓣膜反流,其中2例進行再干預。本研究認為若無明顯臨床癥狀且左心功能正常,無明顯下肢發育遲緩,即使主動脈縮窄段壓差>20 mmHg可暫不處理,繼續隨訪。本組有3例在隨訪期間出現高血壓且服用降壓藥物,這3例患者手術時平均年齡11歲5個月。既往研究認為術后遠期高血壓的發生率與手術年齡呈正相關,但近期有研究表明即使手術年齡趨于低齡化,術后高血壓的發生率也并未得到改善[19]。主動脈縮窄術后需要長期監測血壓,必要時進行藥物或手術干預,這對于提高患者遠期生存率及生活質量具有重要意義。綜上所述,經左后外側開胸非體外循環下行主動脈縮窄根治術治療單純型主動脈縮窄安全有效,中遠期預后較滿意。
本研究具有一些局限性。首先由于部分患者依從性的原因,術后未于門診規律復查,或由于醫療資源等原因缺少上下肢血壓的標準化測量數據,高血壓的發生率可能被低估。其次本研究為回顧性研究,缺少對照組,仍需要大樣本隨機對照研究來證實左后外側開胸非體外循環下主動脈縮窄手術的治療效果。

