雙能CT定量參數預測乳腺浸潤性導管癌病理分級的價值
楊帆,劉文罡,范園,潘雪琳,陳潔,孫家瑜
乳腺癌是嚴重威脅全球女性健康的惡性腫瘤,在女性癌癥中的致死率居第三位,僅次于肺癌和結直腸癌[1]。浸潤性導管癌(invasive ductal carcinoma,IDC)是乳腺癌中最常見的組織學類型,約占所有乳腺癌的80%[2]。其組織學分級是制訂治療方案的重要參考,在很大程度上影響患者的預后。乳腺癌診斷的金標準是病理活檢,但它為有創性且不能對乳腺腫瘤的整體分化程度進行評估,具有一定的局限性。MRI在乳腺癌的診斷中具有重要價值,但檢查時間長、要求患者配合度高,且對乳腺癌肺內轉移的顯示較困難。PET-CT和PET-MRI能很好地顯示乳腺腫瘤及轉移灶,但價格昂貴且設備的普及率較低。
雙能量CT(dual-energy CT,DECT)通過兩套球管高、低電壓(80和140 kVp)的瞬時切換,獲取雙能量成像數據。在常規CT高時間和空間分辨率的基礎上,增加了能量成像和物質分析,可提供除常規CT值之外的單能量圖像、能譜曲線、基物質圖像及有效原子序數等信息。能譜CT已廣泛應用于腫瘤的相關研究,為臨床診斷及治療提供幫助[3-5],但在乳腺癌方面的相關研究較少。本研究通過比較不同分化程度的浸潤性乳腺癌雙能量雙期增強CT定量參數(碘圖中碘濃度、相對碘濃度及能譜曲線的斜率)的差異及分析其與浸潤性導管癌組織學分級的相關性,旨在探討雙能量CT定量參數在乳腺癌術前分級中的應用價值。
材料與方法
1.研究對象
本研究經四川大學華西醫院倫理委員會批準(2020年審177號),所有患者簽署了知情同意書。搜集2019年7月-2020年3月在我院行雙能量CT胸部雙期(動脈期及靜脈期)增強檢查以排除肺內及縱膈、腋窩淋巴轉移的142例乳腺癌患者的病例資料[6]。納入標準:①CT檢查前無胸部放療史或乳腺手術史;②經穿刺活檢或手術病理證實的浸潤性導管癌且有組織學分級;③檢查后兩周內行穿刺活檢或手術病理活檢;④腫塊為單發病變的患者。排除標準:①病理分型為其它類型乳腺癌的患者,如粘液癌、浸潤性小葉癌等;②CT檢查前新輔助治療患者;③圖像偽影多,影響病灶觀察。
最終將符合條件的52例患者納入研究,均為女性,年齡21~84歲,平均(56.05±13.03)歲。乳腺癌的組織學分級是以腺管形成的比例、細胞核的多形性以及核分類象計數為指標進行評定,根據Nottingham組織學分級方法將浸潤性導管癌分為3級,I級為低度惡性,Ⅱ級為中度惡性,Ⅲ級為高度惡性[7]。本研究中組織學分級為Ⅱ級者31例,Ⅲ級者21例。
2.檢查方法
使用Siemens Somatom Definition Flash二代雙源CT機。患者取頭先進、仰臥位,掃描范圍自肺尖至肺底。動脈期和靜脈期增強掃描均采用雙能量掃描方式。掃描參數:80/140 kV,高、低管電壓融合系數0.3,89 mAs,CARE Dose 4D模式,準直器寬度64×0.6 mm,矩陣512×512,螺距0.55,0.28 s/r。對比劑為碘克沙醇(320 mg I/mL),劑量1.5 mL/kg,注射流率2.2~2.5 mL/s,采用對比劑團注跟蹤技術,監測ROI置于主支氣管分叉水平的胸主動脈內,達到閾值100 HU后延遲5 s啟動動脈期掃描,動脈期后延遲25 s進行靜脈期掃描。掃描完成后采用層厚1.0 mm、層距1.0 mm、迭代重建3級算法對雙期圖像分別進行重建。
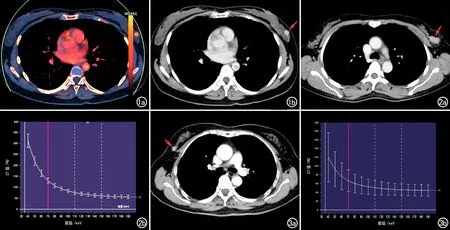
圖1 患者,女,46歲,浸潤性乳腺癌(組織學分級Ⅲ級)。a)靜脈期偽彩碘圖,在病灶和主動脈管腔內勾畫ROI;b)在同一層面的靜脈期增強圖像上測量病灶(箭)及主動脈的碘濃度。 圖2 浸潤性乳腺癌Ⅲ級。a)動脈期增強圖像,顯示左乳外上象限內有一明顯強化的結節影(箭),大小約1.8cm×1.2cm;b)動脈期病灶的能譜曲線圖,40~70keV時曲線呈陡直下降趨勢,曲線斜率為5.833。 圖3 浸潤性乳腺癌Ⅱ級。a)動脈期增強圖像,顯示右乳外上象限內有一強化結節影(箭),大小約0.9cm×0.6cm;b)動脈期病灶的能譜曲線圖,40~70keV時曲線呈下降趨勢,曲線斜率為1.733。
3.圖像分析
將雙期雙能量CT掃描重建圖像導入Siemens Syngo工作站進行圖像后處理。①在虛擬平掃程序中獲得碘圖,選取碘圖中病灶強化最明顯的層面,在病灶強化最顯著的區域及主動脈管腔的中心位置勾畫ROI(圖1),面積4~10 mm2,避開囊性壞死及脂肪區域,記錄病灶和主動脈的碘濃度(iodine concentration,IC)。②在單能譜程序中獲得病灶的能譜曲線,ROI的設置與碘圖相同,記錄病灶在40~140 keV不同單能級時的CT值。上述定量參數的測量由同一技師完成,每例患者的圖像測量3次取其平均值。計算病灶的標準化碘濃度(standardized iodine concentration,SIC)和能譜曲線斜率(slope of spectral curve,λ):
(1)
(2)
4.統計學分析
使用SPSS 22.0軟件進行統計學分析。計量資料的正態性檢驗采用Kologorov-Smirnov法,滿足正態分布的資料采用均數±標準差的形式進行描述,組間比較采用獨立樣本t檢驗。對定量資料與乳腺癌分化程度的相關性分析采Spearman秩和檢驗[8]。采用ROC曲線評價定量資料對兩種分化程度的鑒別診斷效能。以P<0.05為差異具有統計學意義。
結 果
1.不同分化程度IDC定量參數的比較
在動靜脈期雙能CT圖像上兩種組織學分級IDC的各項定量參數測量值及組間比較結果見表1、圖2。在雙期圖像中Ⅱ級和Ⅲ級IDC之間IC、SIC和λ值的差異均具有統計學意義(P<0.05)。

表1 兩種分化程度IDC之間定量參數值的比較
2.雙能CT定量參數與分化程度的相關性
浸潤性乳腺癌在雙期增強圖像上的各項定量參數與其分化程度的相關性分析結果見表2。動脈期中病灶的IC和λ值與分化程度之間呈中度正相關關系,SIC與分化程度之間呈弱正相關關系;靜脈期中病灶的IC、SIC和λ值與其分化程度之間均無顯著相關性(P>0.05)。

圖4 動脈期各項定量參數的ROC曲線,其中以λ的ROC曲線下面積最大,為0.794。
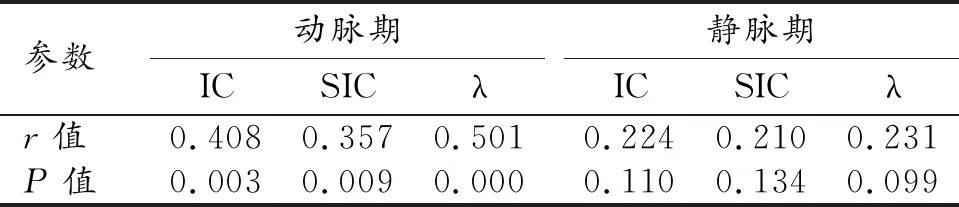
表2 IDC各定量參數與分化程度的相關性
3.雙能CT定量參數的診斷效能
動脈期圖像上3項定量參數的鑒別診斷效能指標見表3、圖4。其中以λ的ROC曲線下面積(0.794)最大,相應的敏感度為81.0%,特異度為67.7%。

表3 動脈期定量參數對兩種組織學分級的鑒別效能指標
討 論
DECT可以通過物質分離成像、能譜曲線以及單能量成像對腫瘤進行更加精確的定性定量分析[9]。CT增強掃描的原理是通過含碘的對比劑進入血管及病灶,使得病灶顯示更加清楚,增強后的碘濃度受病灶攝取能力及血供等因素的影響。DECT通過物質分離得到代表碘分布信息的圖像即碘圖[10]。碘圖能夠反映病灶的組織特性及其對碘的攝取能力等,較常規CT增強能更加全面地反映病灶等組織的特性。組織的物質組成不同其能譜曲線也不一樣,能譜曲線的斜率能夠區分不同組織的組成成分[11]。近年來使用雙能量CT定量參數來評估甲狀腺結節、肺結節、胃部病灶的良惡性及對腫瘤的惡性程度進行分級的相關研究較多[12-16],而聯合應用碘濃度和能譜曲線斜率來評估乳腺癌組織學分級的研究較少。本研究通過定量分析雙能CT掃描獲得的碘圖及能譜曲線與浸潤性乳腺癌組織學分級的關系,旨在評估雙能CT定量參數在乳腺腫瘤惡性程度評估方面的應用價值。
以往的研究結果表明,標準化碘濃度通過消除對比劑流率、總量、給藥速度及個體循環差異等因素的影響,可較準確地定量分析病灶內的碘含量,從而能更加客觀地反映病灶內的血供情況[17]。本研究結果顯示組織學分化程度為Ⅲ級的浸潤性導管癌的IC及SIC值均大于分化程度為Ⅱ級者。筆者推測可能是與惡性程度更高的腫瘤微血管密度和腫瘤新生血管增加更多、以及腫瘤血管對對比劑的通透性增加等因素有關。良性乳腺腫瘤內的血管走行多比較自然、均勻且細,而惡性腫瘤內的血管多走行扭曲、粗大且呈放射狀[18]。惡性程度越高,腫瘤生長速度越快,血供更加豐富。動脈期時腫瘤對碘的吸收處于快速上升期,兩種不同分化的IDC對于碘的吸收差異大,靜脈期時不同分化的腫瘤對碘的吸收均處于相對飽和狀態,但由于兩種分化的腫瘤本身對碘的吸收不同,故不同分化程度的腫瘤在靜脈期時的IC和SIC值還是存在一定差異。這也能夠很好地解釋為什么本組統計結果中動脈期的定量參數與浸潤性乳腺癌的分化程度之間存在統計學相關性。
能譜曲線的差異主要是與病灶本身物質不同對X線的吸收不同,以及病灶中碘對比劑對X線的吸收有關[19]。其中,低keV時可以將不同組織間的細微差異加以放大[20],故本研究中主要對40~70 keV時的能譜曲線斜率進行測量。本研究結果顯示,Ⅲ級乳腺癌在動靜脈期時的能譜曲線斜率高于Ⅱ級。惡性程度越高,能譜曲線的斜率更加陡直。其原因是惡性程度高的腫瘤本身組成物質有一定差異,同時血供也更加豐富,注射碘對比劑后對碘的吸收更多,就增強了不同組織分級腫瘤之間的差異。本研究中能譜曲線斜率的分析結果與陳文哲等[21]的研究結果相似。
本研究中選取碘圖中病灶信號強度最大的層面于病灶內強化最顯著的區域勾畫ROI,此處代表的是病灶代謝最活躍的區域,也是碘攝取量最多的區域。對浸潤性乳腺癌而言,因生長速度較快,腫瘤中心容易缺血、缺氧而形成液化壞死區或纖維化瘢痕區,此處的癌細胞密度較低且活性弱,故壞死或瘢痕區域對碘的攝取較少。有MRI研究表明乳腺癌組織邊緣區的早期強化率要高于中心區域,而腫瘤中心強化較弱區域的MVD值相對較低[22]。故本研究中通過勾畫碘圖中最亮層面及區域,即測量的是腫瘤內強化最顯著的區域,從而可避免勾畫到囊性壞死及癌細胞活性較弱的區域,使得能更獲得更準確的病灶參數的測量結果。
本研究中使用的第二代雙源CT機配備了能譜純化技術[23],且其兩個球管的電流均可單獨調制,使得輻射的利用效率最大化,輻射劑量最小化。另外,其自動管電流調制技術(CARE Dose 4D)和原始數據迭代重建技術均可致雙能量掃描技術達到最大程度以保證圖像質量和最優輻射劑量。此外,本研究中患者取仰臥位掃描,和乳腺癌術中體位一致,與MRI檢查中通常采用的俯臥位的體位相比,雙能量CT掃描更接近于手術體位,減少了圖像和病灶因為體位導致的偏差。美國國家癌癥綜合網絡(NCCN)指南中推薦將CT作為乳腺癌術前分期的檢查方法,尤其是在乳腺癌患者有咳嗽等呼吸系統癥狀時,故本研究中選取CT增強以排除肺內及淋巴轉移的患者符合倫理。
本研究存在的不足之處:納入病例的數量較少,缺少組織分化程度為I級的病例,可能存在樣本的選擇偏倚,我們將在今后的研究中進一步納入更多的樣本進行驗證;此外,沒有對其它雙能量定量參數如有效原子序數等進行分析。

