針刺緩解慢性神經病理性疼痛的作用機制研究進展 *
張文文 米文麗 王彥青△
(1 復旦大學基礎醫學院中西醫結合學系,上海 200032;2 復旦大學醫學院針刺原理研究所,上海200032)
神經病理性疼痛 (neuropathic pain, NP) 即由神經系統原發性損害和功能障礙所激發或引起的疼痛,是多種神經損傷疾病的主要臨床癥狀。臨床上慢性NP 常呈頑固性特點,可伴發睡眠障礙、焦慮、抑郁等神經精神性障礙,嚴重影響病人的生活質量。而NP 的一線治療藥物抗抑郁藥、抗驚厥藥等,以及二線用藥阿片類藥物等都存在療效欠佳、不良反應大等問題[1]。因此,有必要探索新的治療方法和策略。
針刺是中華民族的傳統瑰寶,針刺通過在特定的穴位予以刺激從而調理氣血、疏通經絡,起到驅散邪氣,扶助人體正氣的作用。針刺已在世界范圍內獲得廣泛認可,聯合國教科文組織在 2016 年將中醫針灸列入“世界人類非物質文化遺產代表作名錄”。對針刺的大規模臨床觀察結果已經證實針刺療法不良反應小且可控,是一種相對安全的物理治療方法[2]。除了傳統的手針治療外,電針也被廣泛應用于臨床治療和基礎研究。針刺對于NP 的治療效果已在臨床上得到普遍的肯定和廣泛的應用,與此同時,借助于不同的慢性NP 動物模型(見表1),針刺鎮痛的機制也被逐漸闡釋清楚,為臨床治療決策提供理論支持。本文聚焦于針刺緩解NP 的神經生物學機制,從外周至中樞全面總結了近年來針刺緩解NP 的研究成果,同時對針刺干預的穴位特異性、刺激強度等參數做了討論,以期為進一步探討針刺鎮痛機制提供參考和新的切入點。
NP 的發病原因可分為兩類,即外周神經系統損傷和中樞神經系統損傷。本文主要對近年來針刺緩解慢性NP 的鎮痛機制進行總結,重點論述針刺緩解外周神經系統損傷來源的NP。中樞疾病如卒中或外傷后NP 等疾病的機制有所不同,本文沒有涵蓋。
一、針刺緩解NP 的參數
針刺被廣泛應用于NP 的治療,但是不同的NP 模型取穴有所差異(見表2)。文獻報道,針刺足三里 (ST36)、陽陵泉 (GB34)、環跳 (GB30)對于坐骨神經慢性壓迫性損傷(constriction injury,CCI) 模型的鎮痛作用明顯,被廣泛應用于機制研究[3],此外針刺華佗夾脊穴(EX-B2)也被報道可緩解CCI 引起的NP[4]。針刺陽陵泉 (GB34)、環跳(GB30) 同時也被報道廣泛應用于帶狀皰疹后神經痛(postherpetic neuralgia, PHN)模型[5]。在糖尿病性周圍神經痛(diabetic peripheral neuropathic pain, DPNP)模型上,最常用的鎮痛穴位為足三里 (ST36)、昆侖(BL60)[6]。在坐骨神經分支部分損傷 (spared nerve injury, SNI) 和脊神經結扎 (spinal nerve ligation, SNL)模型上,最常用的穴位為足三里 (ST36)、三陰交(SP6)、陽陵泉 (GB34)、環跳 (GB30)[7],而委中(BL40)、昆侖 (BL60) 也被報道可有效緩解疼痛[8]。在化療誘導的神經性疼痛 (chemotherapy induced neuropathic pain, CINP) 模型上,針刺足三里 (ST36)以緩解奧沙利鉑引起的CINP[9],針刺環跳 (GB30)以緩解紫杉醇引起的CINP。總的來說,在不同NP模型實驗研究中,下肢的近端取穴在針刺緩解NP中呈主流方式,如足三里 (ST36)、陽陵泉 (GB34)、環跳 (GB30)。有趣的是,在脊髓損傷 (spinal cord injury, SCI) 模型上,除了陽陵穴 (GB34) 為近端下肢穴位,遠端取穴如水溝 (GV26)、內關 (PC6)、間使 (PC5) 等也被報道可緩解疼痛[10]。同側取穴和雙側取穴應用最為廣泛,也有文獻報道同側取穴與對側取穴均可以明顯緩解疼痛,且緩解程度無統計學差異[11]。
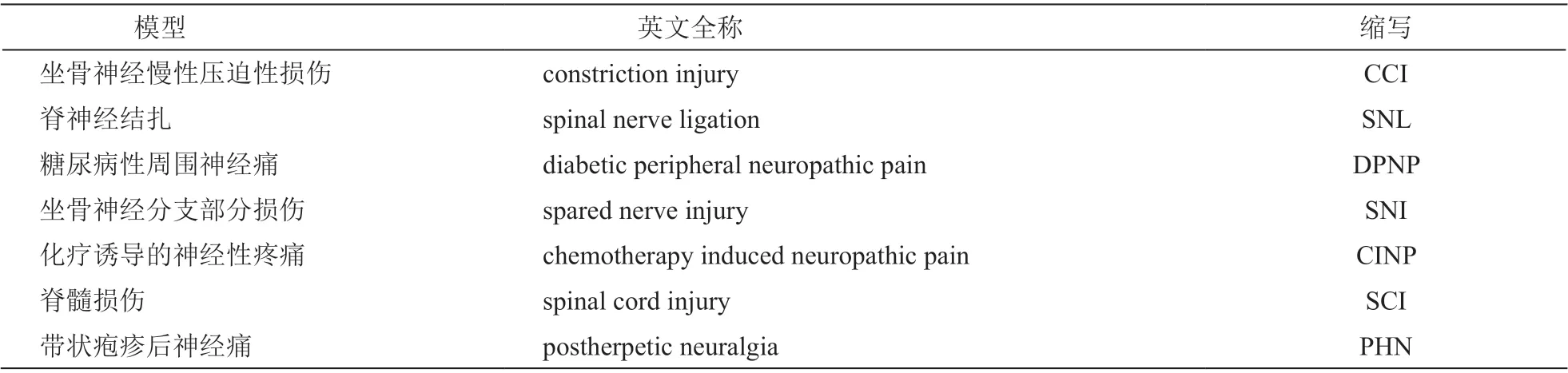
表1 慢性神經病理性疼痛動物模型
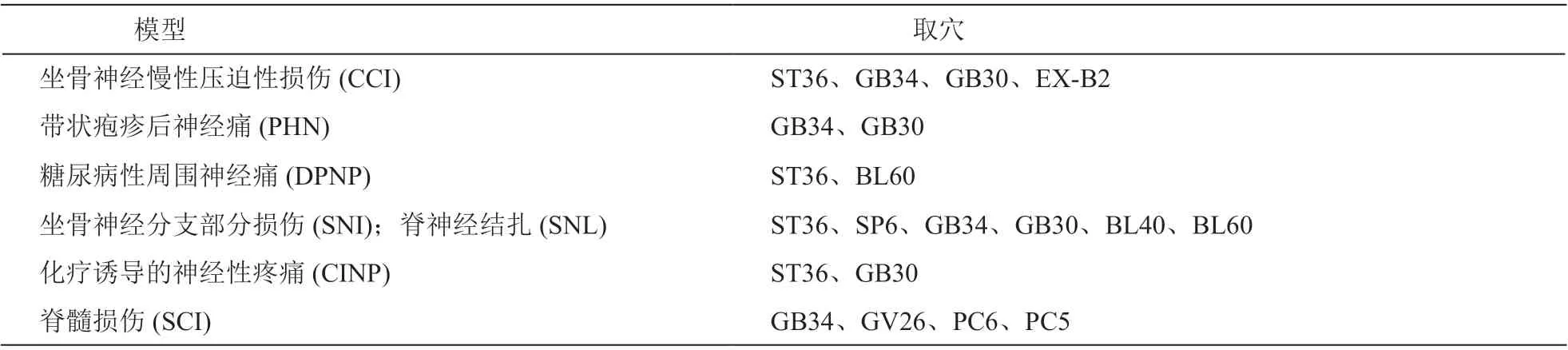
表2 神經病理性疼痛模型常用穴位
電針鎮痛作用與電針頻率有關 ,有研究報道低頻電針 (2 Hz) 和高頻電針 (100 Hz) 作用于不同類型的阿片肽及其受體,低頻電針可引起中樞釋放內啡肽和腦啡肽,作用于μ 受體和δ 受體,而高頻電針可增加脊髓強啡肽的釋放,作用于κ 受體[12]。另有報道觀察到不同頻率的電針可激活同一腦區的不同部位,如低頻電針可激活背側頂蓋前區前核(APtN),而高頻電針則可激活腹側APtN[13]。且在多種NP模型上,均觀察到低頻電針的作用相較于高頻電針而言更有效[9],此外“疏密波”(2 Hz/100 Hz 交替;2 Hz/60 Hz交替)的形式也被報道可明顯緩解疼痛[14]。
研究報道,強手針(捻針180 次/分)相較于弱手針(捻針60 次/分)對于NP 的治療效果更明顯,提示手針的強度與針刺鎮痛效果有關[15]。此外,電針刺激強度也與鎮痛效果有關。有研究報道較強的刺激能產生較好的鎮痛效果,但刺激強度不能無限度增加,以防出現強烈掙扎及明顯的應激[16],也有學者在實驗過程中以觀察到穴位周圍肌肉輕微顫動為標準來調整強度,應用于小鼠的普遍強度參數為1~2 mA,大鼠則可增加至3 mA,時長普遍為單次應用30 分鐘。每天1 次的針刺治療被廣泛報道緩解NP,也有報道隔日電針也可明顯緩解疼痛[17]。
關于針刺起效時間,研究報道在CCI 和SNI 模型上,于模型建立第3 天起給予針刺,在第1 次針刺后半小時即可觀察到痛閾改善,連續針刺7~14天,可觀察到穩定的鎮痛作用[3,7]。
此外,研究還發現不同小鼠品系也存在針刺鎮痛效果的差異,如2 Hz 電針時,DBA/2 小鼠品系和 BALB/c 小鼠品系顯著優于ICR 小鼠品系。此外針刺鎮痛還存在性別差異,研究報道在多個小鼠品系上,無論是低頻電針還是高頻電針,雌鼠的電針鎮痛效應優于雄鼠[16],在大鼠上也觀察到雌性鎮痛作用優于雄性,而這種性別差異可能與脊髓水平強啡肽鎮痛有關。
二、針刺緩解NP 的外周機制
外周敏化(peripheral sensitization)指感覺傳導通路對正常刺激的反應增強,同時對閾下刺激產生反應,發生痛覺超敏和痛覺過敏,在外周層面介導了NP 的發生。研究表明,周圍神經損傷可以通過多種不同途徑介導外周敏化,而針刺可通過影響外周敏化的不同環節來發揮鎮痛作用。有研究表明在CCI 大鼠足三里給予電針,穴位局部觀察到高遷移率族蛋白B1 及其受體CD24 (HMGB 1-CD24) 信號通路激活[18],且針刺可促進穴位處神經活性介質的釋放,以介導鎮痛作用,提示針刺可通過影響穴位局部起鎮痛作用。還有報道觀察到針刺可改善腕管綜合征引起的正中神經異常傳導[19],提示針刺可作用于感覺傳入軸突,改善軸突異位自發放電。
在背根神經節 (DRG) 與三叉神經節區域,神經元功能異常介導慢性NP 的發生發展,而電針可通過改善DRG 神經元功能異常介導鎮痛。一方面針刺通過影響DRG 神經元細胞膜上的受體或通道來發揮鎮痛作用,如電針可降低DRG 中N-甲基門冬氨酸受體1 (NMDAR1) 的mRNA 水平[20],低頻電針也可以通過抑制DRG 中瞬時受體電位香草酸亞型1 (TRPV1) 的表達上調來發揮鎮痛作用[21]。嘌呤受體在DRG 水平也參與針刺緩解NP,有報道顯示電針作用下,CCI 大鼠DRG 中嘌呤受體P2X3 表達降低[22],而在DPNP 中,電針也可以降低DRG 中的P2X3 受體和降鈣素基因相關肽 (CGRP)[7]。另一方面,針刺可通過調節疼痛相關的生物活性物質來鎮痛。本課題組研究發現電針可通過增加DRG 中的膠質細胞源性神經營養因子 (GDNF)起到鎮痛作用。而2 Hz 電針可通過下調DRG 的干擾素調節因子8 (IRF8)表達來抑制DRG 小膠質細胞的活化,進而抑制NP 的發生發展[23]。同時也可降低生長抑素(SOM)的mRNA 水平。還有文獻報道電針可通過阻斷DRG 中白細胞介素33 及其受體ST2 (IL-33/ST2)信號通路介導的炎性反應而發揮作用[24]。
越來越多的證據提示內源性阿片肽及其受體與針刺緩解NP 關聯密切,在外周和中樞神經系統中存在著四類主要的內源性阿片肽家族:內啡肽、腦啡肽、強啡肽以及孤啡肽,它們分別選擇性地與μ、δ、κ和孤啡肽受體結合[12]。在外周,有研究表明在CCI 大鼠足三里給予電針干預,可觀察到穴位局部的β-內啡肽表達增加[18]。另有研究觀察到,在奧沙利鉑誘導的CIPN 模型上,低頻電針 (2 Hz, 0.3 ms,0.2~0.3 mA) 可顯著緩解冷痛覺超敏,這種鎮痛效應可通過系統性給予阿片受體廣譜拮抗劑納洛酮阻斷,同時此研究觀察到電針可增加血漿中β-內啡肽水平[9]。而在紫杉醇誘導的CINP 模型上,單獨使用 μ 受體拮抗劑、δ 受體拮抗劑或κ 受體拮抗劑,均可以拮抗針刺鎮痛作用,提示μ、δ 和κ 受體均參與針刺緩解CINP 的作用。除此以外,有研究觀察到2 Hz 的電針治療可在SNL 模型上觀察到明顯的疼痛緩解現象,而手針在SNI 模型上也可觀察到明顯的鎮痛作用,且這種鎮痛作用均可以被系統性給予納洛酮所抑制[25]。提示內源性阿片肽及其受體也參與針刺緩解NP 的外周機制。
三、針刺緩解NP 的中樞機制
中樞敏化 (central sensitization) 是慢性NP 發生發展的重要機制,其表現為中樞神經系統傷害性感覺神經元對外周傳入的閾下或閾上刺激的反應增強。而神經遞質、膠質細胞等在中樞敏化的過程中發揮重要作用。同時內源性痛覺調制系統失調也是疼痛持續的另一重要因素,如痛覺下行抑制系統功能減弱,下行易化系統功能增強。針刺在緩解NP過程中,可從以上多方面入手,以改善中樞敏化為主要結果,抑制疼痛異常信號的傳導。
1. 阿片肽及其受體
在中樞,阿片肽及其受體也被廣泛報道參與針刺緩解NP。本課題組研究發現CCI 模型上,電針可通過增加中縫大核 (NRM) 中的孤啡肽 (OFQ) 表達來參與鎮痛。在脊髓層面,通過鞘內注射的方式,單獨使用μ 受體拮抗劑或者δ 受體拮抗劑時,均可觀察到對電針鎮痛的拮抗作用,提示脊髓μ 和δ 阿片受體參與針刺緩解NP,而κ 阿片受體是否參與則需要進一步探討。阿片受體的激活還可影響一些下游分子和受體的表達,近期有文獻報道電針激活阿片受體后,軸突導向因子 (Netrin-1) 表達降低。Netrin-1 有兩類受體家族,分別為軸突導向因子受體DCC 和UNC5H 家族,針刺鎮痛過程中,發揮興奮突觸作用的受體DCC 表達降低,而發揮突觸抑制作用的受體UNC5H2 表達增加,聯合作用以起到抑制脊髓中樞敏化的作用[17]。
2. 內源性痛覺調制系統
中樞內源性痛覺調制系統包括下行抑制和下行易化兩大部分。從功能上而言,下行抑制和下行易化系統是獨立存在的機能機構,而從解剖角度而言,這兩大系統并不是完全獨立的。內源性痛覺調制系統的關鍵核團主要為中腦導水管周圍灰質 (PAG) 和腦干延髓頭端腹內側區 (RVM),而前扣帶回 (ACC)、杏仁核以及下丘腦等腦區也在痛覺下行調制系統中起關鍵作用。
研究表明NP 小鼠表現為下行易化系統的激活,以及下行抑制系統的功能抑制,主要表現為PAG 和RVM 內不同類型神經元的功能失調最終引起中樞敏化。針刺可以通過作用于內源性痛覺調控系統的不同環節而起到緩解神經病理性疼痛的作用。在大鼠CCI 模型上,有文獻報道早期電針治療可緩解ACC腦區神經元中ERK1/2 的活化[15],在同樣的模型上,也有研究報道電針可降低PAG 區域P2X3 受體的表達,從而介導鎮痛作用。在CCI 模型上,針刺足三里和陽陵泉可顯著下調杏仁核中促腎上腺皮質激素釋放因子 (CRF) 受體基因[26]。除了內源性痛覺調制系統中的傳統腦區外,針刺還可以通過影響其他腦區以起到緩解NP,有研究觀察到電針可抑制海馬HMGB1 及其下游炎性細胞因子TNF-α 和 IL-1β 的表達,此外海馬乙酰膽堿毒蕈堿和煙堿受體 (mAChRs,nAChRs) 的表達增加也參與電針鎮痛,同時海馬絲裂原激活的蛋白激酶的激酶1 (MEK1) 的激活也被報道參與電針緩解NP[27]。
此外,腦干RVM 至脊髓5-HT 下行調控系統也被廣泛報道參與針刺鎮痛,有文獻報道電針可以明顯增加RVM 的5-HT 含量,增加的5-HT 通過作用于脊髓5-HT 1A 受體緩解痛覺過敏[17]。此外,還有文獻報道,在大鼠右尾干切除支配尾部的S1、S2脊神經,可引起明顯的冷痛覺超敏現象,而電針可緩解痛敏,且鞘內注射五羥色胺(5-HT)1A 受體拮抗劑以及5-HT 3R 拮抗劑可阻斷此現象。而在此模型上,給予鞘內注射α2 腎上腺素能受體拮抗劑也可以觀察到鎮痛現象的阻斷。以上提示在脊髓水平,內源性痛覺調制系統釋放5-HT 作為主要神經遞質參與脊髓中樞敏化而發揮下行調節作用,而其他單胺類神經遞質如去甲腎上腺素 (NE) 也參與其中。
3. 神經遞質及其受體
興奮性氨基酸類遞質和抑制性氨基酸類遞質也參與脊髓中樞敏化,脊髓中興奮性神經遞質谷氨酸含量減少,抑制性神經遞質甘氨酸、γ-氨基丁酸(GABA) 含量增加可介導NP 的緩解。有研究觀察到鞘內給予GABA (A) 或GABA (B) 受體拮抗劑可阻斷針刺鎮痛作用,電針華佗夾脊穴可增加GABA(A) 受體表達[4],這種作用可能與K+-Cl-協同轉運蛋白2 (KCC2) 有關,提示針刺可通過促進抑制性氨基酸神經遞質的釋放來起到鎮痛作用。同時,有報道觀察到在NP 模型上,電針可以抑制脊髓中NMDA 受體GluN1 的表達,增加谷氨酸轉運體1(GLT-1) 的表達[28],減少α-氨基-3-羥基-5-甲基-4-異惡唑丙酸(AMPA)受體的表達[29],共同起到減少興奮性突觸傳遞的作用。此外,也有報道表示針刺可通過抑制毒蕈堿M1 受體激活而鎮痛,同時針刺也可抑制脊髓嘌呤受體如P2X3 亞型、P2X4 亞型[30],且脊髓乙酰膽堿受體煙堿型乙酰膽堿受體(α7nAChR) 上調參與針刺鎮痛[7],提示其他神經遞質也參與針刺緩解脊髓中樞敏化的過程中。
綜上可知,神經遞質在針刺緩解疼痛的過程中發揮著關鍵的作用,而有趣的是,在此過程中不同腦區相同神經遞質的作用存在差異。有文獻報道在炎癥痛模型RVM 腦區,GABA 能神經元功能增加,從而加強了對5-HT 能神經元的抑制作用,以介導中樞敏化,增強疼痛信號傳導,而電針被報道可通過激活RVM 腦區GABA 能神經元上表達的μ 阿片受體而發揮降低GABA 釋放的作用[31]。而有報道表明在CCI 模型的PAG 與海馬區域,GABA 能神經元功能降低[32],同樣在脊髓層面GABA受體表達減少,對疼痛的傳導起到去抑制作用,而電針被觀察到可增加相應部位GABA 的表達,從而緩解疼痛。
4. 膠質細胞及細胞因子
針刺可通過調節脊髓膠質細胞的功能來發揮鎮痛作用。有文獻報道,電針可以顯著改善神經損傷引起的星形膠質細胞和小膠質細胞激活,同時脊髓中的基質金屬蛋白酶2 (MMP2)、MMP9 以及腫瘤壞死因子α (TNF-α)和白介素1β (IL-1β) 均在電針后減少。而在SNI 大鼠模型中,同樣可觀察到針刺對小膠質細胞激活的抑制作用,表現為減少小膠質細胞氧自由基,p38 絲裂原活化蛋白激酶 (p38 MAPK)以及細胞外信號調節酶的磷酸化,同時脊髓中的TNF-α、IL-1β、環氧合酶2 (COX-2)、白介素6 (IL-6)以及前列腺素2 (PGE2)等均被觀察到減少[33]。還有研究報道針刺可通過腺苷A1 受體,抑制脊髓星形膠質細胞激活和TNF-α 上調[34],且針刺也可抑制星形膠質細胞Jun 氨基末端激酶 (JNK) 的激活從而介導鎮痛作用。
5. 信號通路
針刺也可通過調控胞內信號通路發揮鎮痛作用。在大鼠CCI 模型上,本課題組研究發現NLRP1-Caspase-1-IL-1β 在疼痛發生過程中發揮重要作用,而電針可通過抑制脊髓該通路活化而參與疼痛緩解過程[14]。此外,電針還可通過阻斷脊髓小膠質細胞BDNF-TrkB 信號通路發揮作用[35]。也有報道在SNI大鼠上,電針可通過下調脊髓cAMP/PKA/CREB 信號通路而緩解疼痛[36],且脊髓CaMK II-CREB 信號通路也參與其中[37]。在SCI 大鼠上,電針可通過改善PI3K-mTOR 信號通路的激活來起到抑制作用[9]。同時脊髓背角ephrin-B/EphB 信號通路也參與電針緩解NP[38]。
6. 其他疼痛相關生物活性物質
在SNI 模型上,有文獻觀察到在電針作用下,脊髓NOS 表達減少。而另有文獻報道,在DPNP 中,電針可通過增加脊髓薄束核的一氧化氮合酶 (NOS)而鎮痛,因此NOS 在針刺鎮痛中的作用還有待進一步考究。在SNL 模型上,觀察到電針可通過減少脊髓COX-2 發揮鎮痛作用。還有研究觀察到脊髓背角細胞外信號調節激酶磷酸化 (p-ERK) 表達下調[39]。在PHN 大鼠模型上,有研究表明電針可通過降低脊髓血管內皮生長因子 (VEGF) 表達水平來緩解疼痛[5]。
7. 脊髓突觸可塑性
電針還可改善NP 動物脊髓背角突觸傳遞的長時程增強 (long-term potentiation, LTP) 現象。電生理結果顯示,在SNI 模型上,電針可以顯著抑制C 纖維誘發電位LTP 的形成,同時電針對LTP 的維持具有顯著的阻斷作用[40]。而在SNL 模型上也觀察到同樣結果,提示電針可通過改變脊髓背角神經元突觸可塑性來起到鎮痛作用。此外,還有研究者利用腦功能成像來研究針刺緩解NP 的腦區機制。有報道觀察到針刺可明顯緩解腕管綜合征病人的疼痛,與此同時,杏仁核功能活動減弱,而下丘腦功能活動增強,提示針刺可通過調節腦區功能緩解NP。
四、總結
本文主要從外周和中樞兩個方面綜述了近年來針刺尤其是電針在慢性NP 中的鎮痛作用機制。基于以上研究,本文總結電針可以通過影響DRG 神經元可塑性、阿片肽及其受體、內源性痛覺調制系統、膠質細胞及細胞因子、脊髓突觸可塑性以及其他生物活性物質來發揮緩解NP 的作用。
對于針刺緩解慢性NP 的脊髓上高位中樞以及腦神經環路機制,總結文獻發現與針刺緩解其他疼痛(如炎癥性疼痛)相比,針刺緩解NP 的神經環路機制研究較少且不明確,需要更多的研究投入,而近些年神經科學領域熱點技術飛速發展(如光遺傳、化學遺傳等),希望能為針刺緩解NP 機制的研究添加更強大的技術支持。本文通過文獻綜述,提出假想,尋找機制突破口,以期與同行共同探索未知機制。

