兔可食性組織中桿菌肽殘留量HPLC-MS/MS測定方法
聶貞,全家興,王美紅,張小龍,蔣玥,卜仕金
(揚州大學獸醫學院 江蘇省動物重要疫病與人獸共患病防控協同創新中心,江蘇 揚州 225009)
桿菌肽是由一組類似的多肽成分組成的混合物,其中桿菌肽A、B1和B2組分被認為最具抗微生物活性[1-2]。獸醫臨床上常見以桿菌肽鋅和桿菌肽亞甲基水楊酸鹽形式用于畜禽促生長和防治動物的壞死性腸炎[3-5]。在歐盟,亞甲基水楊酸桿菌肽還被推薦用于治療由產氣莢膜梭菌引起的兔壞死性腸炎。桿菌肽在豬和禽等主要生產動物的可食性組織中及奶中殘留量的檢測方法已有很多研究報道[6-10],但桿菌肽在兔的可食性組織中殘留量的檢測分析方法至今未見報道。因此,開展兔可食性組織中桿菌肽的殘留檢測方法研究,對桿菌肽今后推廣應用于家兔和指導臨床合理用藥具有重要的現實意義。研究旨在建立兔可食用組織(肌肉、脂肪、腎臟和肝臟)中桿菌肽殘留標志物的高效液相色譜串聯質譜聯用(HPLC-MS/MS)檢測法,為兔可食性組織中桿菌肽殘留的監控提供技術手段,這對保障人類消費者食用動物源性食品的安全性具有重要意義。
1 材料與方法
1.1 儀器和試劑 儀器:AB sciex Qtrap 6500plus三重四極桿串聯質譜儀;AB sciex ExionLCTMAC高效液相色譜儀;XBridge?C18色譜柱(2.1 mm×100 mm,3.5 μm);EppendorfCentrifuge 5810 R臺式高速冷凍離心機;QUINTIX124-1CN電子天平;上海滬西WH-1微型渦旋混合儀;Eppendorf可調移液器(10 μL、100 μL、5000 μL)。
試劑:甲醇、乙腈(色譜純,美國TEDIA公司);三氟乙酸(色譜純,上海MACKLIN公司);甲酸、氨水(色譜純,上海阿拉丁公司);三氯乙酸、正己烷(分析純,國藥集團化學試劑有限公司);桿菌肽標準品(桿菌肽A、B1、B2和B3總含量84.8%,桿菌肽A含量53.2%。批號:C10418000,購自德國Dr. Ehrenstorfer GmbH公司);水為符合GB/T 6682規定的一級水。
1.2 標準溶液配制 準確稱取約4.68 mg桿菌肽標準品,置10 mL容量瓶中,用0.1%甲酸甲醇溶解并定容至刻度,即配置濃度為0.4 mg/mL(以桿菌肽計)的儲備液,于-20 ℃冰箱中保存。準確吸取適量桿菌肽標準儲備液,用0.1%甲酸水溶液稀釋制備濃度為1000、10000 ng/mL的標準工作液,現配現用。
1.3 方法
1.3.1 液相色譜條件 XBridge?C18色譜柱(2.1 mm×100 mm,3.5 μm),流速:0.4 mL/min,柱溫:35 ℃,進樣量:5 μL,流動相:A為0.1%甲酸水,B為乙腈,梯度洗脫條件見表1。

表1 梯度洗脫條件
1.3.2 質譜條件 電噴霧離子源,正離子掃描,多反應監測(MRM),噴霧電壓5500.0 V,去簇電壓120.0 U/V,離子化溫度550 ℃,氣簾氣壓力30.0 Psi,碰撞室壓力8 Psi。根據桿菌肽離子掃描結果,確定監測離子對見表2。

表2 桿菌肽A、桿菌肽B定性、定量離子對及碰撞能
1.3.3 樣品前處理 準確稱取2.0(±0.01)g勻漿的兔組織樣品于50 mL離心管A內,加入2 mL 10%三氯乙酸乙腈溶液, 渦旋一分鐘,加入5 mL 0.5%三氟乙酸水,渦旋五分鐘,接著10000 r/min離心5 min,取上清至離心管B。重復提取一次,合并提取液上清于離心管B中。向離心管B中加入5 mL正己烷并10000 r/min離心5 min,棄去上層有機相以及中間乳化層,待凈化。將OASIS?PRiME HLB 3cc 150 mg固相萃取柱依次用5 mL甲醇和5 mL水活化后,將離心管B中處理完的樣品液過柱,待樣品液全部流出后,依次用3 mL氨水甲醇和3 mL 1%甲酸乙酸乙酯淋洗,微微抽干,用2 mL甲醇乙腈洗脫并抽干收集于10 mL指形管中。向指形管加入2 mL 0.1%甲酸水,混勻后過0.22 μm有機濾膜過濾,濾液待HPLC-MS/MS檢測。
1.4 定性方法 定性需滿足以下條件:①空白樣品中不出現與陽性對照相同的離子峰;②特征離子峰信噪比(S/N)≥3;③樣品中桿菌肽的保留時間與標準溶液保留時間的偏差在±2.5%之內;④定性離子對的相對豐度與濃度相當的基質標準的相對豐度一致,偏差滿足2002/657/EC[11]中的要求。
1.5 定量方法的確立
1.5.1 基質標準曲線的制備 制備空白肌肉、脂肪、肝臟和腎臟樣品各6份,經前處理后加入適量的標準工作液配成濃度為50、75、150、300、600、1000 ng/g的基質匹配標準溶液,在本試驗所建立的條件下,按照濃度從低至高的順序依次進樣。使用測得的桿菌肽特征離子峰面積作為縱坐標,對應的標準溶液濃度作為橫坐標,繪制基質匹配標準曲線。
1.5.2 檢測限、定量限的測定 用標準儲備液分別制備兔肌肉、脂肪、肝臟和腎臟的空白基質添加樣品,再按1.3項下的條件進行處理、分析,取S/N≥3時桿菌肽的濃度為方法的檢測限(LOD),S/N≥10時桿菌肽的濃度為定量限(LOQ),每個濃度5個平行。
1.5.3 準確度和精密度的測定 準確稱取2 g空白兔肌肉、脂肪、肝臟和腎臟,添加適量的桿菌肽標準工作液,使其濃度分別為50、100、300、800 ng/g。按照1.3.3的方法進行處理后,分別進樣5 μL進行HPLC-MS/MS測定。測定的結果帶入各自標準曲線中,與真實值比較,以計算回收率。每批次每濃度做6個平行樣品,共進行三個批次分三天完成。
2 結果與分析
2.1 方法專屬性 在優化的色譜條件下,桿菌肽標準品溶液中桿菌肽A出峰時間約為3.74 min,桿菌肽B的出峰時間約為3.56 min和3.68 min,峰型良好。見圖1和圖2。

圖1 標準品中桿菌肽A總離子流圖(桿菌肽50 ng/g)

圖2 標準品中桿菌肽B總離子流圖(桿菌肽50 ng/g)
對比兔的可食性組織(肌肉、脂肪、肝臟、腎臟)空白基質圖譜與空白基質添加桿菌肽標準品的圖譜,可以看出標準品中桿菌肽A、桿菌肽B都與基質雜質分離良好,互不干擾,可用于定量分析。掃描空白基質與空白基質添加藥物(50 ng/g)樣品中桿菌肽A定量離子對(711.6>199.1)的離子流圖見圖3~圖10,掃描空白基質與空白基質添加藥物(50 ng/g)樣品中桿菌肽B定量離子對(705.0>199.0)的離子流圖見圖11~圖18。

圖3 空白肌肉中桿菌肽A總離子流圖
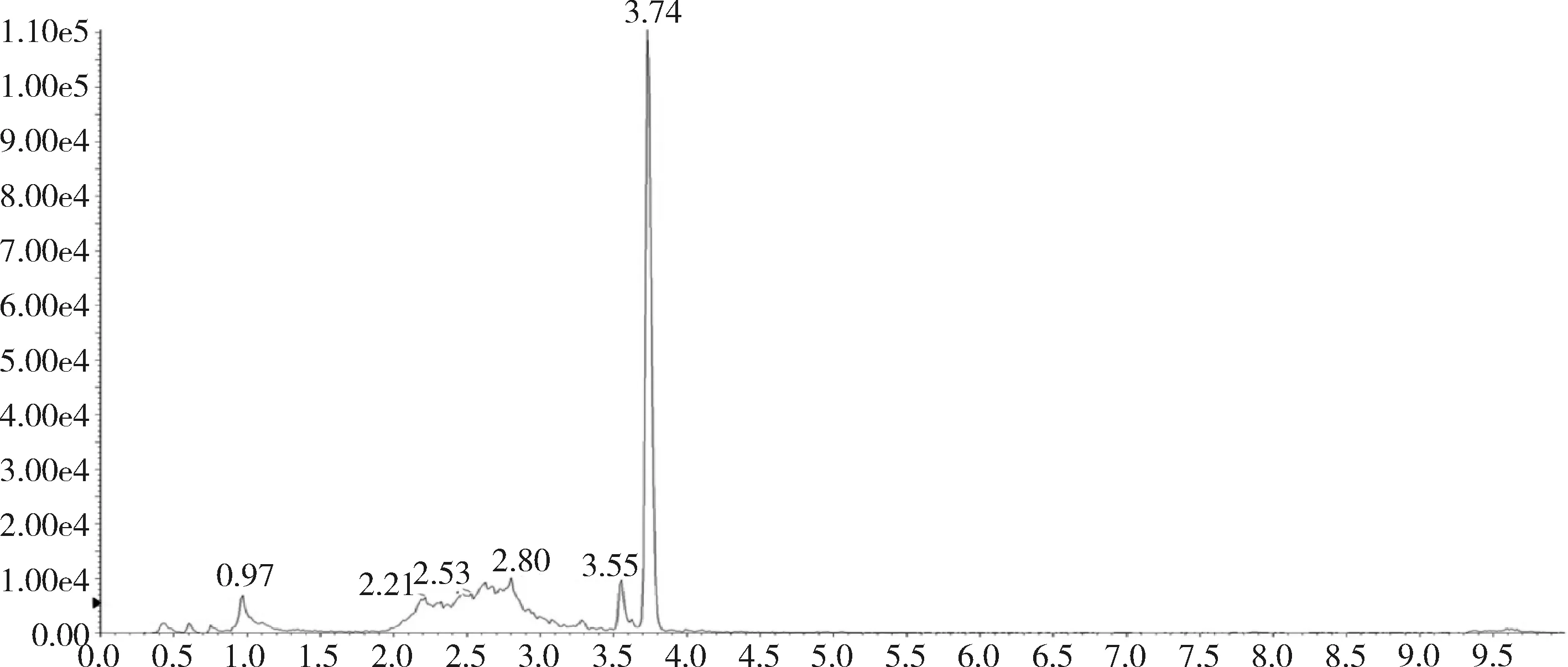
圖4 添加標準品的肌肉中桿菌肽A總離子流圖(桿菌肽50 ng/g)

圖5 空白脂肪中桿菌肽A總離子流圖

圖6 添加標準品的脂肪中桿菌肽A總離子流圖(桿菌肽50 ng/g)

圖7 空白腎臟中桿菌肽A總離子流圖

圖8 添加標準品的腎臟中桿菌肽A總離子流圖(桿菌肽50 ng/g)

圖9 空白肝臟中桿菌肽A總離子流圖

圖10 添加標準品的肝臟中桿菌肽A總離子流圖(桿菌肽50 ng/g)

圖11 空白肌肉中桿菌肽B總離子流圖

圖12 添加標準品的肌肉中桿菌肽B總離子流圖(桿菌肽50 ng/g)

圖13 空白脂肪中桿菌肽B總離子流圖

圖14 添加標準品的脂肪中桿菌肽B總離子流圖(桿菌肽50 ng/g)

圖15 空白腎臟中桿菌肽B總離子流圖

圖16 添加標準品的腎臟中桿菌肽B總離子流圖(桿菌肽50 ng/g)

圖17 空白肝臟中桿菌肽B總離子流圖
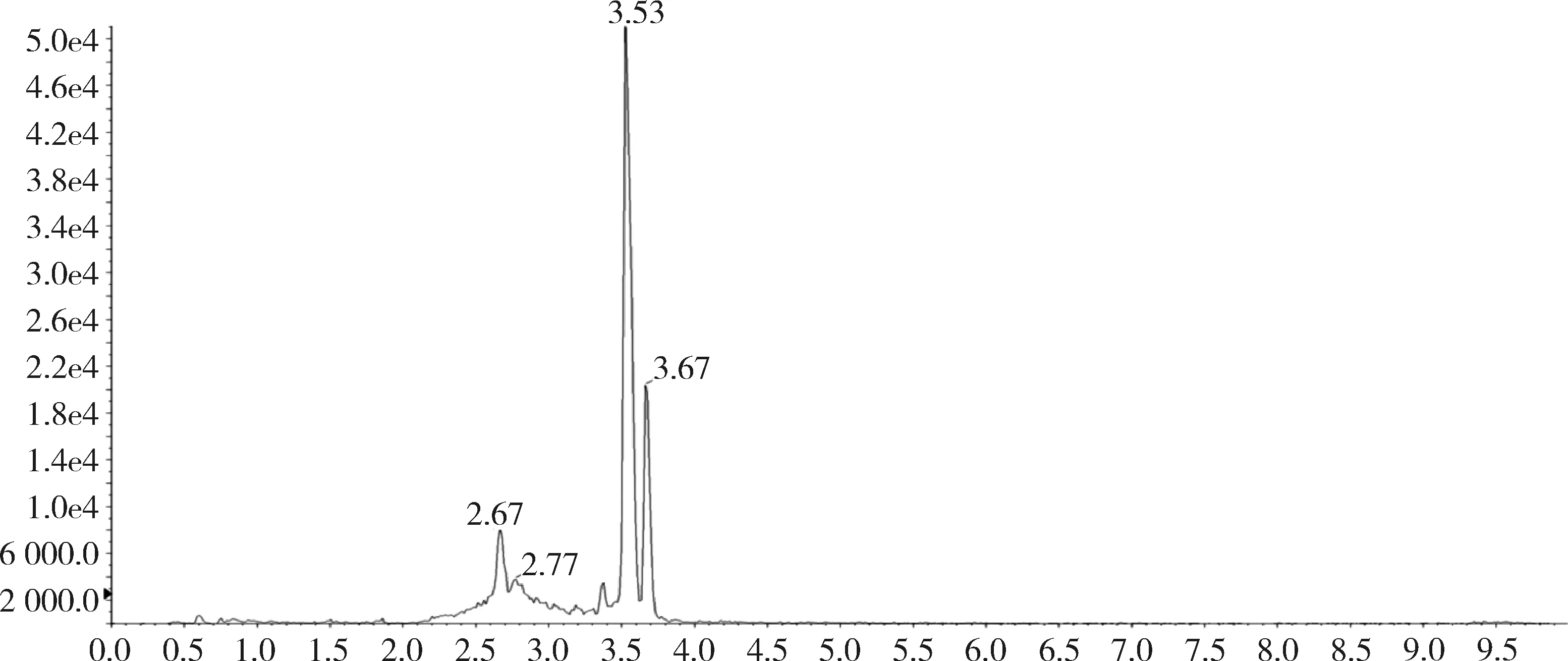
圖18 添加標準品的肝臟中桿菌肽B總離子流圖(桿菌肽50 ng/g)
2.2 線性結果 桿菌肽在50~1000 ng/g添加濃度范圍內,藥物濃度與峰面積呈良好的線性關系,線性回歸方程相關系數(R2)≥0.99 (見表3)。

表3 桿菌肽在兔可食性組織線性方程
2.3 檢測限(LOD)和定量限(LOQ) 取S/N≥3時濃度為最低檢測限,該方法檢測限為30 ng/g;根據精密度和準確度試驗結果,取信噪比S/N≥10時濃度為最低定量限為50 ng/g。
2.4 準確度和精密度 樣品中桿菌肽HPLC-MS/MS測定方法的結果表明,兔可食性組織中桿菌肽在50、150、300、800 ng/g四個添加水平下測定的平均回收率(以桿菌肽A與桿菌肽B之和計算)在74.7%~83.8%。見表4。
2.5 定性試驗 通過考察來源于6只不同兔的組織的測定結果,兔可食性組織中內源性雜質不干擾樣品中桿菌肽A、桿菌肽B含量的測定。基質添加標準品的桿菌肽A、桿菌肽B相對離子豐度符合2002/657/EC 規定的范圍要求。

表4 桿菌肽加標回收率與相對標準偏差(n=6)
3 討 論
3.1 前處理方法的優化 前處理條件優化中,通過比較0.5%甲酸甲醇水(1∶1)、0.5%甲酸甲醇乙腈(1∶1)、0.5%甲酸乙腈水(1∶1)、0.5%甲酸乙腈水(3∶7)、0.1%甲酸水等提取方法,并參照GB/T 20743-2006給出的方法凈化后進樣分析,結果顯示,采用0.5%甲酸甲醇水(3∶7)和0.5%三氟乙酸水提取能夠獲得較好的回收率,但需除雜凈化。優化后最終確定提取液為使用5 mL 0.5%三氟乙酸水提取2次。動物組織中含有大量的蛋白與脂肪,會嚴重影響HPLC-MS/MS系統的分析定量。目前對動物可食性組織或環境中桿菌肽提取液的凈化大多采用OASIS?HLB 3cc 60 mg或200 mg固相萃取柱凈化。試驗中比較了OASIS?HLB 3cc 60 mg、150 mg、200 mg,OASIS?PRiME HLB 3cc 60 mg、150 mg和Agilent Bond Elut-ENV 200 mg 3 mL幾種不同規格的固相萃取柱在6 mL水、3 mL甲醇:5%氨水溶液(V/V 20/80)加3 mL1%甲酸乙酸乙酯、3 mL甲醇:5%氨水溶液(V/V 10/90)加3 mL 1%甲酸乙酸乙酯等不同淋洗條件下的凈化效果,結果表明,在使用甲醇:5%氨水溶液(V/V 20/80)和1%甲酸乙酸乙酯作為淋洗液時,OASIS?PRiME HLB小柱表現得更好,能夠有效減少雜質且不會損耗過多桿菌肽。篩選洗脫液時,甲醇和乙腈差異不顯著。最終確定使用乙腈沉淀蛋白,正己烷除脂,OASIS?PRiME HLB 150 mg固相萃取柱凈化,淋洗條件為3 mL甲醇:5%氨水溶液(V/V 20/80)加3 mL 1%甲酸乙酸乙酯,洗脫液為2 mL甲醇乙腈(V/V 20/80),可獲得較好的回收率,且雜質不影響定量。
3.2 色譜條件的優化 在使用針泵進樣對桿菌肽標準品進行離子掃描時,桿菌肽離子化會出現不同的狀態,因此,在不同的實驗中會依照實驗條件選擇不同的電荷狀態。本試驗條件下,選擇桿菌肽雙電荷狀態即桿菌肽A的母離子質荷比為712、桿菌肽的B母離子質荷比為705時,具有更加穩定的響應值和更低的基線。因此本試驗在離子掃描時選擇雙電荷狀態作為桿菌肽特征離子。
大多數文獻報道中,液相條件都是使用甲酸水乙腈體系,偶有其他類型的流動相體系。在嘗試選擇對人危害較小且更加經濟的甲酸水甲醇體系時發現,桿菌肽在8 min的流動相體系中,雖然出峰時間約為2.8 min且具有較好的峰形和峰高,但與兔組織中的雜質峰嚴重重疊,干擾定量。進一步優化后,最終選擇依舊甲酸水乙腈體系,在該體系條件下可獲得較好的峰形,且不與雜質相互干擾,利于定量分析。
4 結 論
本試驗建立了兔可食性組織中桿菌肽的提取、凈化及含量的HPLC-MS/MS檢測法。兔可食性組織中桿菌肽殘留使用0.5%三氟乙酸水提取,10%三氯乙酸乙腈沉淀蛋白,正己烷除脂,固相萃取柱凈化,以0.1%甲酸水和乙腈為流動相進行梯度洗脫。質譜采用電噴霧離子源(ESI),正離子模式,多反應檢測(MRM)模式。結果表明,桿菌肽在50~1000 ng/g添加濃度范圍內,濃度與響應值之間線性關系良好,相關系數大于0.99,方法的檢測限為30 ng/g,定量限為50 ng/g。桿菌肽平均添加回收率在74.7%~ 83.8 %,批內批間變異系數均小于10%。依據EMEA規定的兔可食性組織中桿菌肽MRL標準,試驗制定的兔可食性組織中桿菌肽殘留標志物的HPLC-MS/MS測定方法,適用于兔可食性組織中桿菌肽殘留量。

