臨床試驗(yàn)機(jī)構(gòu)開(kāi)展ISO9001質(zhì)量管理體系認(rèn)證的意義及體會(huì)
吳建元,鄭 磊,楊有康,黃建英*
(1 武漢大學(xué)中南醫(yī)院臨床試驗(yàn)中心,武漢 430071;2 方圓標(biāo)志認(rèn)證集團(tuán)有限公司,北京 100048)
1 引言
臨床試驗(yàn)機(jī)構(gòu)作為檢驗(yàn)醫(yī)藥產(chǎn)品安全性和有效性最重要的研發(fā)責(zé)任部門之一,其質(zhì)量保證體系關(guān)乎醫(yī)藥產(chǎn)品的質(zhì)量,影響人民生命健康和社會(huì)穩(wěn)定,一直以來(lái)都是藥品監(jiān)管、衛(wèi)生健康和科學(xué)技術(shù)等主管部門監(jiān)管的重點(diǎn)。臨床研究強(qiáng)調(diào)全流程質(zhì)量控制管理,涵蓋藥物、醫(yī)療器械(含診斷試劑)、疫苗臨床試驗(yàn)以及干細(xì)胞、基因治療、體細(xì)胞臨床研究等。臨床試驗(yàn)研究開(kāi)展須嚴(yán)格遵守《中華人民共和國(guó)藥品管理法》《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》(GCP)《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》《干細(xì)胞臨床研究管理辦法(試行)》《涉及人的生物醫(yī)學(xué)研究倫理審查辦法》等一系列法律法規(guī),有著相對(duì)完善的監(jiān)管體系。隨著臨床試驗(yàn)機(jī)構(gòu)備案制的放開(kāi),越來(lái)越多的醫(yī)療機(jī)構(gòu)參與到臨床研究中。新機(jī)構(gòu)所面臨的體系建設(shè)不夠完善、質(zhì)量管理能力不足、團(tuán)隊(duì)協(xié)調(diào)程度不夠等問(wèn)題,以及老機(jī)構(gòu)在備案制新形勢(shì)下面臨的行業(yè)競(jìng)爭(zhēng)壓力增加、質(zhì)量管理要求提升等問(wèn)題,都值得行業(yè)深入研究和思考,而加強(qiáng)臨床試驗(yàn)質(zhì)量管理依舊是提升機(jī)構(gòu)競(jìng)爭(zhēng)力和綜合實(shí)力最重要的手段之一。
ISO是國(guó)際標(biāo)準(zhǔn)化組織(International Organization for Standardization)的英文簡(jiǎn)稱。ISO9001質(zhì)量管理體系在許多領(lǐng)域和學(xué)科均有應(yīng)用,目前發(fā)布的是質(zhì)量管理體系要求的最新標(biāo)準(zhǔn)ISO9001∶2015[1]。ISO9001質(zhì)量管理體系對(duì)產(chǎn)品和服務(wù)質(zhì)量的改進(jìn)和提高具有促進(jìn)作用[2],并可實(shí)現(xiàn)與其他體系的一體化,如臨床試驗(yàn)質(zhì)量管理體系等。通過(guò)管理體系的融合,可提高體系運(yùn)行協(xié)同性、提升內(nèi)部運(yùn)行效率、優(yōu)化資源配置、提高員工積極性。開(kāi)展ISO9001質(zhì)量管理體系認(rèn)證,可以不斷滿足顧客的質(zhì)量要求、改善管理流程和服務(wù)質(zhì)量、提升顧客滿意度。
本文以所在單位臨床試驗(yàn)機(jī)構(gòu)ISO9001∶2015質(zhì)量管理體系認(rèn)證為基礎(chǔ),通過(guò)對(duì)認(rèn)證流程的介紹,分享認(rèn)證體會(huì),淺要探討備案制新形勢(shì)下臨床試驗(yàn)機(jī)構(gòu)開(kāi)展ISO9001認(rèn)證的可行性和必要性,為同行質(zhì)量管理體系建設(shè)工作提供參考。
2 臨床試驗(yàn)機(jī)構(gòu)備案制現(xiàn)狀
2.1 藥物、醫(yī)療器械臨床試驗(yàn)機(jī)構(gòu)備案
在我國(guó)境內(nèi)開(kāi)展的藥物(含藥物以及按照藥物注冊(cè)申報(bào)的生物制品)、醫(yī)療器械(含診斷試劑)臨床試驗(yàn)應(yīng)當(dāng)在具備相應(yīng)條件的臨床試驗(yàn)機(jī)構(gòu)進(jìn)行。2017年11月15日,《醫(yī)療器械臨床試驗(yàn)機(jī)構(gòu)條件和備案管理辦法》[3](2017年第145號(hào))發(fā)布,明確了我國(guó)醫(yī)療器械臨床試驗(yàn)機(jī)構(gòu)實(shí)行備案管理,過(guò)渡期為2018年1月1日~2018年12月31日[4]。2019年11月29日,《藥物臨床試驗(yàn)機(jī)構(gòu)管理規(guī)定》[5](2019年第101號(hào))發(fā)布,代表著藥物臨床試驗(yàn)機(jī)構(gòu)備案制落地,自2019年12月1日起施行,過(guò)渡期為2019年12月1日~2020年11月30日[6]。臨床試驗(yàn)機(jī)構(gòu)備案制的實(shí)施,簡(jiǎn)化了機(jī)構(gòu)資質(zhì)申請(qǐng)流程,縮短了申請(qǐng)時(shí)限,同時(shí)也對(duì)機(jī)構(gòu)監(jiān)管和項(xiàng)目實(shí)施提出了更高的要求。機(jī)構(gòu)備案制很大程度上滿足了臨床試驗(yàn)各參與方的客觀需求,大量新機(jī)構(gòu)的成功備案將形成機(jī)構(gòu)競(jìng)爭(zhēng)機(jī)制,有利于促進(jìn)臨床試驗(yàn)行業(yè)的進(jìn)一步規(guī)范和整體研究水平的提升,特別是在創(chuàng)新藥物(如治療特殊疾病的孤兒藥)、生物制品和質(zhì)量管理方面[7],申辦方將有更多的選擇。截至2020年12月,已有1050家藥物臨床試驗(yàn)機(jī)構(gòu)和972家醫(yī)療器械臨床試驗(yàn)機(jī)構(gòu)完成備案。
2.2 干細(xì)胞臨床研究機(jī)構(gòu)及項(xiàng)目備案
我國(guó)干細(xì)胞臨床研究實(shí)行雙備案制度,即干細(xì)胞臨床研究機(jī)構(gòu)和干細(xì)胞臨床研究項(xiàng)目均需進(jìn)行備案。干細(xì)胞臨床研究實(shí)施應(yīng)當(dāng)符合《干細(xì)胞臨床研究管理辦法(試行)》[8]《干細(xì)胞制劑質(zhì)量控制及臨床前研究指導(dǎo)原則(試行)》[9]等法律法規(guī),且干細(xì)胞臨床研究機(jī)構(gòu)需備案,如藥物臨床試驗(yàn)機(jī)構(gòu)資格認(rèn)定證書、醫(yī)療機(jī)構(gòu)執(zhí)業(yè)許可證,干細(xì)胞臨床研究機(jī)構(gòu)的組織管理體系、人員架構(gòu)、標(biāo)準(zhǔn)操作規(guī)程(SOP)、設(shè)備設(shè)施、質(zhì)量管理和風(fēng)險(xiǎn)控制等文件。干細(xì)胞臨床研究項(xiàng)目則需要備案項(xiàng)目倫理審查、經(jīng)費(fèi)、研究團(tuán)隊(duì)、干細(xì)胞制備流程及工藝、研究方案、風(fēng)險(xiǎn)控制措施等內(nèi)容。干細(xì)胞臨床研究同臨床試驗(yàn)一樣,必須遵循科學(xué)、規(guī)范、公開(kāi)、符合倫理、充分保護(hù)受試者權(quán)益的原則,并在備案成功的干細(xì)胞臨床研究機(jī)構(gòu)開(kāi)展。截至2020年11月23日,我國(guó)完成備案的干細(xì)胞臨床試驗(yàn)機(jī)構(gòu)共計(jì)111家,完成備案的干細(xì)胞臨床研究項(xiàng)目共計(jì)100項(xiàng)。
2.3 臨床試驗(yàn)質(zhì)量管理體系與ISO9001質(zhì)量管理體系的聯(lián)系
臨床試驗(yàn)注重全流程質(zhì)量管理,臨床試驗(yàn)機(jī)構(gòu)應(yīng)建立符合自身發(fā)展的質(zhì)量管理體系。臨床試驗(yàn)質(zhì)量管理體系應(yīng)首要確定管理要素,制定機(jī)構(gòu)的質(zhì)量方針和詳細(xì)的管理目標(biāo)、編制管理體系文件。再依據(jù)管理體系文件實(shí)施項(xiàng)目管理發(fā)現(xiàn)其中的缺陷和問(wèn)題,進(jìn)一步改進(jìn)和優(yōu)化管理體系,從而不斷提升和完善研究質(zhì)量和水平。臨床試驗(yàn)質(zhì)量管理體系涵蓋機(jī)構(gòu)組織與人員、職責(zé)、質(zhì)量控制、培訓(xùn)與考評(píng)、試驗(yàn)用藥品和物資、臨床試驗(yàn)實(shí)施、文檔管理、安全性事件及風(fēng)險(xiǎn)管控等管理要素,貫穿試驗(yàn)項(xiàng)目接洽、實(shí)施和完成等全過(guò)程。機(jī)構(gòu)辦公室應(yīng)依據(jù)臨床試驗(yàn)相關(guān)法律法規(guī)及指導(dǎo)原則,制定完善可行的機(jī)構(gòu)管理體系文件,包括臨床試驗(yàn)管理制度、SOP、方案設(shè)計(jì)規(guī)范、應(yīng)急預(yù)案和職責(zé)分工等[10]。
ISO9001質(zhì)量管理體系同臨床試驗(yàn)質(zhì)量管理體系一樣,均沿用了戴明環(huán)循環(huán)(PDCA)[11]的管理思想,關(guān)注質(zhì)量管理體系的持續(xù)改進(jìn),可實(shí)現(xiàn)兩者體系的一體化。通過(guò)ISO9001質(zhì)量標(biāo)準(zhǔn)的引入實(shí)施,可使臨床試驗(yàn)質(zhì)量管理體系與國(guó)際化、標(biāo)準(zhǔn)化接軌,提高管理體系運(yùn)行的協(xié)同性和效率,改善機(jī)構(gòu)服務(wù)質(zhì)量和水平,從而提升項(xiàng)目管理水平和效率,擴(kuò)大機(jī)構(gòu)影響力和競(jìng)爭(zhēng)力。
3 ISO9001∶2015質(zhì)量管理體系建設(shè)標(biāo)準(zhǔn)和要求
3.1 ISO9001∶2015質(zhì)量管理標(biāo)準(zhǔn)核心概念
ISO9001∶2015質(zhì)量管理標(biāo)準(zhǔn)核心概念:① 過(guò)程方法。在臨床試驗(yàn)機(jī)構(gòu)建立和實(shí)施質(zhì)量管理體系并提高體系有效性時(shí),按過(guò)程對(duì)臨床試驗(yàn)活動(dòng)進(jìn)行管理,識(shí)別相關(guān)過(guò)程及關(guān)系進(jìn)行系統(tǒng)監(jiān)管。② PDCA循環(huán)。對(duì)過(guò)程及體系管理采取PDCA循環(huán)的方法,螺旋上升建立持續(xù)改進(jìn)的機(jī)制。③ 基于風(fēng)險(xiǎn)管理的思維。臨床試驗(yàn)機(jī)構(gòu)需策劃和實(shí)施應(yīng)對(duì)風(fēng)險(xiǎn)和機(jī)遇的措施,防止不合格的發(fā)生,提高質(zhì)量管理體系有效性,以達(dá)到預(yù)期的質(zhì)量目標(biāo)。
3.2 ISO9001認(rèn)證的意義
ISO9001認(rèn)證的意義:① 提高臨床試驗(yàn)機(jī)構(gòu)的對(duì)外形象。② 促進(jìn)臨床試驗(yàn)機(jī)構(gòu)的工作管理標(biāo)準(zhǔn)化、系統(tǒng)化、程序化,規(guī)范研究者臨床研究過(guò)程。③ 人員職責(zé)分工清晰,目標(biāo)考核管理明確,提高臨床研究的服務(wù)效率。④ 提升員工積極性,充分發(fā)揮人員優(yōu)勢(shì)。⑤ 增強(qiáng)相關(guān)方的信任,提高顧客滿意度。⑥ 降低臨床試驗(yàn)管理過(guò)程中質(zhì)量安全的差錯(cuò)、事故發(fā)生率,降低臨床研究成本。⑦ 建立臨床試驗(yàn)機(jī)構(gòu)自我改進(jìn)機(jī)制,培養(yǎng)部門管理者及研究者應(yīng)對(duì)風(fēng)險(xiǎn)和機(jī)遇的思維,充分識(shí)別相關(guān)方的需求和期望,預(yù)防不良事故和不符合要求的行為發(fā)生,持續(xù)滿足顧客要求及行業(yè)主管部門的要求。
3.3 體系建設(shè)和認(rèn)證流程
根據(jù)本機(jī)構(gòu)體系建設(shè)認(rèn)證情況,整理出臨床試驗(yàn)機(jī)構(gòu)開(kāi)展ISO9001∶2015質(zhì)量管理體系認(rèn)證流程,大致如下:
① 項(xiàng)目啟動(dòng)。確定機(jī)構(gòu)開(kāi)展ISO9001∶2015質(zhì)量管理體系建設(shè)認(rèn)證工作任務(wù),設(shè)立專項(xiàng)工作小組;配備有效的資源,確保體系建設(shè)和認(rèn)證過(guò)程中各方人員能配合工作開(kāi)展;并確定第三方認(rèn)證機(jī)構(gòu)及第三方認(rèn)證咨詢服務(wù)機(jī)構(gòu)(非必須)。
② 現(xiàn)狀調(diào)研。了解臨床試驗(yàn)機(jī)構(gòu)發(fā)展規(guī)劃、年度目標(biāo)及實(shí)施情況、經(jīng)營(yíng)管理過(guò)程中內(nèi)、外部環(huán)境、相關(guān)方需求與期望;明確機(jī)構(gòu)組織架構(gòu)、人員狀況和專業(yè)科室的職責(zé)、業(yè)務(wù)范圍、業(yè)務(wù)實(shí)現(xiàn)過(guò)程,并收集現(xiàn)行管理文件(管理制度、SOP及適用的法律法規(guī)等);了解臨床試驗(yàn)相關(guān)儀器設(shè)備管理狀況(醫(yī)療試驗(yàn)設(shè)備、監(jiān)測(cè)儀器等);對(duì)機(jī)構(gòu)質(zhì)量管理體系現(xiàn)狀進(jìn)行初步評(píng)估,為后續(xù)體系策劃提供參考。
③ 標(biāo)準(zhǔn)培訓(xùn)。對(duì)機(jī)構(gòu)、各專業(yè)科室、內(nèi)審員等相關(guān)人員開(kāi)展ISO9001∶2015標(biāo)準(zhǔn)培訓(xùn)、質(zhì)量管理體系文件編寫培訓(xùn)以及內(nèi)審員培訓(xùn),確保體系認(rèn)證相關(guān)人員均熟悉了解質(zhì)量管理標(biāo)準(zhǔn)和文件。
④ 體系策劃。組織機(jī)構(gòu)及專業(yè)科室人員識(shí)別內(nèi)外部環(huán)境因素、相關(guān)方及需求,識(shí)別臨床試驗(yàn)過(guò)程的風(fēng)險(xiǎn)、評(píng)估風(fēng)險(xiǎn)嚴(yán)重程度并制定相應(yīng)的應(yīng)對(duì)措施;確定ISO9001標(biāo)準(zhǔn)框架下的質(zhì)量管理體系文件框架(清單);制定機(jī)構(gòu)質(zhì)量方針和質(zhì)量目標(biāo);識(shí)別機(jī)構(gòu)核心業(yè)務(wù),確定關(guān)鍵和特殊過(guò)程。
⑤ 文件編寫。確定質(zhì)量管理體系文件編寫人員,必要時(shí)再次開(kāi)展培訓(xùn)。依據(jù)質(zhì)量管理體系文件清單,完成管理體系文件的編制、修改、評(píng)審、定稿、批準(zhǔn)和發(fā)布。對(duì)于已發(fā)布執(zhí)行的體系文件,應(yīng)加蓋受控標(biāo)識(shí);對(duì)于失效或廢除的體系文件,應(yīng)加蓋廢止標(biāo)識(shí)。體系文件應(yīng)具有統(tǒng)一、規(guī)律、唯一的文件編號(hào)。
⑥ 體系運(yùn)行。組織機(jī)構(gòu)和專業(yè)科室學(xué)習(xí)質(zhì)量管理體系文件(包含質(zhì)量目標(biāo)和方針),按照體系文件要求運(yùn)行質(zhì)量管理體系,并保存體系運(yùn)行相關(guān)記錄。
⑦ 體系內(nèi)審。編制年度內(nèi)部審核方案、內(nèi)審實(shí)施計(jì)劃、內(nèi)審檢查表、顧客滿意度測(cè)評(píng)程序等文件;組建內(nèi)審組,實(shí)施現(xiàn)場(chǎng)內(nèi)部審核;形成內(nèi)審報(bào)告,提出不合格項(xiàng)及整改要求,并督促相關(guān)責(zé)任科室和人員按照要求制定和實(shí)施不合格項(xiàng)糾正措施。
⑧ 管理評(píng)審。編制管理評(píng)審計(jì)劃,編寫管理評(píng)審報(bào)告,組織召開(kāi)管理評(píng)審會(huì)議,根據(jù)評(píng)審結(jié)論組織制定改進(jìn)措施并付諸實(shí)施。管理評(píng)審會(huì)議應(yīng)當(dāng)由最高管理者主持(一般為臨床試驗(yàn)機(jī)構(gòu)負(fù)責(zé)人),評(píng)價(jià)機(jī)構(gòu)質(zhì)量管理體系的符合性、充分性和有效性,提出改進(jìn)的措施。
⑨ 認(rèn)證審核。確定第三方認(rèn)證機(jī)構(gòu),按照要求遞交資料,申請(qǐng)質(zhì)量管理體系認(rèn)證;接受認(rèn)證機(jī)構(gòu)現(xiàn)場(chǎng)審核,包括管理體系一階段審核和二階段審核。機(jī)構(gòu)應(yīng)確認(rèn)審核評(píng)價(jià)中的不合格項(xiàng),并積極組織整改。
認(rèn)證機(jī)構(gòu)通過(guò)管理體系一階段審核:了解機(jī)構(gòu)管理體系的基本情況;確認(rèn)機(jī)構(gòu)文件所述的體系與審核準(zhǔn)則的符合性/適宜性;收集機(jī)構(gòu)管理體系范圍、過(guò)程和場(chǎng)所等信息;確認(rèn)機(jī)構(gòu)管理體系實(shí)施程度,是否做好第二階段審核準(zhǔn)備工作;策劃第二階段審核的關(guān)注點(diǎn)(包括第二階段審核所需人員、時(shí)間等)。
管理體系二階段審核:評(píng)價(jià)機(jī)構(gòu)在擬認(rèn)證范圍內(nèi)的管理體系與審核準(zhǔn)則的符合性及體系運(yùn)行的有效性。
⑩ 監(jiān)督檢查。ISO9001∶2015質(zhì)量管理體系初次認(rèn)證有效期為3年,效期內(nèi)開(kāi)展年度監(jiān)督檢查,到期后開(kāi)展復(fù)評(píng)認(rèn)證;機(jī)構(gòu)應(yīng)定期組織專人負(fù)責(zé)審核工作。此外,對(duì)于擬增加認(rèn)證范圍的機(jī)構(gòu),可申請(qǐng)擴(kuò)大認(rèn)證范圍審核;對(duì)于變化的過(guò)程,機(jī)構(gòu)要進(jìn)行策劃和控制,確保變化的過(guò)程風(fēng)險(xiǎn)的識(shí)別與評(píng)價(jià),職責(zé)和資源得到分配和獲得。認(rèn)證機(jī)構(gòu)在例行監(jiān)督審核時(shí)對(duì)變化的過(guò)程及管理體系符合性的保持進(jìn)行審核。臨床試驗(yàn)機(jī)構(gòu)申請(qǐng)認(rèn)證范圍一般為藥物臨床試驗(yàn)(Ⅰ~Ⅳ期)、醫(yī)療器械和體外診斷試劑臨床試驗(yàn)、研究者發(fā)起的臨床研究(IIT)或干細(xì)胞臨床研究等。
3.4 質(zhì)量管理體系文件架構(gòu)
質(zhì)量管理體系文件一般包括以下4個(gè)部分:質(zhì)量手冊(cè)、程序文件、臨床試驗(yàn)管理文件(管理制度、SOP、應(yīng)急預(yù)案、設(shè)計(jì)規(guī)范等)、體系運(yùn)行記錄文件(證據(jù))等。體系文件效力層級(jí)見(jiàn)圖1。
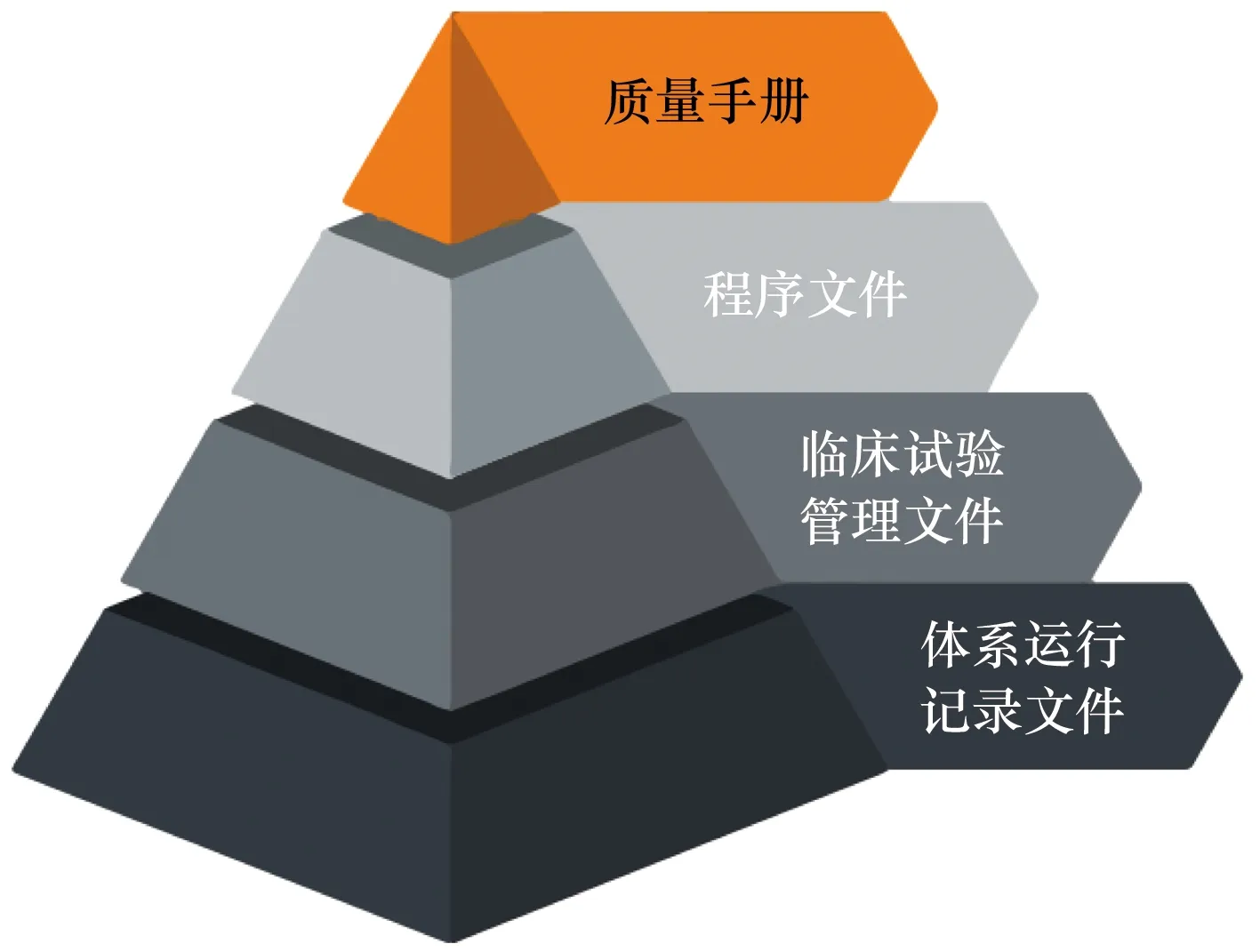
圖1 質(zhì)量管理體系文件架構(gòu)圖
質(zhì)量手冊(cè)對(duì)機(jī)構(gòu)的質(zhì)量方針和質(zhì)量目標(biāo)進(jìn)行了歸納提煉,并闡述了機(jī)構(gòu)質(zhì)量管理體系過(guò)程順序和相互作用,是機(jī)構(gòu)質(zhì)量管理的法規(guī)性文件,也是臨床試驗(yàn)人員從事質(zhì)量管理工作的行為準(zhǔn)則,更是機(jī)構(gòu)持續(xù)改進(jìn)質(zhì)量管理體系的依據(jù)。全體臨床試驗(yàn)相關(guān)人員應(yīng)當(dāng)認(rèn)真學(xué)習(xí)并貫徹執(zhí)行。質(zhì)量手冊(cè)組織框架與ISO9001質(zhì)量管理體系章節(jié)一致,可視機(jī)構(gòu)實(shí)際情況進(jìn)行撰寫、增加或刪除。質(zhì)量手冊(cè)應(yīng)當(dāng)在執(zhí)行過(guò)程中,不斷根據(jù)內(nèi)外部環(huán)境變化進(jìn)行評(píng)審、修改和完善。
程序文件是機(jī)構(gòu)質(zhì)量管理體系中確定的核心業(yè)務(wù)及關(guān)鍵過(guò)程的規(guī)范性描述,也是機(jī)構(gòu)重要管理事項(xiàng)應(yīng)當(dāng)嚴(yán)格遵守的準(zhǔn)則。程序文件一般包括知識(shí)管理程序、文件管理程序、記錄管理程序、臨床試驗(yàn)過(guò)程管理程序、受試者管理程序、顧客滿意度測(cè)評(píng)程序、內(nèi)部審核管理程序、管理評(píng)審程序、不合格和糾正措施管理程序等文件。程序文件可視機(jī)構(gòu)管理體系的實(shí)際情況進(jìn)行編制。
臨床試驗(yàn)管理文件,即機(jī)構(gòu)目前現(xiàn)行的管理類文件,包括臨床試驗(yàn)管理制度、SOP、應(yīng)急預(yù)案及方案設(shè)計(jì)規(guī)范等。臨床試驗(yàn)管理文件是臨床試驗(yàn)機(jī)構(gòu)備案所需的制度文件,機(jī)構(gòu)應(yīng)建立適應(yīng)自身建設(shè)運(yùn)行的管理文件體系,并根據(jù)法律法規(guī)及內(nèi)外部環(huán)境變化進(jìn)行修訂完善。臨床試驗(yàn)管理文件應(yīng)具備合規(guī)性、必要性、適用性和科學(xué)性,但并非越多越好。
體系運(yùn)行記錄文件,即體系管理文件中規(guī)定的記載質(zhì)量管理過(guò)程性數(shù)據(jù)的記錄文件,體系運(yùn)行記錄相關(guān)表格應(yīng)當(dāng)在質(zhì)量手冊(cè)、程序文件或臨床試驗(yàn)管理文件中進(jìn)行描述,其編號(hào)應(yīng)統(tǒng)一編制。體系運(yùn)行記錄為臨床試驗(yàn)管理過(guò)程中的原始記錄,應(yīng)當(dāng)遵守“沒(méi)有記錄就沒(méi)有發(fā)生”的原則。
4 ISO9001∶2015質(zhì)量管理體系認(rèn)證對(duì)機(jī)構(gòu)建設(shè)發(fā)展的優(yōu)勢(shì)
① 領(lǐng)導(dǎo)支持。ISO9001∶2015質(zhì)量管理體系第五章“領(lǐng)導(dǎo)作用”,要求臨床試驗(yàn)機(jī)構(gòu)負(fù)責(zé)人對(duì)建立、實(shí)施和持續(xù)改進(jìn)質(zhì)量管理體系提供保障,達(dá)到率先垂范、總體策劃、統(tǒng)籌謀劃等要求,保證了醫(yī)院決策層對(duì)質(zhì)量管理體系建設(shè)工作的參與度和重視度。此外,《管理評(píng)審程序》要求機(jī)構(gòu)應(yīng)當(dāng)定期開(kāi)展管理評(píng)審工作,并規(guī)定了管理評(píng)審的策劃、準(zhǔn)備、輸入、實(shí)施、輸出等內(nèi)容,這與機(jī)構(gòu)臨床試驗(yàn)管理體系的質(zhì)量控制工作類似。不同的是,ISO9001∶2015質(zhì)量管理體系管理評(píng)審要求臨床試驗(yàn)機(jī)構(gòu)負(fù)責(zé)人必須參與,且應(yīng)簽署管理評(píng)審計(jì)劃和管理評(píng)審報(bào)告,并主持質(zhì)量管理體系評(píng)審活動(dòng)。這些機(jī)制能促進(jìn)決策層對(duì)臨床試驗(yàn)管理體系的深入了解,提升決策層對(duì)臨床試驗(yàn)工作的重視程度,有利于醫(yī)院臨床試驗(yàn)工作的進(jìn)一步發(fā)展。
② 風(fēng)險(xiǎn)管控。ISO9001∶2015質(zhì)量管理體系第六章“策劃”,要求機(jī)構(gòu)應(yīng)充分考慮內(nèi)外部環(huán)境因素、相關(guān)方及其需要和期望,并通過(guò)對(duì)風(fēng)險(xiǎn)的評(píng)估確定需要應(yīng)對(duì)的風(fēng)險(xiǎn)和機(jī)遇,以增強(qiáng)有利影響,改進(jìn)體系不足,確保質(zhì)量管理體系實(shí)現(xiàn)預(yù)期目標(biāo),并盡可能避免或減少不利影響。此外,還要求機(jī)構(gòu)及專業(yè)科室將年度質(zhì)量目標(biāo)分解到各部門和專業(yè),通過(guò)監(jiān)督、檢查和質(zhì)量控制措施開(kāi)展自評(píng),對(duì)目標(biāo)完成情況進(jìn)行督查,以確保分解后的質(zhì)量目標(biāo)達(dá)到預(yù)期。這一風(fēng)險(xiǎn)管控及目標(biāo)分解機(jī)制有助于機(jī)構(gòu)及專業(yè)科室充分剖析自身不足,明確未來(lái)發(fā)展方向,增強(qiáng)體系適應(yīng)能力,穩(wěn)定地提供滿足顧客要求及法律要求的臨床試驗(yàn)服務(wù)。
③ 內(nèi)審機(jī)制和不合格項(xiàng)糾正措施。《內(nèi)部審核管理程序》要求機(jī)構(gòu)應(yīng)當(dāng)定期開(kāi)展內(nèi)部審核工作,并規(guī)定內(nèi)審的計(jì)劃實(shí)施、不合格項(xiàng)的開(kāi)具、整改追蹤等內(nèi)容。對(duì)于新機(jī)構(gòu)或部分質(zhì)量管理體系建設(shè)不夠完善的老機(jī)構(gòu)而言,其質(zhì)量控制容易出現(xiàn)浮于表面的情況,即質(zhì)量控制中發(fā)現(xiàn)的問(wèn)題常常得不到專業(yè)科室的及時(shí)解決,或是整改內(nèi)容僅存在于紙面上。但I(xiàn)SO9001∶2015質(zhì)量管理體系采取PDCA循環(huán)的思想制定《不合格和糾正措施管理程序》,要求對(duì)機(jī)構(gòu)不合格問(wèn)題進(jìn)行評(píng)審、糾正和跟蹤驗(yàn)證,并需要提供佐證材料,以及項(xiàng)目負(fù)責(zé)人和質(zhì)量負(fù)責(zé)人的再次審核。這一機(jī)制很大程度上保證了不合格項(xiàng)得到真正意義上的解決,有助于持續(xù)改進(jìn)質(zhì)量管理體系的不足和問(wèn)題,增強(qiáng)體系的有效性和實(shí)用性。
④ 顧客滿意度測(cè)評(píng)。《顧客滿意度測(cè)評(píng)程序》是ISO9001∶2015質(zhì)量管理體系關(guān)注的重點(diǎn)。機(jī)構(gòu)所服務(wù)的顧客,對(duì)外為臨床試驗(yàn)申辦方和受試者;對(duì)內(nèi)為臨床試驗(yàn)研究者。這與藥物臨床試驗(yàn)質(zhì)量管理規(guī)范(GCP)關(guān)注受試者權(quán)益保護(hù)和機(jī)構(gòu)管理職責(zé)內(nèi)涵一致。《顧客滿意度測(cè)評(píng)程序》規(guī)定了機(jī)構(gòu)應(yīng)當(dāng)對(duì)顧客滿意或不滿意的信息進(jìn)行收集、統(tǒng)計(jì)分析以及測(cè)評(píng)等,并要求機(jī)構(gòu)對(duì)顧客不滿意的內(nèi)容進(jìn)行持續(xù)改進(jìn)、彌補(bǔ)不足,最終達(dá)到顧客滿意。這一思想有助于機(jī)構(gòu)深入了解內(nèi)外部環(huán)境變化及顧客需求,并以此不斷改進(jìn)機(jī)構(gòu)的服務(wù)質(zhì)量,完善質(zhì)量管理體系,持續(xù)提升機(jī)構(gòu)競(jìng)爭(zhēng)力,為機(jī)構(gòu)管理實(shí)踐提供參考。
5 討論
目前,國(guó)內(nèi)僅有為數(shù)不多的臨床試驗(yàn)機(jī)構(gòu)選擇開(kāi)展ISO9001∶2015質(zhì)量管理體系認(rèn)證。但隨著質(zhì)量管理體系建設(shè)的重要性不斷上升,為不斷提高質(zhì)量管理水平,業(yè)內(nèi)越來(lái)越多的單位選擇ISO9001∶2015質(zhì)量管理體系認(rèn)證,如國(guó)家藥品監(jiān)督管理局食品藥品審核查驗(yàn)中心、國(guó)家藥典委員會(huì)、上海藥品審評(píng)核查中心、湖北省藥品監(jiān)督管理局技術(shù)審評(píng)核查中心、江蘇省食品藥品監(jiān)督管理局認(rèn)證審評(píng)中心等審評(píng)機(jī)構(gòu),華中科技大學(xué)同濟(jì)醫(yī)學(xué)院附屬同濟(jì)醫(yī)院、中國(guó)醫(yī)學(xué)科學(xué)院血液病醫(yī)院、天津中醫(yī)藥大學(xué)第二附屬醫(yī)院臨床藥理科I期病房等臨床試驗(yàn)機(jī)構(gòu),以及北京經(jīng)緯傳奇醫(yī)藥科技有限公司等臨床試驗(yàn)第三方稽查機(jī)構(gòu)。ISO9001是國(guó)際認(rèn)可的質(zhì)量管理認(rèn)證體系,質(zhì)量管理體系的成功認(rèn)證是體現(xiàn)機(jī)構(gòu)具備提供臨床試驗(yàn)全流程質(zhì)量管理服務(wù)能力的國(guó)際標(biāo)準(zhǔn),在備案制下有利于提升機(jī)構(gòu)競(jìng)爭(zhēng)力和綜合實(shí)力,樹立機(jī)構(gòu)品牌形象。
質(zhì)量管理體系建設(shè)是機(jī)構(gòu)各項(xiàng)工作制度化和規(guī)范化的保障,更是機(jī)構(gòu)體系建設(shè)的重中之重,開(kāi)展ISO9001質(zhì)量管理體系認(rèn)證并不是最終目的,如何借助ISO9001質(zhì)量管理體系,推動(dòng)臨床試驗(yàn)的持續(xù)良性發(fā)展才是宗旨。機(jī)構(gòu)應(yīng)當(dāng)立足自身質(zhì)量管理體系建設(shè)實(shí)際,決定是否引入ISO9001質(zhì)量管理體系。而一旦引入該標(biāo)準(zhǔn)體系,則應(yīng)當(dāng)執(zhí)行到底,不斷促進(jìn)ISO9001質(zhì)量管理體系與機(jī)構(gòu)臨床試驗(yàn)質(zhì)量管理體系的深度融合,保證機(jī)構(gòu)質(zhì)量管理體系的有效運(yùn)行和持續(xù)改進(jìn)。
- 中國(guó)合理用藥探索的其它文章
- 60Co-γ射線輻照滅菌對(duì)水蛭抗凝血酶活性的影響
- 甲潑尼龍琥珀酸鈉聯(lián)合西咪替丁治療腹型過(guò)敏性紫癜患兒的療效分析
- 視網(wǎng)膜激光光凝聯(lián)合康柏西普玻璃體腔注射治療視網(wǎng)膜分支靜脈阻塞繼發(fā)黃斑水腫的療效研究
- 石氏傷科芪骨組方配合導(dǎo)引八法在骨質(zhì)疏松患者中的應(yīng)用觀察
- CYP3A5*3基因多態(tài)性對(duì)他克莫司治療膜性腎病血藥濃度及臨床療效的影響
- 貝伐珠單抗結(jié)合XELOX、FOLFOX6方案治療轉(zhuǎn)移性結(jié)直腸癌的療效對(duì)比及其對(duì)患者肝腎功能的影響

