影像學在克羅恩病并發腸腔狹窄診斷及隨訪中的價值
莊 楠,李文波,朱慶莉
中國醫學科學院 北京協和醫學院 北京協和醫院超聲醫學科,北京 100730
克羅恩病(Crohn’s disease,CD)是一類慢性復發性炎癥性腸病,腸腔狹窄是其常見的并發癥之一。腸腔狹窄可累及消化道各個節段,最常見的部位為末段回腸和回盲瓣,由于CD所導致的透壁性炎癥,其纖維化可累及腸壁全層,導致腸壁增厚/硬化、腸腔狹窄甚至梗阻[1]。一項基于人群的隊列研究顯示[2],超過5%的患者最初為狹窄性表型,15%的患者10年內發展為腸腔狹窄。
按照病因,CD合并腸腔狹窄可分為原發狹窄和術后吻合口處狹窄;按照病理類型,可分為炎癥型、纖維型及混合型。炎癥型狹窄是腸壁充血水腫、淋巴增生等所導致的,纖維型狹窄則是長期慢性炎癥刺激所導致的腸壁纖維組織沉積和瘢痕形成[3]。以炎癥型狹窄為主的CD患者可通過藥物保守治療,激素類藥物和抗腫瘤壞死因子抑制劑能夠緩解炎癥型狹窄所導致的梗阻癥狀[4]。藥物治療僅能延遲患者接受手術的時間,80%以上的患者在首診CD 10年內接受第一次腸切除術[5]。針對纖維型狹窄為主的患者,目前尚無有效的藥物治療手段,必須采用內鏡下球囊擴張術(endoscopic balloon dilation,EBD)、狹窄成形術(strictureplasty)或節段性腸管切除術等外科手段治療[6]。但手術治療并非沒有風險,手術后原部位再次手術的概率為10%[7],4%的狹窄成形術后可能會導致吻合口漏、膿腫形成等并發癥[7],多次手術可導致短腸綜合征,嚴重影響患者的消化功能。故準確鑒別CD并發腸腔狹窄的病變性質,選擇恰當的治療手段,對患者的預后及生存質量至關重要。
在CD并發腸腔狹窄的評估中,必須明確狹窄腸段的數目、部位、程度等特征,盡可能區分炎癥型狹窄與纖維型狹窄,為臨床進一步診療提供參考,同時評價藥物療效、監測術后情況,這是影像學診斷的重點。目前的影像學評估方法包括腔內評估和計算機斷層掃描評估,如內鏡、CT、MRI、超聲等。本文總結針對CD并發腸腔狹窄的各項影像學技術,討論其優點和局限性,旨在為臨床提供參考。
1 內鏡
內鏡是CD診斷的常規首選檢查項目,可在腔內直觀地觀察消化道情況,并通過內鏡在腸腔內走行是否通暢等判斷狹窄的部位、節段及程度(圖1)。第三屆歐洲炎癥性腸病共識已推薦其用于評價結腸和末段回腸腸腔狹窄[8]。CD內鏡嚴重指數評分[9](Crohn’s disease endoscopic index of severity,CDEIS)和CD簡化內鏡評分[10](simple endoscopic score for Crohn’s disease,SES-CD)亦將腸腔狹窄列入CD活動指數評價指標中。同時,內鏡可留取狹窄部位腸段進行病理學評估,明確病變性質。3.5%的腸腔狹窄合并發育不良或癌變[8]。
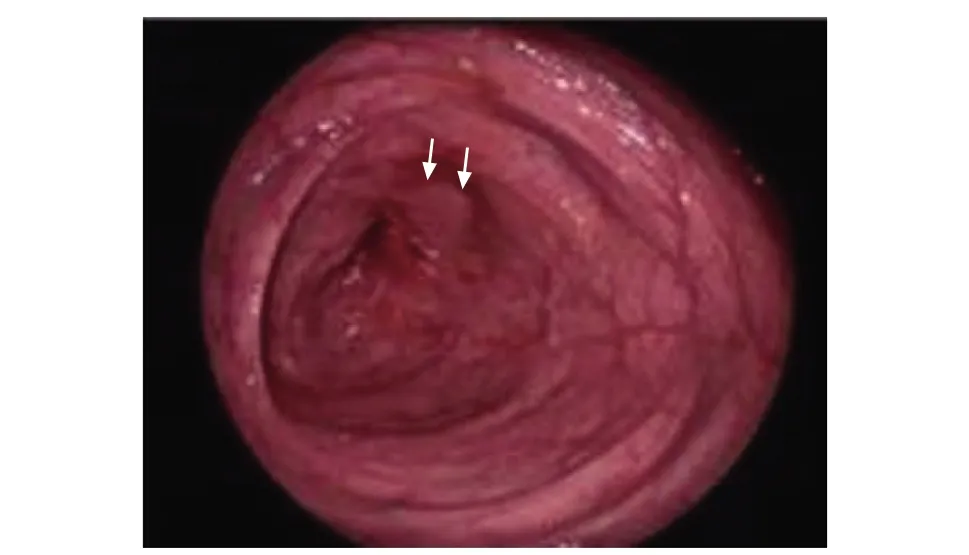
圖 1 1例女性患者,42歲,右半結腸切除術后,診斷為克羅恩病,腸鏡顯示吻合口處狹窄(箭頭)
CD合并腸腔狹窄的內鏡下治療手段日趨成熟,EBD目前已成為一項常用的非手術性治療方法,適用于短節段(≤4 cm)、內鏡可通過的狹窄性病變[11]。其并發癥少,安全性高,穿孔的發生率僅為3%[12]。17%~82%的CD并發狹窄患者可通過EBD使病情長期緩解[13],接受EBD的患者在1、3、5年內累計避免外科手術率分別為80%、57%和52%[12]。長節段、黏膜面炎癥嚴重的狹窄性病變是EBD治療失敗的主要原因[14]。狹窄成形術被視為一類腸管切除術的替代方法,雖然腸管切除術能夠解除腸腔狹窄,但切除過長節段腸管將降低吸收功能,造成短腸綜合征,影響患者的營養情況,甚至縮短預期壽命。狹窄成形術的指征為較長節段的腸管內存在多處腸腔狹窄,尤其適用于腸段受累超過100 cm且患短腸綜合征的患者[15]。Yamamoto等[16]匯總了1112例行狹窄成形術CD患者的臨床結局,術后5年復發率為28%,其中90%發生于非手術部位。狹窄成形術對減輕CD合并狹窄患者癥狀、降低手術幾率具有重大價值。內鏡下針刀狹窄切開術(needle-knife stricturotomy)[17]和內鏡下金屬支架植入術[18]是一類針對纖維型狹窄或球囊擴張失敗的難治性狹窄的新型治療手段,能夠進一步減少內鏡下出血、穿孔等創傷。
但內鏡對于多節段、腸壁深部病變的取材較為困難,難以進行全面評估;且內鏡為侵入性檢查,患者接納度低,腔內檢查僅能提供黏膜信息,對于明顯梗阻、內鏡不能通過的腸段,則無法確切評價腸腔狹窄情況。
2 計算機斷層掃描腸道成像
計算機斷層掃描腸道成像(computed tomography enterography, CTE)是目前整體評估CD的重要非侵入性影像學手段之一,診斷腸腔狹窄的靈敏度為85%~93%,特異度為100%[5]。CTE對單個狹窄的診斷準確度可達100%,對狹窄數目的診斷準確度為83%[5](圖2)。
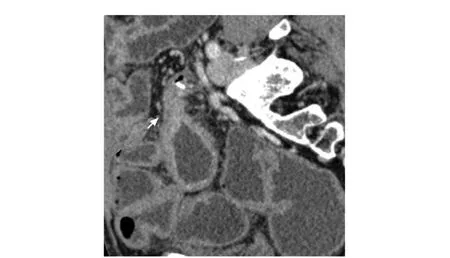
圖 2 1例男性患者,52歲,結腸次全切除術后,計算機斷層掃描腸道成像顯示吻合口處腸腔狹窄(箭頭)
以組織病理學為參考,CTE圖像中腸壁增厚伴異常強化、腸系膜血管增生等征象與CD高度炎性狹窄密切相關[19]。Chiorean等[20]納入44例CD伴腸腔狹窄患者,構建了CTE標準化評分系統,將CTE評分與47處手術切除病變腸段的病理結果進行分析,結果表明CTE對炎性病變和狹窄性病變的診斷準確度分別為76.6%和78.7%。CTE對于腸壁炎性和纖維化病變的診斷價值仍有待進一步前瞻性研究加以證實。雖然CTE是一類臨床上廣泛采用的非侵入性CD檢查手段,但CTE需要腸道準備,對已存在梗阻的患者并不適用;同時其輻射暴露等問題在患者長期隨訪及重復評估中應予以重視。
3 MRI
MRI在CD的診斷及評估中發揮了重要作用,磁共振腸造影(magnetic resonance enterography,MRE)能夠準確評價CD并發腸腔狹窄,明確狹窄性病變的數目、部位和程度,檢測腸腔狹窄診斷準確度為90%,靈敏度為75%~100%,特異度為90.9%~95.7%[21-22]。目前,MRI已用于藥物療效評價的隨訪中。一項研究表明,腸腔狹窄長度小于12 cm,近端腸腔最大直徑為18~29 mm,MRE延遲相顯著增強,無瘺管存在等因素可作為阿達木單克隆抗體治療CD腸腔狹窄成功的預測因子[23]。
在評估腸壁病變性質方面,多項MRI新技術在腸壁纖維化定性和定量測量中取得了突破。MRI擴散加權成像(diffuse weighted imaging,DWI)是利用水分子通過不同密度的組織以提供圖像對比度(若炎癥組織密度高、擴散受限,呈現為明亮的圖像),一項Meta分析總結了DWI評價CD腸壁炎癥程度的靈敏度為92.9%,特異度為91.0%[24]。動態對比增強MRE在延遲相測量的增強參數,纖維化腸壁的造影劑滯留時間更長,從而區分腸壁的炎癥與纖維化[25]。磁化傳遞成像(magnetization transfer imaging,MTI)對狹窄腸腔組織中的膠原含量變化十分敏感,能夠準確區分纖維化和非纖維化的腸壁組織。動物實驗表明,晚期腸壁纖維化的大鼠磁化傳遞比值(magnetization transfer ratio,MTR)明顯高于非纖維化大鼠[26]。Li等[27]的研究表明,MTR與腸壁纖維化密切相關,并且能夠區分中-重度纖維化和無-輕度纖維化。然而,由于MRI費用昂貴、檢查時間長、需嚴格腸道準備,且患者耐受性低,故其在臨床尚未得到廣泛應用。

圖 3 1例男性患者,45歲,診斷克羅恩病,經腹超聲顯示第5組小腸局部腸腔狹窄,近端腸腔擴張(箭頭)
4 經腹超聲
經腹超聲(transabdominal ultrasound, TAUS)近年來已被廣泛應用于CD的診斷和隨訪中,在并發癥檢測方面具有較高的靈敏度和特異度(圖3)。根據既往文獻報道,常規TAUS診斷CD合并腸腔狹窄的靈敏度可達100%,特異度為63%[28-29]。以手術病理為金標準,Pallotta等[30]發現腸道超聲造影檢查對CD患者單發狹窄診斷的靈敏度為97.5%,特異度為100%,對多發狹窄的診斷靈敏度為75%,特異度為100%。TAUS對腸腔狹窄的診斷靈敏度和特異度均較高,且無輻射、檢查簡便,適用于CD并發癥的隨訪及藥物療效監測。
值得一提的是,在明確腸腔狹窄的纖維化程度方面,超聲新技術取得了長足進展。腸道超聲造影具有區分CD炎癥型和纖維型狹窄的潛能,研究表明,超聲造影顯示的腸壁彩色多普勒血管化程度與纖維狹窄程度呈顯著負相關[31],超聲造影表現與腸壁炎癥型(Spearman’s,r=0.53)、纖維型狹窄(Spearman’s,r=0.50)的病理評分顯著相關[32]。剪切波超聲彈性成像(shear wave elastography, SWE)是通過脈沖刺激,在體內產生剪切波,測量傳播速度從而得到的組織彈性值。Chen等[33]通過對CD合并腸腔狹窄的腸切除標本進行SWE檢查,結果顯示以22.55 kPa為臨界值,區分輕/中度與重度腸壁纖維化的靈敏度為87.5%,特異度為57.9%。Dillman等[34]動物實驗表明,纖維化腸壁相對于急性炎癥期腸壁,其剪切波速度(shear wave velocity,SWV)顯著增高,測量SWV能夠區分腸壁炎癥型病變和纖維型病變。綜上,腸道超聲造影和SWE能夠明確CD合并腸腔狹窄的腸壁病變性質,具有良好的臨床應用前景。
5 正電子發射斷層顯像/計算機體層成像
18F-氟脫氧葡萄糖(fludeoxyglucose,FDG)正電子發射斷層顯像/計算機體層成像(positron emission tomography/computed tomagraphy,PET/CT)主要用于評價組織功能及代謝情況,近年來越來越多地應用到了炎癥性腸病的評估中。Louis等[35]發現,對于內鏡下的嚴重病變,包括深潰瘍和狹窄等,PET/CT的檢出率為100%(14/14)。
18F-FDG PET/CT對重度炎癥性病變的檢出率為87%,但對淺表的輕度炎癥、潰瘍性病變,診斷準確度僅為7%[36-37]。Jacene等[38]納入了17例具有明確梗阻癥狀的CD患者,其中13例接受了手術,術前利用18F-FDG PET/CT檢測患者腸壁內的FDG攝取情況,將檢查結果與術后病理標本進行比較,發現FDG不僅沉積于急性炎癥的腸壁中,在嚴重纖維化、腸肌肥大的腸壁中也有積累,提示18F-FDG PET/CT可能無法進一步鑒別腸腔狹窄是炎癥型或是纖維型。然而,在其他研究中,以內鏡聯合組織學檢查為金標準,納入37處腸腔狹窄病變,利用18F-FDG PET/CT聯合MRI、TAUS等其他影像學手段,能夠100%發現有臨床癥狀并需要干預的CD狹窄性病變[39]。因此,18F-FDG PET/CT鑒別炎癥型和纖維型狹窄的能力有待于進一步研究證實。
6 小結
影像學評估可明確CD狹窄腸段的數目、部位、形態以及程度,對該病的診斷及治療起到了重要作用,雖然內鏡是最常用的評價手段,但對于CD這類跨壁性炎癥性腸病來說,不能僅局限于腔內評估,還需要結合斷層影像學手段及連續性檢查手段綜合評估,如CT、MRI和TAUS等。在評價腸壁炎癥及纖維化程度方面,超聲、MRI等新技術有著良好的發展前景,并逐漸得到認可,有望在臨床上廣泛應用。目前尚無指南提出診斷及鑒別CD伴腸腔狹窄性質的標準方法,各項影像學手段各有其優勢和局限性(表1),對于CD合并腸腔狹窄的早期篩查、治療評價及預后評估仍不完善,對于腸壁纖維化診斷標準尚不統一[40],期待更為深入的臨床研究。

表 1 不同影像學方法診斷CD合并腸腔狹窄的優勢和局限性
作者貢獻:莊楠負責文獻查詢、整理及文章撰寫;李文波、朱慶莉負責文章審閱和修改。
利益沖突:無

