微小膜殼絳蟲感染ICR小鼠后的蟲體生長發(fā)育情況和小腸組織的病理變化*
楊漢蕾,趙敬,張科,鄢宇航,門萬琪,皮煥婷,牟榮*
(1.貴州醫(yī)科大學(xué) 基礎(chǔ)醫(yī)學(xué)院 人體寄生蟲學(xué)教研室,貴州 貴陽 550004;2.貴州醫(yī)科大學(xué) 現(xiàn)代病原生物學(xué)特色重點實驗室,貴州 貴陽 550004;3.貴州醫(yī)科大學(xué) 臨床醫(yī)學(xué)院,貴州 貴陽 550004)
微小膜殼絳蟲(Hymenolepisnana,H.nana),又稱短膜殼絳蟲,屬于膜殼科膜殼屬[1],是一種人獸共患寄生蟲,也是幼兒較常感染的一種絳蟲,通常被稱為“侏儒絳蟲”,是因其體積小,長2~4 cm、寬1 mm[2-4]。H.nana成蟲寄生于人或嚙齒類動物小腸,以頭節(jié)吸盤附著在腸絨毛間的黏膜表面[3];當(dāng)H.nana性成熟時,末端孕節(jié)在腸道內(nèi)分離、解體,之后釋放出蟲卵,并通過糞便排出蟲卵;這些蟲卵會立即產(chǎn)生感染性,且可以在環(huán)境中存活長達兩周。據(jù)估計,全世界H.nana感染人數(shù)大約有50 000 000~75 000 000[5-6]。相關(guān)證據(jù)表明,H.nana感染具有改善腸炎的能力,其引起的免疫調(diào)節(jié)機制能夠確定新的分子靶點,為炎癥性腸道疾病患者提供新的治療方案[7-9]。嚙齒類動物目前是實驗性哺乳動物絳蟲研究的主要對象,尤其是小鼠[10]。因此,建立H.nana感染小鼠的實驗動物模型可為后續(xù)開展H.nana所致炎癥性腸炎的相關(guān)研究提供動物模型。近年來,國內(nèi)外報道了一系列H.nana感染脊椎動物和節(jié)肢動物的動物模型[11-12],為建立H.nana感染小鼠動物模型奠定了理論基礎(chǔ),但是這些研究均缺少對小鼠體質(zhì)量變化以及腸組織病理變化的研究,且小鼠每克糞便蟲卵數(shù)(eggs per gram,EPG)檢測缺乏連續(xù)性和系統(tǒng)性。因此本實驗通過將野生小鼠小腸獲取的H.nana,以不同蟲卵量實驗感染ICR小鼠,觀測感染后不同時間小鼠的EPG、體質(zhì)量和小腸組織病理學(xué)特征及檢獲蟲體形態(tài)學(xué)特征,以了解H.nana在小鼠腸內(nèi)的生長發(fā)育情況和小鼠腸組織病理變化,為H.nana實驗感染ICR小鼠的后續(xù)研究奠定基礎(chǔ)。
1 材料與方法
1.1 蟲體來源、實驗動物、主要試劑及儀器
蟲體采自野生小鼠,經(jīng)形態(tài)學(xué)和分子鑒定,確定采集蟲體為H.nana。6周齡ICR雌鼠購自貴州醫(yī)科大學(xué)實驗動物中心,體質(zhì)量26~28 g,體健,經(jīng)糞檢和間接凝集實驗證實無寄生蟲感染。稱量體質(zhì)量后隔離飼養(yǎng)觀察3 d。嚴(yán)格隔離飼養(yǎng),飲水瓶與鼠糧不能交叉污染,每周清洗更換3次飼養(yǎng)籠、飼料和墊料。Trizol購自美國Sigma公司,PCR引物購自上海生工生物工程有限公司,Nikon科研級成像系統(tǒng)(日本Nikon公司,Nikon DS-RI2),PCR擴增儀(THCHNE,TC-512)、生物組織冷凍包埋機(BIOBAS EKD-BC,BK-BM)、生物組織切片機(德國徠卡,RM2016)。
1.2 H.nana蟲種鑒定
1.2.1形態(tài)學(xué)鑒定 將蟲體取出置于載玻片上,滴入生理鹽水使之舒展開,在普通光學(xué)顯微鏡下觀察其成蟲和蟲卵的形態(tài)[13]。取兩載玻片將H.nana蟲體壓平,棉線纏緊,于70 %的酒精里固定后行醋酸明礬卡紅染色[14],二甲苯透明后用中性樹膠封片,觀察并拍照。
1.2.2野生小鼠體內(nèi)獲取的蟲體分子生物學(xué)鑒定 取約5 mg成蟲,用酚氯仿法提取總DNA。以其為模板用COX1[15-17]特異性引物(COX1 上游引物5′-ACCGCGTCGTGTGTGTATTT-3′,COX1 下游引物5′-ACATGCAACTGGGCTCATACG-3′)進行PCR擴增,推測結(jié)果為COX1產(chǎn)物條帶202 bp。PCR反應(yīng)體系:模板DNA 2 μL,上游引物1 μL,下游引物1 μL,2×TaqPCRMix 12.5 μL,ddH2O 8.5 μL。PCR擴增程序:94 ℃ 2 min,94 ℃ 40 s,57 ℃ 1 min,72 ℃ 1 min,30個循環(huán);72 ℃ 10 min。使用1%的瓊脂糖凝膠電泳35 min,于紫外燈下觀察結(jié)果,凝膠成像系統(tǒng)拍照。將PCR 產(chǎn)物送上海生工公司進行測序,然后進行序列分析。
1.3 H.nana蟲卵的收集和計數(shù)
取數(shù)段H.nana的末段孕節(jié),生理鹽水反復(fù)沖洗后以眼科剪充分剪碎使蟲卵逸出,待蟲體組織沉淀后收集上清,光學(xué)顯微鏡下觀察收集的蟲卵[18],分別計數(shù)5次蟲卵量后取均值,每次計數(shù)蟲卵懸液6 μL,最后定量為生理鹽水0.3 mL中含1 000個蟲卵備用。
1.4 分組
168只、6周齡、體質(zhì)量約26 g的ICR小鼠分為6組,5個實驗組和1個對照組,每組28只。5個實驗組分別以60、100、300、500、1 000個蟲卵灌胃感染,生理鹽水灌胃的小鼠作為對照組。
1.5 觀察指標(biāo)
1.5.1一般情況與體質(zhì)量實驗組和對照組每組隨機選8只小鼠標(biāo)記,每日觀察小鼠活動情況,連續(xù)記錄小鼠體質(zhì)量25 d,小鼠相對體質(zhì)量=小鼠體質(zhì)量/小鼠初始體質(zhì)量×100。
1.5.2糞檢蟲卵 使用改良加藤法[19]檢測檢測小鼠糞便EPG,連續(xù)檢測25 d,根據(jù)記錄結(jié)果作排卵趨勢圖。
1.5.3剖檢獲取蟲體觀測 小鼠在感染后第5、10、15、20、25 d,每組隨機選取5只小鼠麻醉處死,打開腹腔,取出小腸,放置于裝有預(yù)冷生理鹽水(0 ℃)的培養(yǎng)皿中10 min,然后解剖并收集蟲體,觀察腸內(nèi)H.nana的發(fā)育狀況。
1.5.4組織學(xué)觀察 感染后第5、10、15、20、25天,取 5個實驗組和對照組的小腸,經(jīng)多聚甲醛固定、石蠟包埋、切片并做蘇木精-伊紅染色(hymatoxylin-eosin stain,H&E stain)。
1.5.5腸組織的DNA提取 挑選出觀察到蟲體的蠟塊組織提取其中的總DNA,以其為模板利用COX1特異性引物進行PCR擴增。將石蠟包埋的組織切成厚10 μm的薄片,取10 張切片用二甲苯常規(guī)脫蠟后,使用75%酒精和無菌水各洗滌3次,然后采用酚氯仿法提取總DNA,DEPC水溶解后采用分光光度計測定DNA的濃度和純度[20-21]。
1.6 統(tǒng)計學(xué)方法
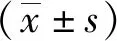
2 結(jié)果
2.1 H.nana蟲種鑒定
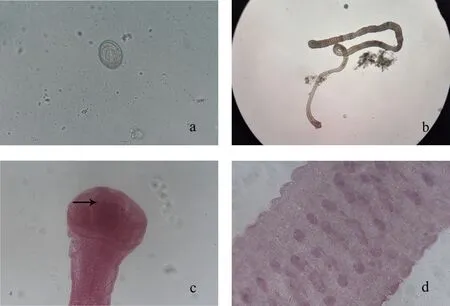
將野生小鼠體內(nèi)獲得的蟲體置于顯微鏡下觀察,發(fā)現(xiàn)蟲體頭節(jié)有4個吸盤以及一個可自由伸縮的頂突;劃破孕節(jié)使蟲卵逸出,可見卵殼較薄,胚膜兩端凸起發(fā)出絲狀物,內(nèi)有一六鉤蚴(圖1a、圖1b);明礬醋酸卡紅染色后鏡下可清晰看到蟲體頂突上有一圈小鉤,成節(jié)內(nèi)有3個圓球形睪丸和發(fā)達的儲精囊(圖1c、圖1d)。此外,蟲體DNA的PCR擴增結(jié)果顯示在約200 bp位置有一特異性條帶,與分子生物學(xué)鑒定的COX1產(chǎn)物條帶為202 bp的預(yù)期結(jié)果大致相符(圖2)。同時PCR 產(chǎn)物測序及序列比對結(jié)果表明,所克隆的基因片段與GenBank中記錄的COX1參考株核苷酸序列同源性為99%。
注:a為蟲卵(400×);b為成蟲(100×);c為頭節(jié)(200×),箭頭所示為小鉤;d為成熟節(jié)片(400×);a、b為生理鹽水涂片,c、d為醋酸明礬卡紅染色。圖1 野生小鼠體內(nèi)獲取的微小膜殼絳蟲形態(tài)Fig.1 Morphology of H.nana in wild mice
注:M為DNA分子質(zhì)量標(biāo)準(zhǔn),1為COX1核酸擴增產(chǎn)物。圖2 野生小鼠體內(nèi)獲取的蟲體DNA PCR擴增圖Fig.2 PCR amplification of insect DNA obtained from wild mice
2.2 小鼠一般情況與體質(zhì)量
感染后第3天,小鼠出現(xiàn)精神萎靡、食量下降、活動減少、皮毛色澤變暗、毛發(fā)蓬亂等癥狀,癥狀隨蟲卵感染量加重。感染量為60、100和300個蟲卵的實驗組小鼠體質(zhì)量與對照組比較,差異無統(tǒng)計學(xué)意義(P>0.05);與對照組比較,感染量為500個蟲卵的實驗組小鼠體質(zhì)量在感染后第2天明顯減輕(P<0.05),感染量為1 000個蟲卵的實驗組小鼠體質(zhì)量在感染后第2天和第7天也明顯減輕(P<0.05)。見圖3。
2.3 糞檢結(jié)果
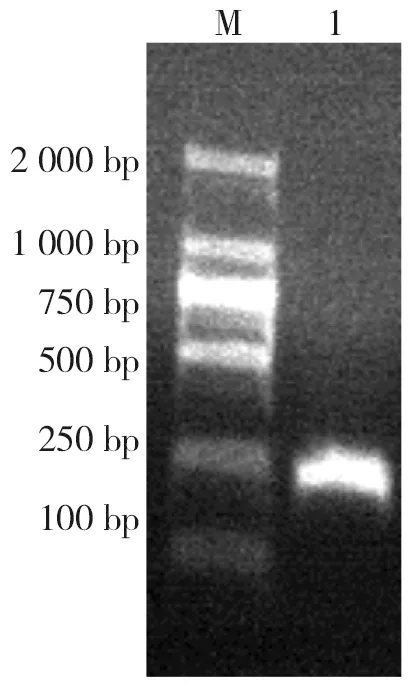
不同蟲卵感染量的實驗組小鼠,在感染后第12天從糞便中檢獲蟲卵,感染率為100%,證明蟲體在感染后第12天已經(jīng)發(fā)育成熟,完成一個生活史。感染500個蟲卵的實驗組檢出蟲卵時間最早、排卵持續(xù)時間最長,H.nana感染ICR小鼠動物模型建立可參考該感染量,見表1。
表1 各組H.nana感染ICR小鼠糞檢蟲卵情況Tab.1 The results of eggs detected from the feces of ICR mice infected with H.nana
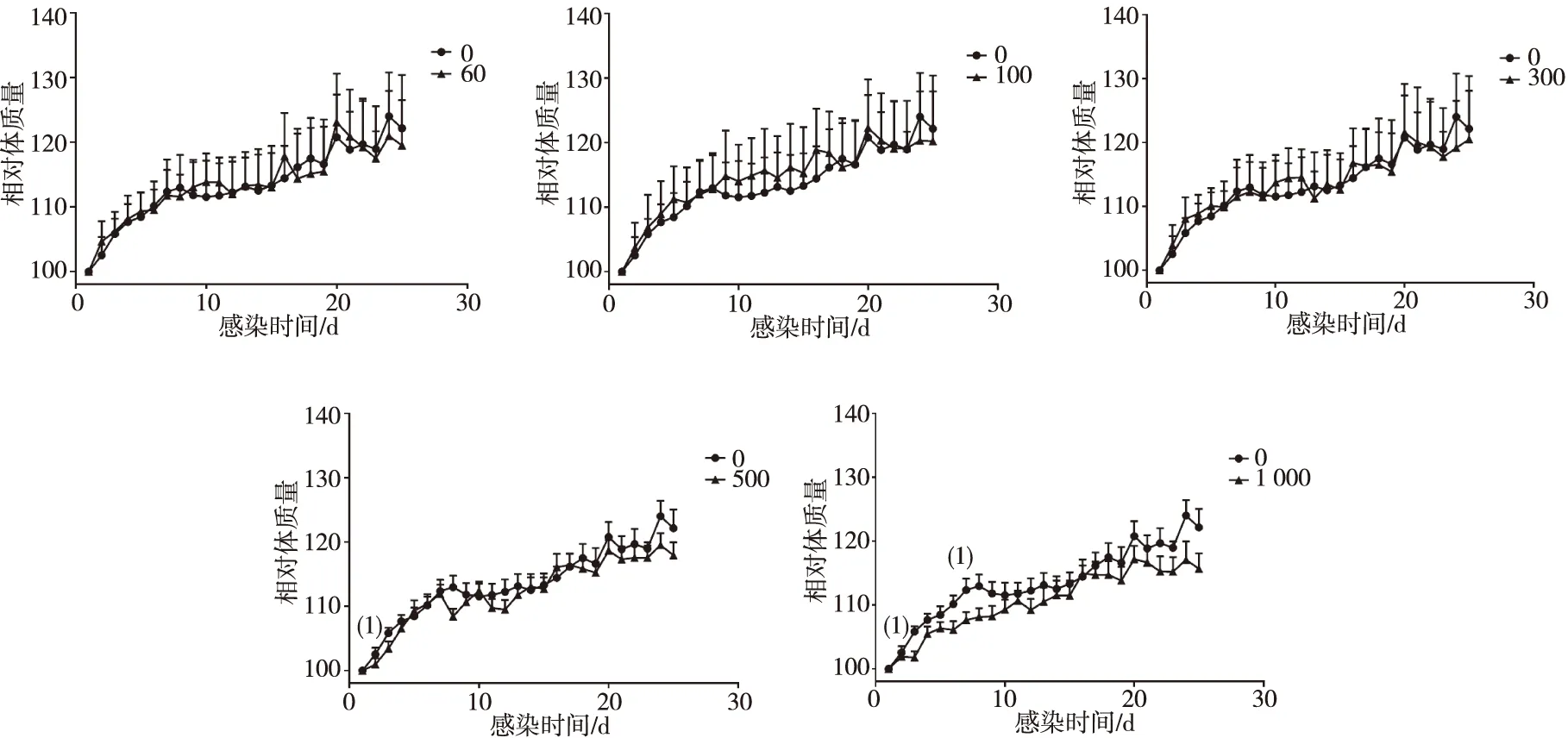
注:(1)與對照組比較,P<0.05。圖3 實驗組和對照組小鼠的相對體質(zhì)量Fig.3 Relative weight of mice in experimental group and control group
2.4 剖檢蟲體觀測
感染后第5天未檢獲蟲體。感染后第10天感染量為60個蟲卵的實驗組有3只小鼠檢獲蟲體,成蟲檢獲率60%;感染量為100、300、500、1 000個蟲卵的實驗組小鼠均檢獲蟲體,成蟲檢獲率100%,蟲體主要分布于距回盲部6~12 cm處的小腸內(nèi)。感染后第15、20、25天所有實驗組小鼠小腸內(nèi)均發(fā)現(xiàn)成蟲,成蟲檢獲率100%,蟲體主要分布于距回盲部1~8 cm處的小腸內(nèi)。見圖4。
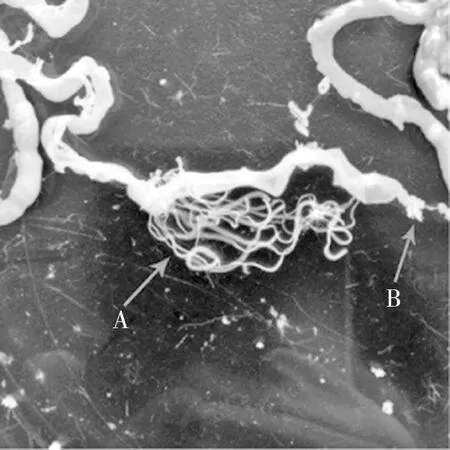
注:箭頭A所指為H.nana蟲體,箭頭B所指為回腸末端。圖4 感染小鼠小腸內(nèi)獲取的微小膜殼絳蟲成蟲Fig.4 Adult H.nana isolated from the small intestine of infected mice
2.5 小腸組織觀察及蠟塊組織PCR檢測
2.5.1小腸組織觀察 感染第5天感染量為1 000個蟲卵的實驗組及感染第15天60個蟲卵的實驗組小鼠的組織切片中發(fā)現(xiàn),小鼠后三分之一的小腸黏膜內(nèi)含有似囊尾蚴(圖5a),在腸絨毛之間發(fā)現(xiàn)帶有吸盤和鉤狀物的成蟲頭節(jié)和頭節(jié)后未分節(jié)的細(xì)長頸部(圖5b、圖5c)、以及含有雌雄生殖系統(tǒng)的成蟲節(jié)片(圖5d),認(rèn)為H.nana從幼蟲到成蟲的發(fā)育過程是一個從腸壁逐漸向腸腔的遷移過程。與對照組比較,感染后25 d內(nèi)實驗組H.nana感染處腸組織病理切片均未觀察到損傷修復(fù)肉芽腫組織,但是炎癥細(xì)胞增多,特別是嗜酸性粒細(xì)胞增多明顯。
2.5.2小腸蠟塊組織的PCR檢測 結(jié)果約200 bp有一特異性條帶,與分子生物學(xué)鑒定的COX1產(chǎn)物條帶為202 bp的預(yù)期結(jié)果大致相符(圖6),表明小鼠腸道內(nèi)寄生的確為H.nana。
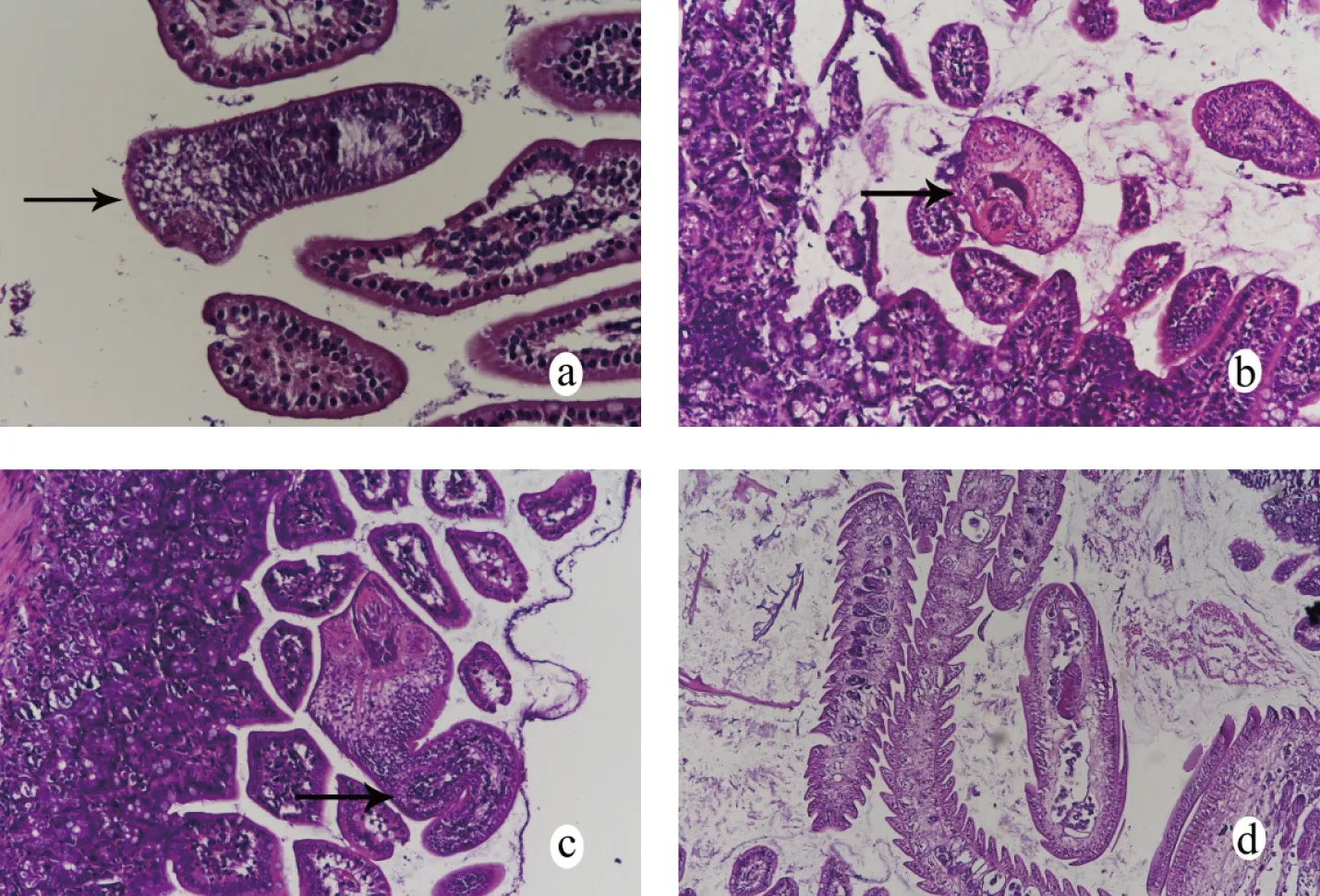
注:a箭頭所示為似囊尾蚴(400×),b箭頭所示為成蟲頭節(jié)(200×),c箭頭所示為成蟲頭節(jié)和頸部(200×),d為成蟲成熟節(jié)片(100×)。圖5 微小膜殼絳蟲感染小鼠小腸組織切片(HE)Fig.5 Section of small intestine in mice infected with H.nana(HE)
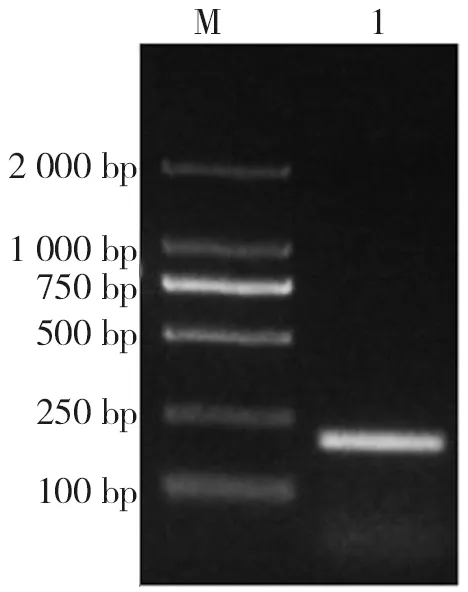
注:M為DNA分子質(zhì)量標(biāo)準(zhǔn),1為COX1核酸擴增產(chǎn)物。圖6 感染組小鼠小腸蠟塊組織的PCR擴增情況Fig.6 PCR detection of intestinal tissue of the worm found in HE staining section
3 討論
H.nana是一種常見的絳蟲,分布于世界各地,主要發(fā)現(xiàn)于發(fā)展中國家的兒童體內(nèi)。人類膜殼絳蟲病是一種全球性流行的人畜共患病,由H.nana和縮小膜殼絳蟲引起[22]。H.nana在亞洲、南歐和東歐、中美洲和南美洲以及非洲流行,其生活在人類、小鼠和大鼠的小腸中,它主要通過含有卵的糞便或以中間宿主昆蟲為載體進行傳播。H.nana也能夠在一個宿主中完成其整個生命周期,因此能夠自體感染。張維真等[23]研究報道,H.nana蟲卵孵化出六鉤蚴的時間大約需要2~ 3 d。
本實驗結(jié)果顯示,感染量為60~1 000個鼠源性H.nana蟲卵均能感染ICR小鼠,且感染后第2天,500個蟲卵感染量和1 000蟲卵感染量的實驗組小鼠體質(zhì)量均較對照組明顯減輕。結(jié)合張維真等[23]所報道的結(jié)果,推測感染后第2天H.nana蟲卵孵化出六鉤蚴后鉆入小鼠腸絨毛對其造成損傷,同時蟲卵孵化過程中的代謝分泌物也會刺激小鼠腸壁,導(dǎo)致腸壁吸收功能障礙,從而使感染組小鼠體質(zhì)量下降。本實驗糞檢蟲卵的結(jié)果顯示,實驗組小鼠的感染率為100%,蟲體在感染后約第12天發(fā)育成熟,這與Thompson[24]研究中所報道的約2周時間相符合,其中感染500個蟲卵的實驗組蟲體和蟲卵檢獲時間一致性最高,反應(yīng)了蟲體發(fā)育狀況良好。500個蟲卵感染量的實驗組小鼠體內(nèi)蟲體發(fā)育良好的原因可能是小鼠體型較小,其腸道無法負(fù)擔(dān)過多的蟲卵感染有關(guān);本研究中也發(fā)現(xiàn)1 000個蟲卵感染量的實驗組小鼠體質(zhì)量下降更明顯,排卵持續(xù)時間反而更短。因此適量的蟲卵感染量可維持H.nana與小鼠相互作用的平衡關(guān)系,一方面小鼠的自身免疫力不會完全清除感染的蟲卵,另一方面部分蟲卵可以在小鼠小腸內(nèi)繼續(xù)生長發(fā)育成熟。Fan等[12]曾報道以20個H.nana蟲卵感染小鼠,感染19~33 d后檢測的成蟲感染率僅為33%。因此可將500個蟲卵感染量作為參考以建立H.nana感染ICR小鼠動物模型。
本實驗的組織病理切片結(jié)果顯示,在實驗組小鼠距離回盲部1~12 cm處的小腸內(nèi)可見似囊尾蚴、成蟲頭節(jié)、頸部以及成蟲節(jié)片,腸粘膜未見損傷修復(fù)肉芽腫組織,但是炎癥細(xì)胞增多,尤以嗜酸性粒細(xì)胞增多明顯,這與Hench等[10]報道的情況基本一致,在檢測中并沒有發(fā)現(xiàn)與宿主排斥反應(yīng)有關(guān)的變化,如組織正常結(jié)構(gòu)的喪失、水腫、混合細(xì)胞浸潤或上皮糜爛,但是炎癥性細(xì)胞明顯增多。從進化角度來說,寄生蟲對宿主的傷害越小越好。Hench等[10]的研究是基于1例自然感染的病患,而本實驗是取野生小鼠體內(nèi)的H.nana蟲卵感染ICR小鼠。有研究報道,人、嚙齒類動物的H.nana雖屬于同種生物,但其生理型并不相同,當(dāng)改變宿主后其生理型會逐漸改變,這其中的機制尚不明確。
本實驗設(shè)計尚存在不足之處,實驗過程中可能存在自體感染的問題,比如感染后12 d,有可能存在自身感染,這對后續(xù)實驗結(jié)果的分析會造成干擾,因此今后在建立H.nana實驗感染ICR小鼠動物模型時可以將實驗時間控制在12 d以內(nèi),來排除自體感染的干擾,以利于開展進一步的相關(guān)研究。

