后腹腔鏡輔助小切口配合鈥激光碎石治療孤立腎鹿角形結石療效評價
王偉錄,李巧星,梁東彥,鐘隆飛,黃振華
(江蘇省昆山市第一人民醫(yī)院泌尿外科,江蘇昆山 215300)
腎鹿角形結石一直是泌尿外科臨床治療的難題,而孤立腎鹿角形結石治療難度大、風險高,是泌尿外科醫(yī)師具有挑戰(zhàn)性的工作之一。如今隨著微創(chuàng)技術的發(fā)展,大部分孤立腎鹿角形結石可以通過經皮腎鏡手術(percutaneous nephrolithotomy,PCNL)聯合輸尿管軟鏡或者體外沖擊波碎石術(extracorporeal shock wave lithotripsy,ESWL)得到治療。但經皮腎鏡碎石取石術可能發(fā)生術后出血及感染等并發(fā)癥,如果孤立腎鹿角形結石患者術后一旦發(fā)生出血或者感染,治療極為棘手,若處理不當,往往會引起腎衰,甚至危及生命。本文回顧分析了21例采用后腹腔鏡輔助小切口配合鈥激光碎石治療孤立腎鹿角形結石的患者,療效滿意,現報告如下。
1 資料與方法
1.1 臨床資料回顧性分析2013年2月至2020年4月江蘇省昆山市第一人民醫(yī)院收治的21例采用后腹腔鏡輔助小切口配合鈥激光碎石治療孤立腎鹿角形結石患者的臨床資料,患者年齡23~65歲,平均(43.70±13.18)歲,男性13例,女性8例。10例先天性孤立腎,8例因結石嵌頓造成對側腎臟重度腎積水致無功能而行腎臟切除,1例因對側腎外傷切除,2例對側腎先天性發(fā)育不良無功能。患者手術前均行血常規(guī)、凝血功能、血生化、尿常規(guī)、尿細菌培養(yǎng)加藥敏試驗,根據藥敏試驗有效控制尿路感染;并進行雙腎B超、腹部平片和腎輸尿管計算機斷層掃描(computed tomography,CT)平掃,證實為鹿角形結石,結石直徑為2.4~6.1 cm,平均(4.0±1.2)cm。其中4例腎無積水,15例輕度腎積水,2例中度腎積水,血肌酐(serum creatinine,Scr)(202±86)μmol/L,腎小球濾過率(glomerular filtration rate,GFR)平均值為(36±11)mL/min。
1.2 治療方法采用全身麻醉,取健側臥位,抬高腰部,于腋中線髂嵴上2 cm處作1個約2 cm的切口。用血管鉗分離肌肉及腰背筋膜,手指伸入后腹膜間隙,推開腹膜,于后腹膜置入自制球囊,充氣600 mL,在手指引導下,于肋弓下緣腋前線及腋后線各作1個0.5 cm長的切口(兩切口處于同一橫斷面水平,距離約12 cm)。分別置入0.5 cm Trocar,腋中線髂嵴上切口置入腹腔鏡,超聲刀游離腹膜外脂肪,切開Gerotas筋膜,辨清腹膜反折,防止腹膜損傷。萬一損傷腹膜,用吸引器伸進損傷裂口處吸盡腹腔內氣體,Home-O-lock夾閉裂口。充分游離腎臟、腎盂及輸尿管上段,顯露腎盂,如果是腎竇內腎盂,則緊貼腎盂表面鈍性分離腎竇,擴大腎竇。退出腹腔鏡及Trocar,由肋緣下腋后線切口作為起點向腋前線切口方向,作1個長約8 cm的切口,切開皮膚、皮下及肌層,進入腹腔鏡分開的后腹膜間隙,再次顯露腎盂,用小S拉鉤牽開腎實質,充分顯露腎盂后切開腎盂,暴露結石,為便于收集碎石渣和避免碎石污染周圍組織,在腎盂周圍用紗布覆蓋。用Wolf(F8.0~9.8)硬性輸尿管鏡對準結石部位,使用ACU-H2E鈥激光治療儀,設置鈥激光功率1.8~2.0 J/16~18 Hz,生理鹽水邊沖洗邊碎石并分塊取出結石,同時吸出沖洗液,碎石結束后,各腎盞內的殘留結石可用彎取石鉗分別取出。最后用膀胱軟鏡從不同的角度,進入各腎盞,直視下將腎盞內殘余結石擊碎并沖出或取出,反復沖洗直至取盡結石,吸盡沖洗液。置雙J管,關閉腎盂,腎周引流。

2 結 果
本組21例患者手術均順利完成,手術平均時間約120 min,術中出血約80~180 mL,術中無腎實質及腎盞黏膜損傷,術后無出血、嚴重感染、尿漏及其他并發(fā)癥發(fā)生,患者接受手術后平均住院7 d,均順利出院(圖1)。術后1周B超及尿路平片(kidney ureter bladder,KUB)檢查,有2例輸尿管內殘余結石,直徑約0.5 cm,4周后復查B超已自行排出,另有2例腎下盞內殘余結石,直徑0.4~0.5 cm,隨訪中未作處理,結石清除率90.48%(19/21)。術后隨訪1~12個月,1個月后復查Scr較術前均有不同程度的下降[(134±51)μmol/L],其中8例已恢復到正常水平,腎小球濾過率GFR為(41±10)mL/min,較手術前有所上升。隨訪1年腎功能保持穩(wěn)定。根據統計學分析,各項指標手術前后比較差異有統計學意義(P<0.05,表1)。
表1 患者術前術后Scr、GFR評估
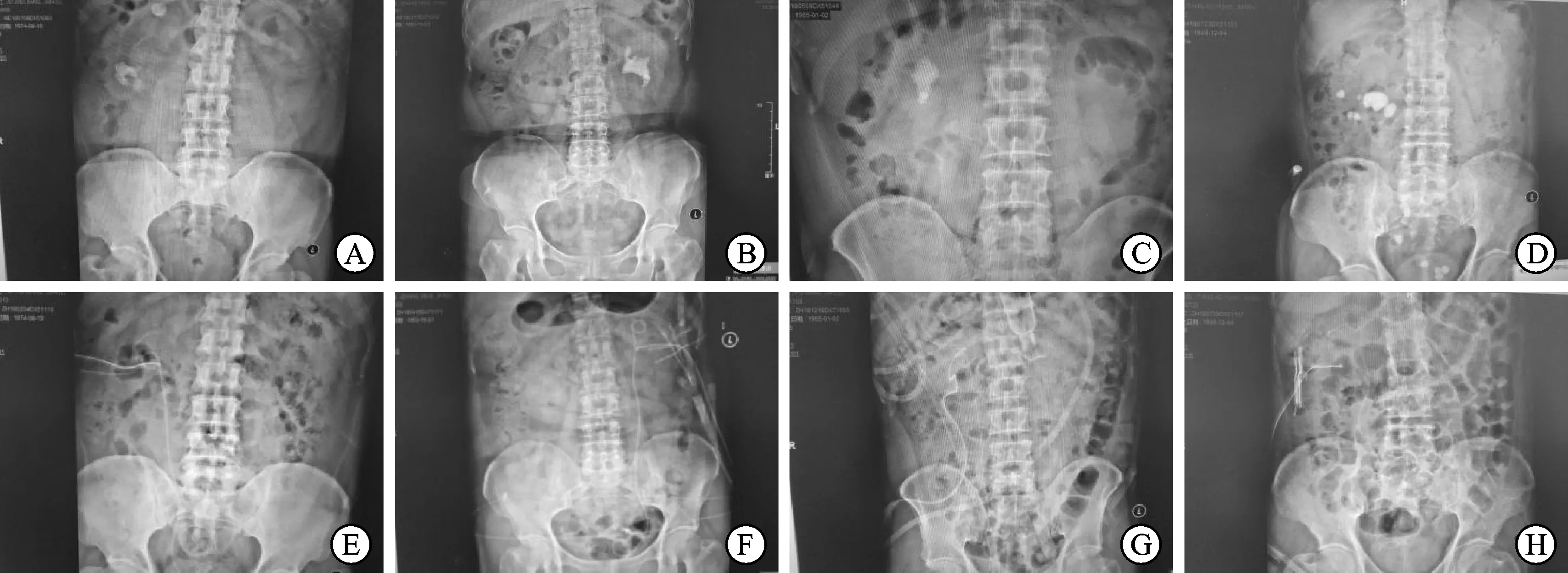
A~D:手術前;E~H:術后復查。
3 討 論
在臨床上孤立腎腎結石、鹿角形結石、多發(fā)性結石等被稱為復雜性腎結石[1]。鹿角形結石體積大,占據集合系統,容易合并感染,其處理一直是泌尿外科醫(yī)師的難題。雖然近年來由于經皮腎鏡、輸尿管軟鏡、ESWL等高新技術的應用,使得大部分鹿角形結石患者得到有效治療。但孤立腎鹿角形腎結石常常合并尿路感染和腎功能不全,容易出現氮質血癥,治療更為棘手,成為泌尿外科高風險的手術之一[2]。因此,更需要選擇一種安全有效的手術方式。
ESWL治療鹿角形結石在國內報道甚少,據文獻報道,ESWL對于直徑大于2.0 cm的結石經過碎石也難以完全擊碎,即使部分擊碎一旦形成石街阻塞輸尿管造成無尿,就會引起急性腎功能衰竭[3],反復的ESWL會加重腎損害,使病情更為復雜,因此ESWL不適宜治療較大的孤立腎鹿角形腎結石[4]。
孤立腎鹿角形結石的治療方法和其他鹿角形結石一樣,主要以手術為主。在經皮腎鏡還沒有開展的年代,孤立腎鹿角形結石的治療,只能采取傳統的開放手術,但開放手術創(chuàng)傷較大,僅切開腎盂有時無法取出鹿角形腎結石,必須采用腎盂聯合腎下盞或者腎實質切開取石等,這種手術方式不同程度地造成腎實質損傷,甚至影響局部腎實質血供,有時為了減少術中出血,需要阻斷腎蒂而造成腎功能不可逆的損害。一旦傷及腎內大血管,出血難以控制,手術風險極大,所以孤立腎鹿角形結石患者不建議首選腎實質切開取石術。
隨著腔鏡技術的發(fā)展,經皮腎鏡碎石取石術能治療絕大多數腎鹿角形結石,具有創(chuàng)傷小、出血少、恢復快等優(yōu)點,已成為復雜性腎結石治療的首選方法[5-6]。也是治療孤立腎鹿角形結石的重要方法,但有時術后會出現出血、感染等危險的并發(fā)癥。腎實質較為嚴重的出血往往需要行腎動脈造影和超選擇動脈栓塞治療[7],才能有效止血。對于較大鹿角形腎結石,應用PCNL治療,一般需要多通道或二次以上手術才有可能取盡結石[8]。對患者進行二次手術,既增加經濟和精神上的負擔,又增加了術中出血、腎功能受損的風險。孤立腎鹿角形結石因腎臟代償性增大,血管豐富,術中及術后更易出血[9],一旦術后出現延遲性出血或感染,不僅會進一步損害腎功能,而且將存在著極大風險[10-11],甚至危及生命。據報道應用PCNL治療孤立腎鹿角形結石,由于存在尿路感染和腎功能損傷等風險,限制了PCNL操作時間,導致結石殘余較多[12],而結石殘余又是結石復發(fā)的重要原因。故PCNL治療孤立腎鹿角形結石在結石清除率方面和安全性方面,有一定的局限性。
近年來,輸尿管軟鏡治療腎結石發(fā)展迅速,但因價格昂貴,鏡體纖維容易斷裂,清除結石能力相對差,其應用受到了一定的限制,長期被認為適宜處理 ≤2 cm的結石[13],孤立腎鹿角形結石常常伴有感染,輸尿管條件差,應用軟鏡治療手術時間長,并發(fā)癥及風險較高[14]。對于>2 cm的孤立腎鹿角形結石應用輸尿管軟鏡治療值得商榷。
本組21例孤立腎鹿角形結石采用后腹腔鏡輔助小切口配合鈥激光碎石取石術,既能取盡結石,又能最大限度地保護腎功能,減少并發(fā)癥發(fā)生,療效滿意,筆者有以下幾點體會。
第一,做好充分的術前準備。術前對每個患者要作出全面仔細的術前評估,仔細閱讀KUB、CT等,特別注意腎功能的檢查,制定出每個患者個體化的治療方案。研究表明,腎鹿角形結石通常為感染性結石,感染性結石手術后的殘余結石又會長成腎鹿角形結石,此類結石含有大量的革蘭氏陰性菌[15],所以術前常規(guī)行尿培養(yǎng)及藥敏試驗,根據藥敏試驗,至少在術前48 h應用有效的抗生素,使腎實質及尿中保持足夠的濃度,避免術中細菌、毒素的吸收[16]。
第二,術中動作輕柔、操作仔細。術中必須充分游離腎臟及輸尿管上段,充分暴露腎盂切口,使輸尿管硬鏡有足夠擺動的角度,切開腎盂后,利用輸尿管鏡邊沖洗邊碎石,同時吸出沖洗液,以防止沖洗液滲漏到腹腔內,若少量沖洗液滲漏到腹腔內無須處理,自行吸收。殘余結石可能散落在腎盞內,用膀胱軟鏡進入腎盞,直視下將腎盞內殘余結石鉗取或擊碎,術中防止腎盞黏膜損傷,常規(guī)放置雙J管。術后繼續(xù)使用敏感的抗生素,密切觀察病情變化。
第三,本組21例孤立腎鹿角形結石患者全部采用后腹腔鏡輔助小切口配合鈥激光碎石取石術,有如下優(yōu)點:①無須腎實質切開,基本不損傷腎功能,在碎石過程中基本不損傷腎盂及腎盞黏膜,故術中出血少。②最大限度地減少了結石的殘留,對腎盞內無法取出的結石可用膀胱軟鏡,故該術式取盡結石的可能性很大。③在手術中切開腎盂進行沖洗、碎石,引流通暢,較好地保持了腎盂內的低壓狀態(tài),不會出現PCNL中因快速灌注而產生腎盂內高壓,從而有效地阻止了細菌、毒素的吸收[17],術后全身感染中毒的機會明顯減少。④術中腎實質無損傷、出血少,術后無繼發(fā)出血的可能性。
筆者認為孤立腎鹿角形結石采用后腹腔鏡輔助小切口配合鈥激光碎石取石術,術中出血少、取石干凈、感染風險低、術后恢復快、腎功能改善明顯、安全性高,是一種比較理想的手術方法。

