超聲引導下經“腎盞穹隆-盞頸軸線”兩步穿刺法
——PCNL通道建立的解剖學研究及臨床應用
饒 婷,阮 遠,程 帆
(武漢大學人民醫院泌尿外科,湖北武漢 430060)
尿路結石是泌尿系統常見病、多發病,流行病學研究顯示我國患病率為1.0%~5.0%,并呈逐年遞增趨勢,其高患病率、高復發率、高治療成本給患者及社會帶來沉重的負擔[1]。經皮腎鏡碎石取石術(percutaneous nephrolithotomy,PCNL)作為一種微創方法被廣泛應用于上尿路結石的臨床治療,建立安全、高效的經皮腎通道是該技術的關鍵點。PCNL治療效果高度依賴于通道建立的安全性及有效性,理想的操作通道在徹底清除結石的同時,能最大限度減少手術并發癥。腎臟血管解剖是建立安全通道的基礎,基于集合系統結構及其與結石分布關系的效率原則是最大限度提高結石清除率的關鍵所在[2]。基于大量臨床實踐和應用研究,我們摸索出了一套利用超聲定位實現精準穿刺建立安全、高效經皮腎通道的方法,并逐漸形成了基于腎臟血管及集合系統解剖的PCNL通道建立的理論體系,本文就PCNL通道建立的相關經驗和認識進行分析總結。
1 PCNL的發展歷程
PCNL發展與演變歷程是一部通道建立的發展史。1976年,FERNSTROM和JOHANSSON首先報道X線引導下使用經皮腎鏡技術處理腎結石,從而促成PCNL技術的誕生[3]。我國自20世紀80年代開始引入PCNL技術,2005年后該技術發展迅猛,在傳統X線引導基礎上逐漸向超聲引導建立經皮腎通道過渡,并逐步在國內應用推廣。
1.1 體位及無管化1987年VALDIVIA-URIA等報道了仰臥位PCNL(supine PCNL,sPCNL)的第一個大型臨床研究,開啟了內鏡聯合腎內手術的時代[4]。盡管俯臥位不再是進行PCNL的唯一體位,但許多泌尿外科醫師仍不愿考慮sPCNL,開展一項大型的前瞻性、多中心、隨機臨床試驗以驗證sPCNL的有效性和安全性可能有助于突破當前的困境。1984年WICKHAM等[5]首次報道了術后無管化PCNL。目前,普遍認為無管化PCNL與較低的術后鎮痛需求和較短的住院時間相關,且不會增加術后失血量。盡管尚未明確無管化PCNL的適應證,但需注意的是無管化PCNL最初僅在高度選擇的病例中進行。完全無管化PCNL在術后不放置引流管的同時不留置輸尿管支架,有研究表明在把握好適應證的前提下,完全無管化PCNL是安全、有效的,但同樣面臨著普適性的安全問題[6]。
1.2 通道小型化HELAL等[7]在1997年首次報道對兒童腎結石患者使用F15通道進行微創經皮腎鏡碎石取石術(minimally invasive percutaneous nephrolithotomy,MPCNL),并提出微通道經皮腎鏡手術(mini-PCNL)的概念。近10年來,超微通道經皮腎鏡手術(ultramini-PCNL)及micro-PCNL也已被逐漸廣泛采用,以減少PCNL相關的手術并發癥。盡管定義并不統一,但需要注意的是這些代表通道大小的術語不僅表明通道鞘的尺寸,還涵蓋了特定的操作器械及手術概念。由于在減少出血和縮短住院時間等方面的療效明顯,通道小型化已成為PCNL發展的主要趨勢之一。然而,較小的通道可能會增加手術操作時間,如何平衡安全和手術效率仍然是主要挑戰[8]。
1.3 引導技術最初PCNL通道建立是在X線引導下進行的。X線引導穿刺不僅對腎臟集合系統具有很好的識別效果,在建立多通道及經上下腎盞穿刺方面也具有獨特優勢。超聲(ultrasound,US)引導穿刺建立皮腎通道已被廣泛應用于臨床實踐。超聲沒有抗輻射要求,便于推廣使用,是PCNL穿刺不可或缺的重要工具。彩色多普勒超聲對血管的敏感性更高,可以充分地顯示腎臟動脈分布,有助于穿刺時識別并避開通道內異位血管。對于復雜病例,同時使用超聲和X線引導的組合方法同樣值得嘗試。
針對不同的引導設備目前已開發出多種輔助穿刺技術。ClearGuideOne、SonixGPS和UProbe-2等計算機輔助可視化系統能夠在超聲監視器上實時顯示穿刺針的軌跡,使得穿刺線可視化成為現實[9]。多種技術及設備聯合引導是PCNL穿刺技術發展的重要方向之一。術前計算機斷層掃描(computed tomography,CT)和術中US動態融合成像引導下穿刺是一個有趣的嘗試,相關臨床研究顯示該技術是安全可靠的[10]。需要注意的是,該技術雖然實現動態融合成像,但本質上是CT橫截面圖像重建,難以用于縱向穿刺。
2 PCNL通道建立的相關腎臟應用解剖與安全路徑
PCNL通道建立相關腎臟應用解剖的發展歷程主要包括三個階段,包括早期解剖學研究的貢獻,此后過渡到開放手術時代,最后現代醫學影像學進一步定義了腎臟應用解剖。SAMPAIO在20世紀90年代對尸體腎臟集合系統和血管解剖的研究具有重要意義[7],因為它進一步幫助泌尿外科醫師建立一種操作規范,即應通過穿刺腎盞穹隆而不是漏斗部來進入集合系統,以最大程度地減少出血的風險。
出血是PCNL最常見的手術并發癥之一,對患者的治療和預后影響極大,曾是PCNL手術面臨的最大挑戰。腎臟血管解剖是建立安全皮腎通道的基礎,選擇準確的穿刺路徑是減少手術出血的關鍵所在。建立從皮膚到腎集合系統的通道來實現碎石取石,這一過程中如何避開大的腎臟血管分支,關系到PCNL手術的安全與效率。事實上,腎臟血管分布在X線和普通超聲中并不能清晰顯示,穿刺過程的完成均是以集合系統作為定位標志而進行的,因此血管解剖的重要性并沒有得到足夠的重視。
根據現有腎臟的血管解剖認識,腎動脈(Ⅰ級)及前后主干動脈(Ⅱ級)分布在腎竇內,髓質層中的腎段動脈(Ⅲ級)發出葉間動脈(Ⅳ級)走形于腎錐體兩側的腎柱內。葉間動脈在腎錐體底部發出弓形動脈(Ⅴ級),走形過程中進一步發出小葉間動脈(Ⅵ級)進入腎皮質。PCNL嚴重手術出血通常與Ⅲ級和Ⅳ級動脈損傷相關。在以超聲或X線作為引導手段進行穿刺時,腎錐體并不能作為穿刺的定位標志來尋找其“中心線方向”,因為腎錐體與腎皮質在超聲和X線下對比不明顯,難以辨識其具體位置。根據腎錐體與腎小盞一對一的解剖關系,腎錐體中心線的延長方向應該正好是腎小盞的軸線方向,而腎小盞因其內部為“尿液”填充,在超聲和X線下可清楚顯示輪廓,因此以腎小盞軸線作為定位標記穿刺進入集合系統,理論上是對腎柱內血管的最小損傷線。
3 超聲引導下經“腎盞穹隆-盞頸軸線”兩步穿刺法
我們團隊[11]在國內外率先提出的超聲引導下經“腎盞穹隆-盞頸軸線”兩步穿刺法(簡稱“兩-兩穿刺法”)建立PCNL通道,經過國內同行的應用實踐以及我們單中心8 000余例的臨床實踐,已被證實是一種基于腎臟血管及集合系統解剖安全、高效的通道建立方法。該方法核心主要包括3個方面的內容,首先是根據腎臟結石分布和腎集合系統結構,結合術前影像資料和術中超聲實時動態掃描,選定最佳穿刺目標盞;其次是根據腎臟血管解剖與集合系統關系,選擇目標盞穹窿部正中至盞頸平面中心點的連線,即目標盞“穹窿-盞頸軸線”,為最終進針方向;第三是熟練應用超聲實時監控穿刺針道,根據腎臟隨呼吸移動及肋骨遮擋情況,靈活選擇皮膚穿刺點,根據“兩-兩穿刺法”按既定路徑準確穿刺進入目標腎盞。我們團隊[12]的系列回顧性研究顯示,超聲引導下經“兩-兩穿刺法”建立PCNL通道的總體輸血率約為1.2%~3.6%,由于血流動力學波動及保守治療無效進行超選擇性動脈栓塞的比例約為0.7%。同時,“兩-兩穿刺法”在馬蹄腎、孤立腎及經腹途徑盆腔異位腎PCNL通道建立中也均展示出可靠的臨床應用價值[13-14]。
受腎臟隨呼吸移動的影響,皮膚選點常具有不確定性,采用“兩-兩穿刺法”可有助于實現目標腎盞“穹窿-盞頸軸線”方向穿刺進入集合系統(圖1)。“兩-兩穿刺法”的第一個“兩”是指兩點定位,即目標腎盞“穹窿-盞頸軸線”的兩個端點,一個是腎小盞穹隆的正中點,另一個是目標盞開口平面的中心點;第二個“兩”是指兩步進針,第一步是從皮膚穿刺點至腎皮質附近,根據穿刺路徑與目標盞穹窿-盞頸軸線偏離情況判斷皮膚選點是否合適,如果偏離較遠則推針至皮膚外調整皮膚穿刺點位置,第二步是隨腎臟在呼吸影響下的移動,穿刺進入腎集合系統,如果穿刺時機把握不當,則退針至腎包膜外,跟隨腎臟上下移動選擇恰當時機再次進針。實際操作中常存在肋骨位置及腎盞方向的不利影響,一般而言小角度偏離軸線方向不影響整體效果,但在允許情況下應盡可能貼近目標腎盞“穹窿-盞頸軸線”方向。該方法將PCNL通道建立的方法系統化和理論化,可以幫助快速完成學習曲線,且不需要特殊的設備,在一般超聲下即可實現精準穿刺和通道建立,便于推廣[15]。

圖1 “兩-兩穿刺法”有助于實現目標腎盞“穹窿-盞頸軸線”方向穿刺進入集合系統
4 融合腎錐體
通常認為腎錐體是腎實質內相對乏血管的區域。實際上,在使用腎臟增強CT或多普勒超聲檢查的過程中,我們經常發現人體腎臟中有兩種不同類型的腎錐體,即正常腎錐體(normal renal pyramid,NRP)和融合腎錐體(fused kidney pyramid,FRP)。 NRP與腎小盞呈一對一的解剖關系。FRP是指腎髓質層中相鄰的兩個或多個腎錐體發生融合后進入同一腎小盞,其內存在異位血管走形(圖2)。FRP的出現會對以腎小盞軸線作為定位標記的穿刺引導方法帶來挑戰。以FRP對應的腎小盞軸線作為定位標記,穿刺路徑經過的可能是FRP內部的血管變異區。這可能是一些看似很“精準”的穹隆穿刺卻出血較多的解剖學原因。我們在豬腎和尸體腎標本中的研究表明,融合腎錐體廣泛存在,尤其是上組和下組腎盞出現FRP的比例較高,中組腎盞相對較少,經FRP穿刺可能會增加血管損傷風險[16]。由于FRP的存在,腎錐體路徑并不一定是安全的,但存在風險并不意味著損傷一定會發生,準確把握手術風險并及時調整以獲得滿意的手術效果是建立安全通道的關鍵[17]。
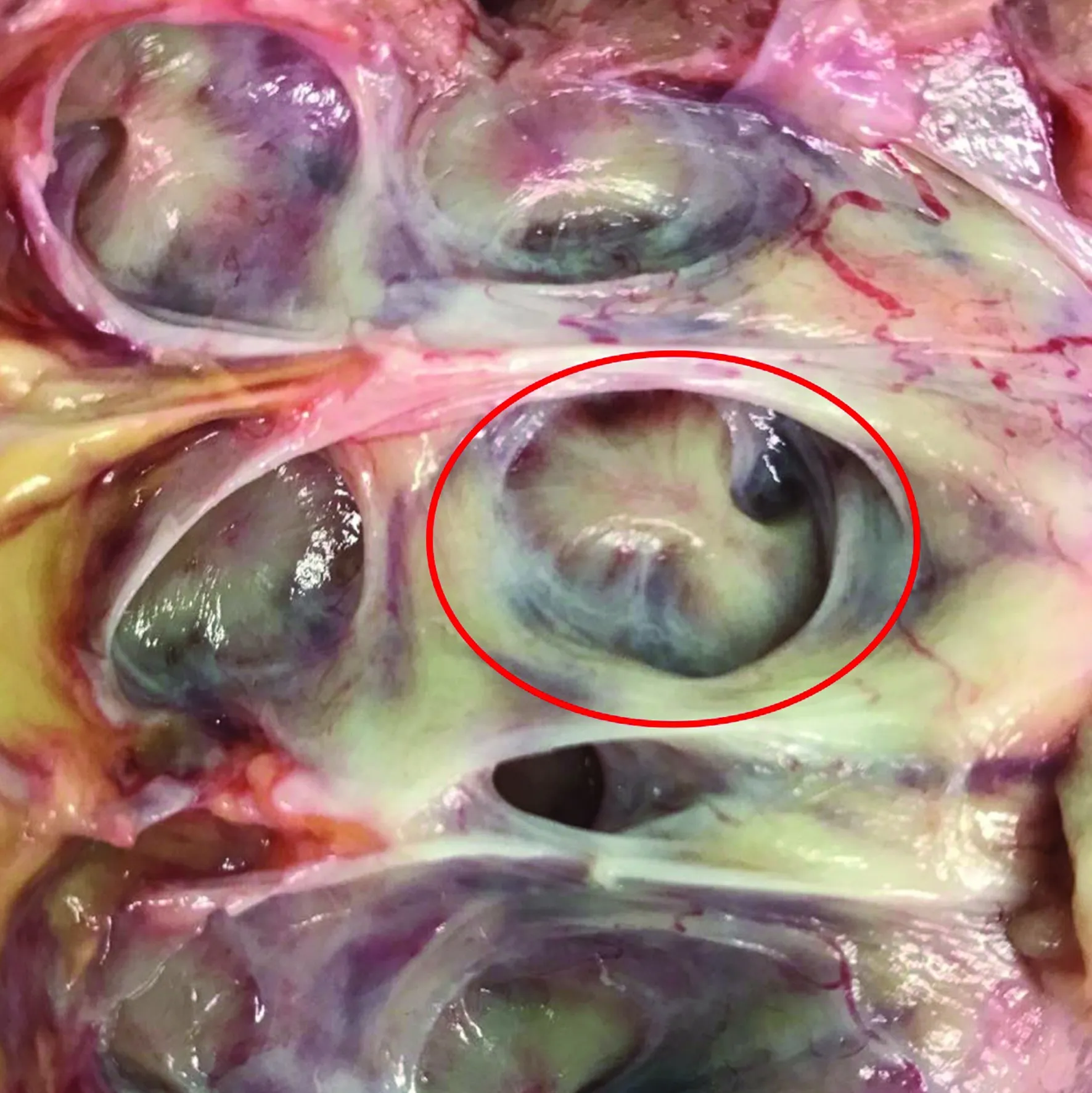
圖2 融合腎錐體解剖圖
融合腎錐體作為一種解剖變異廣泛存在,在PCNL手術中就不可避免會遇到經融合腎錐體穿刺建立通道的情況。腎臟增強CT掃描皮質期可以清楚地顯示FRP,這有助于術前規劃安全的穿刺路徑。實際上,解剖學意義上的FRP很難僅通過普通超聲來識別,術中應用多普勒超聲則可較準確地識別分布在FRP中的異位血管[18]。執行術前影像檢查如腎臟增強CT,并在術中進行系統的超聲檢查以評估目標腎盞與腎內血管解剖之間的關系,這將有助于建立更加安全的PCNL通道。
5 影像融合及人工智能與PCNL通道建立
近年來,多種醫學圖像融合技術在臨床診療中的應用范圍越來越廣,相關設備也層出不窮,極大促進了前沿醫學影像技術在臨床中的應用與轉化,其中“高精度”和“全自動”是醫學影像融合技術發展的兩個重要方向。PCNL相關CT-US融合成像技術具有很大的發展潛力,理論上利用術前高精度CT圖像與術中實時超聲進行多模態CT-US自動配準融合,能夠實現術中實時定位規劃精準的穿刺路徑。即便如此,目前CT-US多維影像融合仍然處于起步階段,精度及實用性尚無法取得令人滿意的效果,如何實現精準實時多維融合成像并提供智能化操作是突破瓶頸的關鍵所在。
實時精準多維CT-US融合圖像的獲取、識別、分析及處理是融合影像技術發展的主要難題之一,人工智能在這方面擁有無可比擬的深度挖掘能力。未來我們將圍繞PCNL實時CT-US多維智能融合成像及人工智能規劃體系這一核心問題開展工作,可分三步執行。首先,在基于PCNL通道建立解剖學研究的基礎上實現CT影像隨超聲實時掃描圖像的同步顯示,提高PCNL穿刺的精準性;其次,通過3D技術與虛擬現實技術實現術中CT-US多維圖像實時智能配準與融合,更為直觀地顯示穿刺路徑的狀態;最后,將深度學習和人工智能等技術應用于規劃最佳的PCNL穿刺路徑,突破關鍵技術難題,以期實現PCNL技術的真正可視化及標準化,從而達到安全與高效。

