動物血清中四環素類殘留的快速檢測
——放射免疫法
王 楠,蘇明明,張曉聲,沈偉健,陳 靜
(大連海關技術中心,遼寧大連 116000)
四環素是四環素族抗生素中最基本的化合物,分子式為C22H24N2O8,本身及其鹽類都是黃色或淡黃色的晶體,在干燥狀態下穩定性極高,除金霉素外,其他的四環素族的水溶液都相當穩定。四環素族除可溶于低濃度的酸堿溶液,也可以微溶于水、甲醇、乙醇等溶液,但不溶于醚類溶液,如石油醚等[1~2]。四環素族抗生素主要包括金霉素、土霉素、四環素。四環素類抗生素在20 世紀中葉時期被科學家發現,屬于廣譜抗生素,廣泛應用于革蘭氏細菌和細胞支原體引起的細菌感染[3~5]。目前,四環素作為生長促進劑在畜牧業發展中發揮了重要的作用,并且可以預防和治療動物養殖過程中產生的多種感染性疾病[6~7]。然而,在動物屠宰之前,動物體內的四環素不能完全代謝掉,有很大一部分殘留下來,并主要集中在肝臟和腎臟部位[8~10]。人們在食用了有四環素類抗生素殘留的動物源食品,會對身體造成嚴重的傷害,引起較多嚴重疾病,比如肝腎中毒,影響中樞神經系統以及血液系統的疾病等。如果長期食用,不僅會產生耐藥菌株,還會產生過敏反應,降低對病菌的免疫能力[11]。我國2020年4月實施的GB 31650-2019《食品安全國家標準 食品中獸藥最大殘留限量》以及一些歐美等國家,都對食品中四環素類藥物殘留量做了嚴格的規定:土霉素、四環素、金霉素最低值都不得超過100 μg/kg。
目前,四環素類藥物檢測方法有許多種,主要有微生物檢測法、高效液相色譜法(HPLC)和酶聯免疫吸附法(ELISA)等。其中,微生物檢測法耗時較長,且容易被其他抗生素類干擾,檢測準確度不足。高效液相色譜法是目前常用的可以對大批量樣品進行檢測的方法,檢測靈敏度和準確度較高,但是前處理方法復雜費時,且成本較高,不適合快速檢測。酶聯免疫吸附法容易產生交互反應,且需要對每一種抗體進行分別標記,導致檢測費用較高,且無法解決同時檢測四環素類藥物多殘留的問題[12~13]。Charm Ⅱ放射免疫分析法具有樣品前處理簡單快速、特異性強、檢測時間短等優點,可以檢測四環素類藥物殘留總量,并且具有高效液相色譜法檢測的準確性和免疫吸附法檢測的高效性,適用于初篩檢測。該檢測方法也已經得到了美國FDA和歐盟等國家的認可和應用,具有廣闊的應用前景。
1 材料和方法
1.1 設備和材料
Charm Ⅱ7600 分析儀(美國Charm 公司);高速冷凍離心機;渦旋震蕩器;恒溫培養箱(80±2℃);閃爍液加液器;離心管;硼硅玻璃試管及試管塞;液體閃爍計數器(美國Charm 公司);藥片壓桿。
1.2 樣品和試劑
檢測基質為羊和雞的血清:分別采集兩種動物血液,將采集好的血液置于容器內,室溫下靜置10 h,等待其析出血清,并收集血清備用。檢測試劑為四環素類Charm Ⅱ檢測試劑盒、閃爍液、陰性對照液、多抗標準品等
1.3 實驗方法
1.3.1 實驗原理
微生物細胞表面存在著不同的特異性點位,并能夠與各種四環素類藥物共有功能基團相結合發生相應的微生物受體反應。檢測四環素類藥物殘留時,同時加入微生物受體結合物和[3H]標記過的金霉素。如果樣品中存在四環素類藥物殘留,就會同[3H]標記過的金霉素競爭結合微生物受體結合物的相關點位。用液體閃爍計數儀測定樣品反應后的[3H]含量的cpm 值(即每分鐘脈沖數),cpm 值越低,則四環素類藥物殘留量越高。
1.3.2 樣品制備
在50 ml 離心管中加入1 ml 血液樣品和30 ml MSU 提取緩沖溶液,渦旋振蕩5 min。將離心管于(80±2)℃的恒溫培養箱中放置45 min,取出后置于冷水中10 min,1750 g 離心10 min,取上清液備用。恢復室溫后,測定其pH 值是否為7.5,如不準確則使用試劑盒配置的M2 緩沖液或1 mol/L鹽酸調節pH 值為7.5,即為樣品測試液。
1.3.3 測定步驟
用藥片壓桿的平端將白色藥片壓入已加入300 μl 蒸餾水的玻璃試管內,渦旋振蕩10 s 直至藥片破碎。吸取4 ml 處理好的血液試樣放入試管中,壓入橙色藥片,用振蕩器上振蕩15 s,使樣品上下15 次,置于(65±1)℃的恒溫培養箱中3 min,取出后1750 g 離心5 min,離心停止后立即取出試管,倒掉上清液(此時不宜太用力,防止將有四環素標記的藥物甩出,造成結果不準確),用棉簽清理試管壁內的殘漬,注意不可觸碰沉淀物。向試管中加入300 μl 蒸餾水,搖動試管直至沉淀物完全破碎,之后加入3 ml 閃爍液,渦旋混勻至試管無不均一的云狀物,放置1 min 后,將試管放入Charm Ⅱ7600 分析儀中,讀取[3H]的cpm 值。
1.3.4 控制點的建立
選取六份已知不含四環素類藥物殘留的血清樣品,按照試劑盒使用說明書的要求加入不同濃度的抗生素,按照上述測定步驟進行測定,得到6 次計數值,計算平均值,則可計算出控制點為:平均值×(1+20%)。
1.3.5 結果判定
當樣品計數值大于控制點時,則判定為陰性樣品。當樣品計數值小于等于控制點時,在初篩時判定為疑似陽性,此時應對樣品進行復檢,同時增加一個陰性對照和陽性對照,判斷使用的檢測試劑是否失效,以及檢測的儀器是否出現問題。判定樣品為陽性有兩個要求:一是陰性對照的范圍內波動不可以超過陰性對照平均值的80%~120%;二是陽性對照的計數值必須要小于控制點。如果可以同時滿足以上兩點,并且重新測試的樣品計數值也小于控制點,則可以判定為陽性樣品。
2 結果與分析
2.1 抗原抗體的競爭性
在Charm Ⅱ放射免疫分析中的受體和[3H]標記的金霉素抗原的量是固定的,因此可以通過對不同藥物濃度檢測來確定方法的靈敏度。以MSU 萃取緩沖液為零標準,將MSU 多種抗生素標準品依次配制成10.0、20.0、50.0、100.0、200.0、500.0、1000.0 μg/kg 標準溶液,并分別測定cpm 值,表1結果顯示,測定的cpm 值與添加的藥物濃度呈反比,當到達一定濃度后cpm 值將不再變化。

表1 不同藥物濃度測定結果
2.2 檢出限以及線性范圍的確定
在已知陰性的基質中添加不同濃度的MSU 多種抗生素標準品進行測試,以確定基質的檢測限。分別向羊血清和雞血清中添加濃度分別為0、10.0、20.0、30.0、40.0、50.0 μg/kg 的四環素測試,得到結果見表2。

表2 不同基質中不同添加水平的測定結果
以添加水平的自然對數ln(ρ)為自變量,分別對相應質量濃度的羊血清和雞血清的cpm 數值相對值(即相應濃度cpm 值與陰性控制cpm 值的比值,B/B0)進行線性擬合,得到結果見圖1~2。
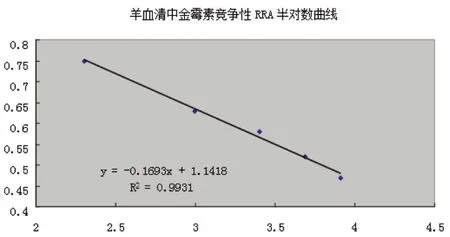
圖1 羊血清ln(ρ)與B/B0 值擬合曲線
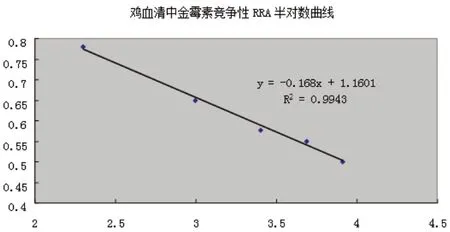
圖2 雞血清ln(ρ)與B/B0 值擬合曲線
各數據點都較好地分布在擬合曲線兩側,擬合情況良好,各種基質中ln(ρ)均與cpm 值存在著良好的線性關系。根據實際情況確定檢測限時,考慮到分析相對標準偏差,一般要測定兩項內容,分別是樣品空白加標與空白樣品,測定的cpm 值相對值應該小于0.6,確定金霉素在動物血清中的最低濃度應不小于20 μg/kg。
3 結論
Charm Ⅱ檢測方法不僅符合國內四環素快速檢測要求,同時也是其他國家采用的快速檢測手段,符合國際標準。使用Charm Ⅱ放射免疫分析法檢測動物血清中四環素類藥物殘留,可以提高檢測效率,降低檢測成本,適用于對大量活體動物體內四環素檢測的陽性初篩,具有檢測靈敏度高、穩定性良好、特異性強、準確度高等優點,是一種快速有效的檢測動物體內四環素類藥物殘留的篩選方法。

