濕法磷酸選擇性除雜制工業級磷酸二氫銨
王智娟
(曲靖師范學院化學與環境科學學院,云南曲靖655000)
磷酸二氫銨按其純度高低可分為農用級(NH4H2PO4質量分數≥82.7%)、工業級和食品級等,根據HG/T 4133—2010《工業磷酸二氫銨》標準規定,工業級磷酸二氫銨Ⅰ、Ⅱ、Ⅲ類產品的NH4H2PO4質量分數分別≥98.5%、≥98.0%、≥96.0%。 食品級磷酸二氫銨除要求NH4H2PO4質量分數≥96%外,對氟化物、砷和鉛等重金屬含量亦有嚴格要求。高純度磷酸二氫銨除用作水溶肥、阻燃劑、飼料添加劑和食品添加劑外[1-2],近年來在制備磷酸鹽光學玻璃[3]、鋰電池正極材料[4-5]和非線性光學器件[6-7]等方面的研究逐漸增多,因其在農業、消防、食品和材料等領域有廣闊的應用及市場前景,其需求量不斷增大。磷酸二氫銨制備方法有熱法磷酸和萃取法凈化磷酸[8]路線。前者工藝簡單、產品質量高,但受資源、能源和環境制約。 萃取法凈化磷酸路線先以溶劑萃取法制得精制磷酸,再通氨中和,經多效濃縮、冷卻結晶得到磷酸二氫銨[8],此法工藝長,萃取精制環節設備、技術投資大,成本高。 廖曉婷等[9]提出了磷酸脲母液溶劑萃取制磷酸二氫銨的工藝路線,產品純度達到99.45%、P2O5回收率達到85.34%, 但過程涉及多次萃取,流程復雜、萃取劑用量大。 故研究者更關注濕法磷酸直接制工業級磷酸二氫銨,此路線采用氨化方式將鐵、鋁、鎂、氟等雜質以磷酸復鹽形式沉淀析出[10],pH 越高,雜質去除率越高,但磷損失越大,產品P2O5收率僅為25%~40%[11-12],嚴重制約了該路線的經濟效益。
目前,濕法磷酸直接制工業級磷酸二氫銨技術的研究集中于調控氨化pH。濕法磷酸一步(或兩步)通氨中和至磷酸二氫銨中和度的路線雖簡單, 但產品含雜質較多,純度常低于95.7%[13-14];一步(或分步)通氨中和至pH>5,再以高純磷酸等將料液一步或分步中和至pH=4.5 的路線,磷酸二氫銨純度大于97.3%,但需多次調節pH 和固液分離,工藝復雜[15-16]。 磷酸二氫銨料液中加入絡合劑(如檸檬酸、檸檬酸鈉、EDTA 和EDTA 二鈉等)可絡合液相中殘存金屬離子,抑制其結晶析出,從而可提高磷酸二氫銨純度[17-18]。 此外,也有文獻報道用氫氟酸[19-20]凈化濕法磷酸,使鎂、鋁等雜質形成不含磷沉淀除去,如(NH4)x(Mg)y(Al)zF6(OH)6·2H2O、NaMgAlF6·xH2O、MgAl2F8、MgAlF5等,該法可減少P2O5損失,但需預加Al(NO3)3、Na2CO3等調整Al3+、Mg2+、Na+比例。 為進一步改善濕法磷酸直接制工業級磷酸二氫銨的路線,降低過程磷損失,簡化流程,本文考察了采用氟化鈉選擇性除雜再氨化中和制磷酸二氫銨工藝的可行性,在探討過程規律基礎上,初步建立了優化工藝。
1 實驗方法
1.1 實驗原料
采用國內某磷化工企業提供的濕法磷酸為原料,組成見表1。
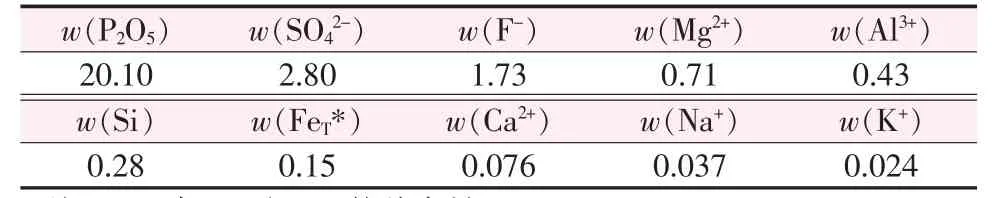
表1 濕法磷酸化學組成 %Table1 Chemicalcompositionofwet-processphosphoricacid
1.2 實驗方法
預除雜:稱取一定量濕法磷酸于燒杯中,置于恒溫磁力攪拌(250 r/min)水浴鍋,升溫至60 ℃后按化學計量比加入Ca(OH)2和Na2CO3以脫除SO42-和SiF62-。 反應2.0 h 后過濾分離。 選擇性除雜:稱取一定量預凈化磷酸于燒杯中,置于恒溫磁力攪拌(250 r/min)水浴鍋,升溫至50 ℃后加入NaF,反應1.0 h 后過濾分離。 固相用超純水洗滌后烘干待測(80 ℃)。磷酸二氫銨制備:稱取300 g 預除雜濕法磷酸,加入適量NaF,控制氟化鈉與磷酸質量比(mNaF/mH3PO4)為2.5%,在50 ℃下反應1.0 h 后,過濾濾液通氨至pH=4.5~4.6,80 ℃反應1.0 h 后過濾,濾液經濃縮、結晶制得磷酸二氫銨。
1.3 分析檢測
采用喹鉬檸酮重量法測定P2O5含量;氟離子選擇電極法測定F-含量;采用蒸餾后滴定法測定總氮含量; 利用電感耦合等離子體光譜儀(ICP,Spectro Arcos)測定金屬離子(Fe、Al、Mg、Ca、Na 和K)濃度;利用X 射線粉末衍射儀(XRD,D8 advanced)分析沉淀物組成;利用掃描電子顯微鏡(SEM,JSM 7401F)觀察沉淀物形貌。
2 結果與討論
2.1 氟化鈉對沉淀物組成的影響
圖1 為mNaF/mH3PO4為1.2%~6.0%時,反應1.0 h 后形成的沉淀物的XRD 譜圖。沉淀物主要由氟化復鹽[NaMgAl (F,OH)6·H2O、NH4MgAlF6、KMgAlF6和NaMgAlF6]組成。 以上4 種氟化復鹽出峰位置極接近, 但2θ 在29~31°的兩個特征峰的相對強度有差異。mNaF/mH3PO4<3.5%時,沉淀物以NaMgAl(F,OH)6·H2O、XMgAlF6(X=K+或NH4+)為主;mNaF/mH3PO4>3.5%時,沉淀物中NaMgAlF6衍射峰逐漸增強。mNaF/mH3PO4為6.0%時,沉淀物中出現鈣的硅鋁酸鹽物相。
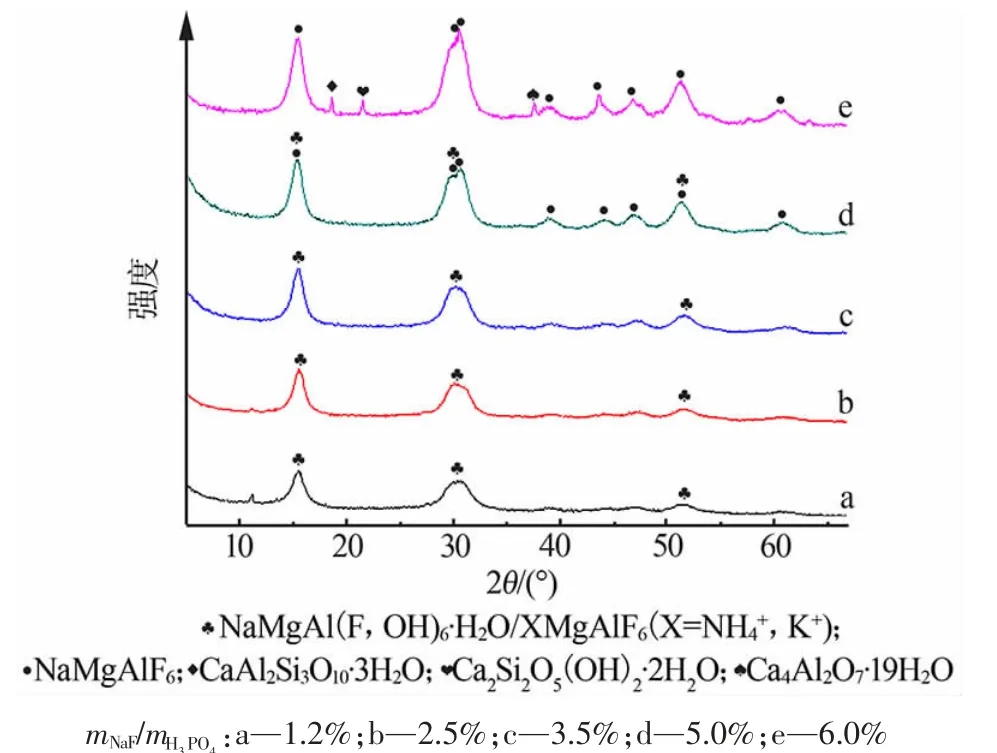
圖1 氟化鈉對沉淀物XRD 譜圖的影響Fig.1 Influence of NaF on XRD patterns of precipitates
2.2 氟化鈉對沉淀物形貌的影響
圖2 為氟化鈉對沉淀物形貌的影響。mNaF/mH3PO4為1.2%時,沉淀物呈細砂礫狀,mNaF/mH3PO4為2.5%時,沉淀物粒徑更細小,但有較明顯的松散團聚體,過濾時間分別為1 min 和3 min;氟化鈉添加量越多,形成的難過濾膠狀物越多,當mNaF/mH3PO4增大到6.0%時,沉淀物極其細小細密,過濾時間延長至21 min。

圖2 沉淀物SEM 圖Fig.2 SEM of precipitates
2.3 氟化鈉對雜質脫除的影響
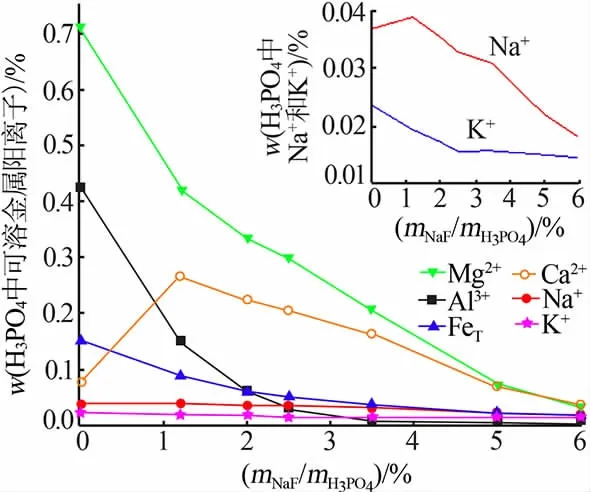
氟化鈉對雜質脫除的影響見圖3。 氟化鈉用量增大,磷酸中金屬陽離子含量總體呈下降趨勢,雜質脫除率提高。mNaF/mH3PO4為6.0%時,鎂、鋁、鐵、鉀和鈉質量分數分別下降至0.029%、0.002 7%、0.012%、0.014%和0.018%。鎂、鋁、鉀和鈉析出主要是由于形成NaMgAl(F,OH)6·H2O、XMgAlF6(X=Na+、K+或NH4+)沉淀,鐵的脫除可能是共沉淀作用[20]。 濕法磷酸中SiF62-在堿性條件下易生成硅凝膠(反應1),影響料漿黏度,使料漿難以過濾,故以Na2CO3進行預脫除(反應2);為消除SO42-對磷酸二氫銨結晶的影響,加入Ca(OH)2將其預脫除(反應3)。mNaF/mH3PO4在0~1.2%范圍時, 添加NaF 對Na+、Ca2+濃度降低的影響還不足以抵消外引Na2CO3和Ca(OH)2帶來的影響,這是圖3 中Na+和Ca2+濃度稍有上升的原因。隨氟化鈉用量增大,NaMgAl(F,OH)6·H2O、鈣的硅鋁酸鹽等沉淀逐漸增多,Na+和Ca2+含量持續下降,Ca2+質量分數逐漸降至0.037%(mNaF/mH3PO4為6%)。
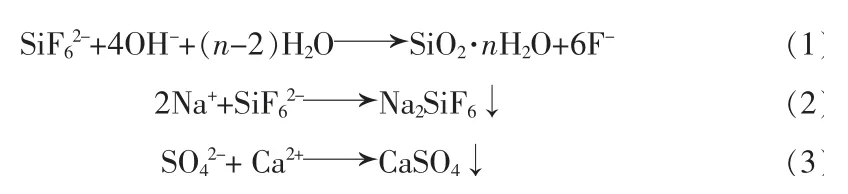
2.4 氟化鈉對磷酸中殘余F-含量的影響
氟化鈉對磷酸中殘余F-含量的影響如圖4 所示。mNaF/mH3PO4由1.2%增至2.5%時,磷酸中F-含量變化不大;mNaF/mH3PO4由2.5%增至5%時,磷酸中F-含量迅速由0.148%增至0.331%。 綜合考慮雜質脫除、殘留氟和過濾性能,mNaF/mH3PO4為2.5%時較合適。
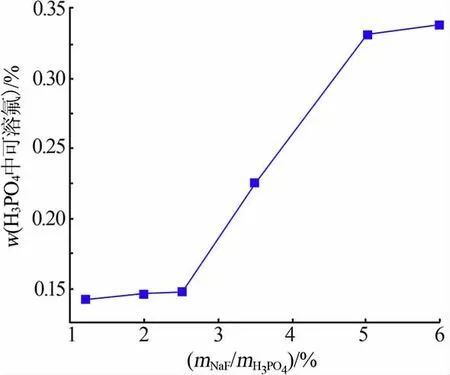
圖4 氟化鈉對磷酸中殘余F 含量的影響Fig.4 Effect of NaF on residual fluoride content in phosphoric acid
2.5 磷酸二氫銨的制備
圖5 為制得的磷酸二氫銨形貌及XRD 譜圖,其他結果見表2。 由圖5 可看出,制得的磷酸二氫銨呈四棱短柱狀,但顆粒大小不均勻,其XRD 特征峰位置與標準譜圖基本一致, 磷酸二氫銨平均純度達到98.53%,收率為86.2%,含氟質量分數為0.23%。
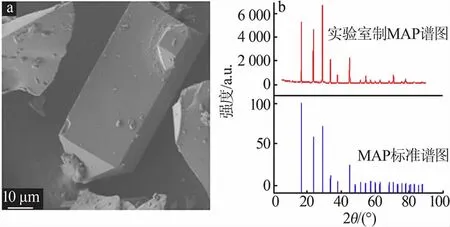
圖5 磷酸二氫銨SEM(a)及XRD 譜圖(b)Fig.5 SEM(a)and XRD pattern(b)of ammonium dihydrogen phosphate
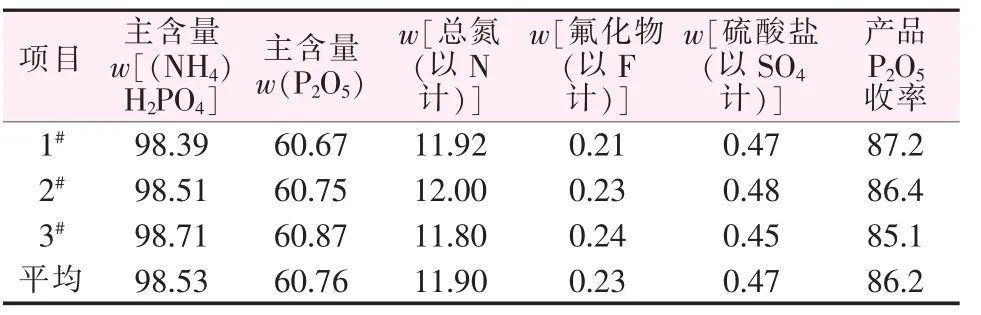
表2 磷酸二氫銨產品質量 %Table2 Productqualityofammoniumdihydrogenphosphate
3 結論
本文通過對濕法磷酸進行選擇性除雜,使液相中雜質金屬離子以NaMgAl(F,OH)6·H2O、XMgAlF6(X=Na+、K+或NH4+) 和鈣的硅鋁酸鹽等非含磷沉淀析出,由此可降低氨化過程P2O5損失。 mNaF/mH3PO4為2.5%時,磷酸二氫銨純度達到98.53%、收率為86.2%、氟殘留量較低(0.23%),滿足工業級磷酸二氫銨Ⅱ類指標。

