從銅陽極泥分銅渣堿浸液中回收碲
廖春發,鄒 耕,彭 珊,鄒建柏,周 迅
(江西理工大學 材料冶金化學學部,江西 贛州 341000)
自然界中,碲的獨立礦床較少,主要伴生于其他金屬礦[1-2]中。工業上主要從冶金副產物[3-4]中回收碲,其中銅陽極泥是回收碲的主要原料,所生產的碲占總產量的90%左右[5]。目前,從含碲溶液中分離提取碲的方法有置換法[6]、SO2還原法[7]或Na2SO3還原法[8]、沉淀分離法[9]等。置換法采用銅粉還原溶液中的碲,碲以Cu2Te形式回收[10-11],此法環境友好,碲回收率高,但對銅粉需求大,成本較高。采用SO2或Na2SO3還原溶液中碲,碲以單質形式沉淀。相較而言,以Na2SO3作還原劑,對環境污染小,碲沉淀時間短[8]。中和沉淀分離法是通過調節溶液pH,使碲以TeO2形式沉淀析出,但此法所得中和渣含較多雜質,需除雜[12-13]。
試驗針對銅陽極泥分銅渣超聲強化氧化堿浸含碲溶液[14],用Na2SO3將溶液中+6價碲預還原為+4價碲,再用Na2S除雜,最后調節除雜后液pH,使碲以TeO2形式沉淀。
1 試驗部分
1.1 試驗原料及方法
試驗料液為銅陽極泥分銅渣經超聲強化氧化堿浸所得溶液,pH為13~14,溶液中各主要元素質量濃度見表1。

表1 分銅渣堿浸液中各主要元素質量濃度 mg/L
1.2 試驗原理
(1)
還原后液中含有Cu2+、Pb2+等雜質。Cu2+、Pb2+易與S2-結合生成難溶MeS沉淀而被去除。PbS、CuS的Ksp[15]分別為1.3×10-28、6.3×10-36,而二硫化碲易溶于堿性含硫溶液[16],因此可采用Na2S作除雜劑。

(2)

(3)
(4)

(5)
(6)
25 ℃時各反應的平衡常數[17]K1=10-2.2,K2=10-5.03,K3=10-11.41。此時溶液中碲總濃度[Te(Ⅳ)]T計算公式為
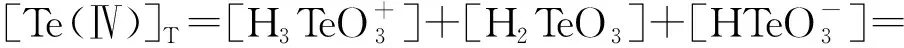
(7)
根據公式(5),繪制lg([Te(Ⅳ]T)-pH關系曲線,如圖1所示。
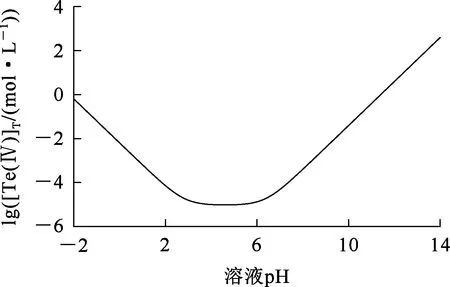
圖1 25 ℃時lg([Te(Ⅳ)]T)-pH關系曲線
由圖1看出:隨溶液pH降低,溶液中+4價碲濃度下降,在pH為3~6時達最低,為10-5mol/L,即此時溶液中的碲基本水解完全;繼續降低pH,溶液中碲濃度又有所提高,水解產生的碲沉淀物有部分溶解。因此,要使溶液中的碲盡可能多地沉淀,需控制水解pH為3~6。
2 試驗結果與討論
2.1 堿浸液的預還原
2.1.1 還原時間對預還原的影響
Na2SO3用量為理論用量的1.0倍,反應溫度70 ℃,攪拌速度300 r/min,還原時間對碲還原的影響試驗結果如圖2所示。可以看出:隨還原時間延長,碲還原率提高明顯;但反應9 min后,再繼續反應,碲還原率反而逐漸下降。隨反應進行,溶液中生成的+4價碲與Na2SO3反應生成碲單質,導致溶液中+4價碲濃度降低。在反應時間為9 min時,碲還原率最高,為85.21%。
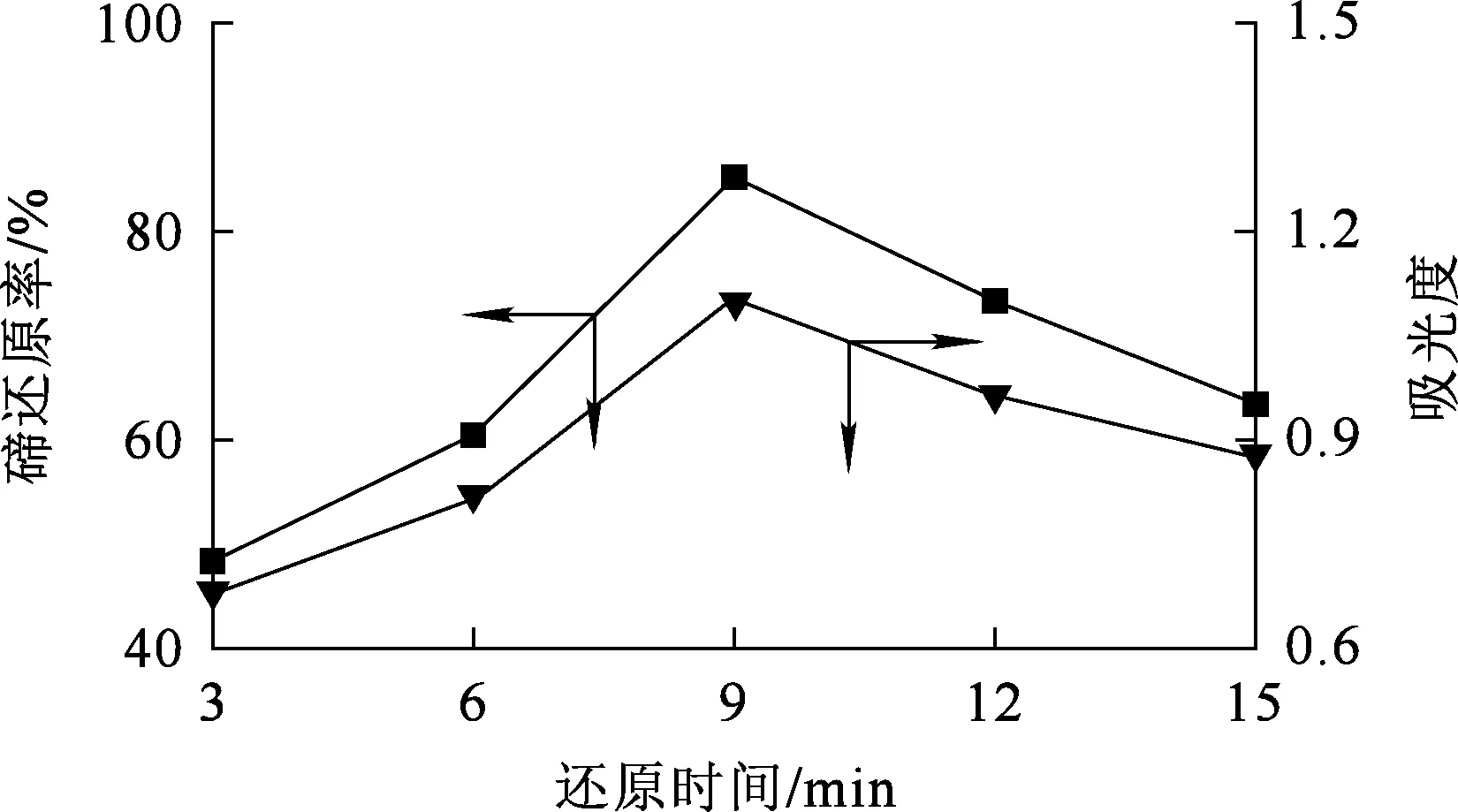
圖2 還原時間對碲還原的影響
2.1.2 Na2SO3用量對預還原的影響
還原溫度70 ℃,還原時間9 min,攪拌速度300 r/min,Na2SO3用量對碲還原的影響試驗結果如圖3所示。
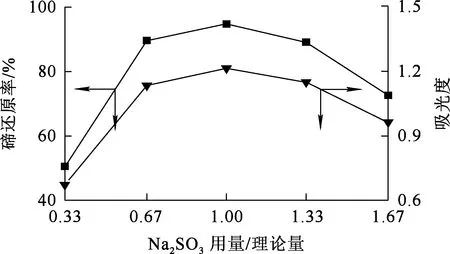
圖3 Na2SO3用量對碲還原的影響
由圖3看出:隨Na2SO3用量增加,碲還原率呈先升高后下降趨勢,Na2SO3用量為0.15 g即理論用量的1.0倍時碲還原率最高,為94.75%。這是由于隨Na2SO3用量過量,已經被還原的+4價碲被還原為單質碲,致使溶液中+4價碲濃度下降。
2.1.3 還原溫度對預還原的影響
Na2SO3用量為理論用量的1.0倍,還原時間9 min,攪拌速度300 r/min,反應溫度對碲還原的影響試驗結果如圖4所示。可以看出:隨還原溫度升高,碲還原率逐漸提高;溫度升至70 ℃時,碲還原率達最大,為92.27%; 但繼續升溫,碲還原率有所降低。隨溫度升高,溶液中的+4價碲與Na2SO3的反應加劇,使+4價碲被繼續還原為碲單質,導致溶液中+4價碲濃度降低。
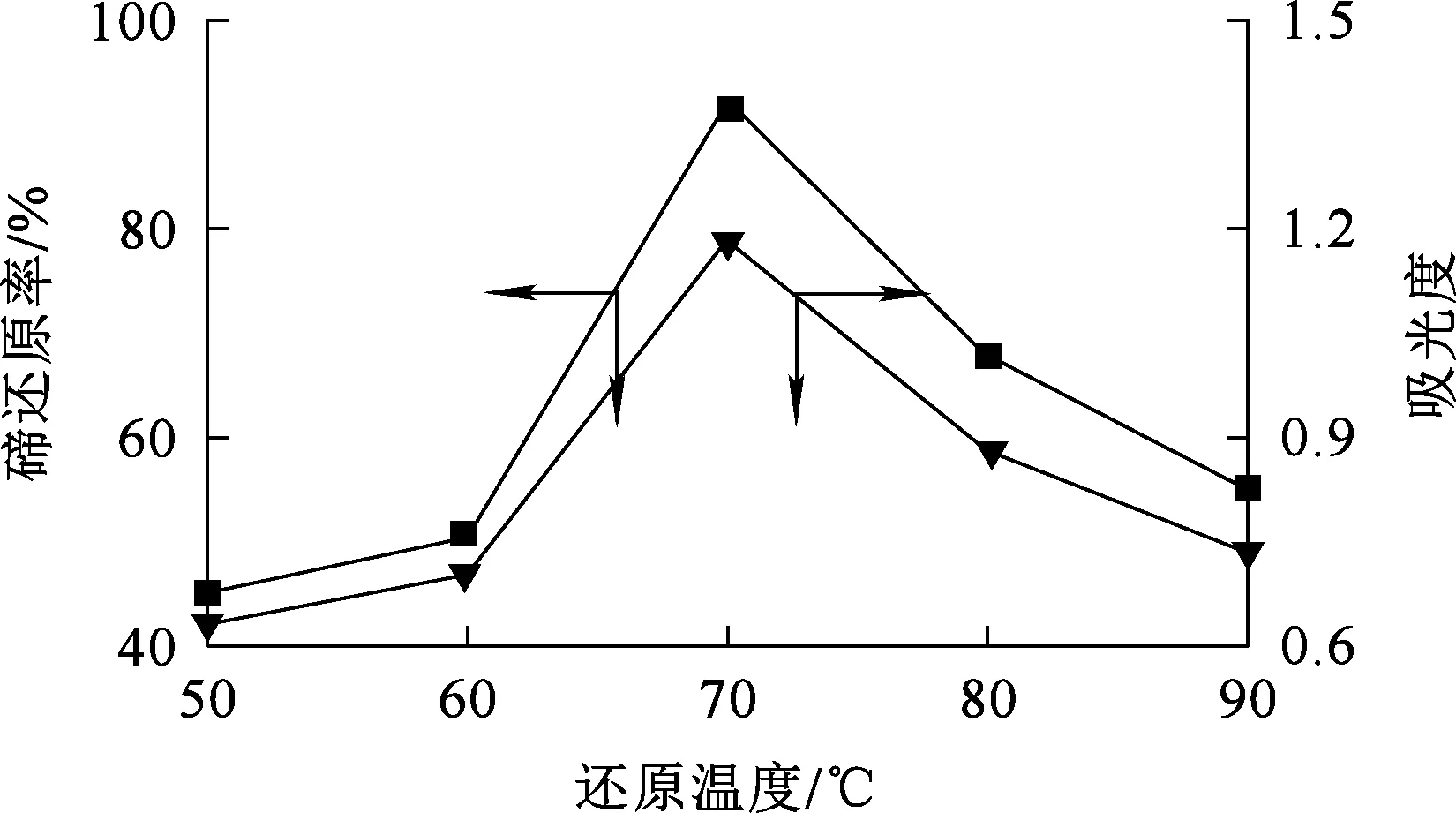
圖4 還原溫度對碲還原的影響
2.2 預還原后溶液的除雜
2.2.1 反應時間對脫除雜質的影響
Na2S用量為理論用量的1.0倍,反應溫度70 ℃,攪拌速度300 r/min,反應時間對脫除雜質Pb2+、Cu2+的影響試驗結果如圖5所示。
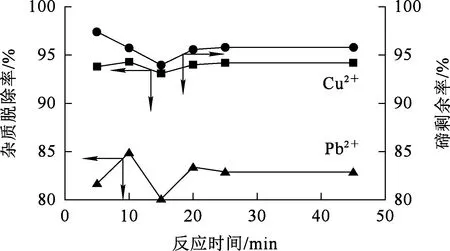
圖5 反應時間對脫除雜質Pb2+、Cu2+的影響
由圖5看出:反應10 min,溶液中Pb2+、Cu2+脫除率達最大;隨反應進行,雜質脫除率略有降低之后保持穩定;溶液中的碲則隨反應時間延長先略有降低后趨于穩定。反應初期,部分+4價碲與Na2S反應被還原為碲單質,導致溶液中+4價碲濃度降低。反應時間為10 min時,雜質脫除率較高且碲損失較少。
2.2.2 Na2S添加量對脫除雜質的影響
反應時間10 min,反應溫度70 ℃,攪拌速度300 r/min,Na2S添加量對脫除雜質Pb2+、Cu2+的影響試驗結果如圖6所示。可以看出:Na2S添加量低于理論量的1.0倍時,隨Na2S添加量增加,Pb2+脫除率提高明顯,之后隨Na2S添加量增加,Pb2+脫除率提高幅度不大;Cu2+脫除率隨Na2S添加量增加略有提高,之后保持穩定;溶液中碲濃度則呈下降趨勢。溶液中的碲與過量的Na2S反應會生成單質碲,為取得較高的Pb2+、Cu2+脫除率及較低的碲損失率,確定Na2S用量以理論量的1.0倍為宜。
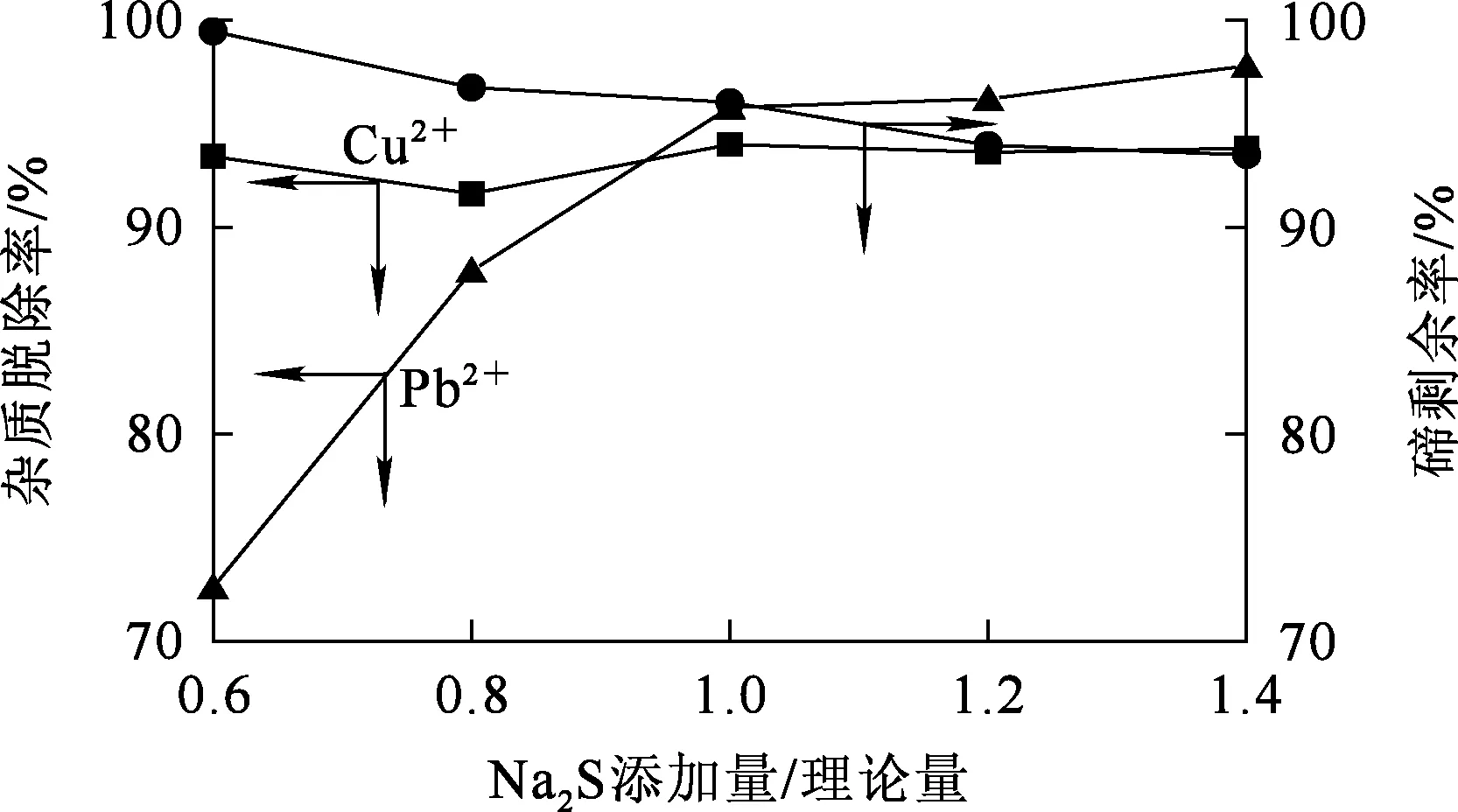
圖6 Na2S添加量對脫除雜質Pb2+、Cu2+的影響
2.2.3 反應溫度對脫除雜質的影響
反應時間10 min,Na2S用量為理論量的1.0倍,攪拌速度300 r/min,反應溫度對脫除雜質Pb2+、Cu2+的影響試驗結果如圖7所示。
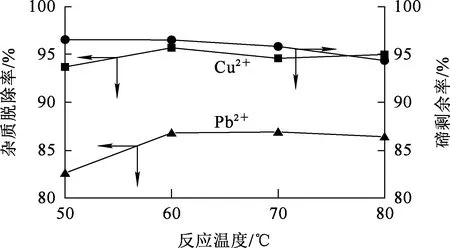
圖7 反應溫度對脫除雜質Pb2+、Cu2+的影響
由圖7看出:隨反應溫度升高,Pb2+、Cu2+脫除率僅小幅升高后趨于穩定;溶液中碲濃度則在溫度高于70 ℃后略有下降。隨溫度上升,溶液中的部分碲與Na2S反應,+4價碲被還原為單質碲,導致溶液中+4價碲濃度略有降低。綜合考慮,確定溫度以60 ℃為宜,此條件下,Pb2+、Cu2+脫除率較高分別為86.8%、95.7%,而碲損失較少。
2.3 除雜后液水解沉淀碲
2.3.1 水解時間對碲水解的影響
調節水解終點溶液pH為4左右,水解溫度90 ℃,攪拌速度300 r/min,水解時間對碲水解的影響試驗結果如圖8所示。可以看出:水解時間小于10 min時,碲水解率提高較快,水解10 min時,碲已基本水解完全,水解率為98.16 %;繼續水解,碲水解率基本保持穩定不再變化。
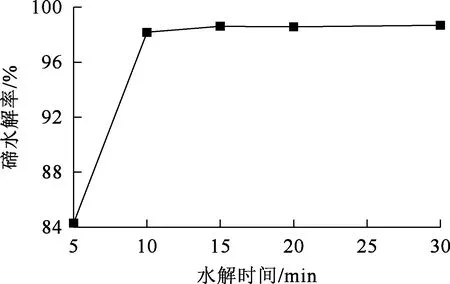
圖8 水解時間對碲水解的影響
2.3.2 水解溫度對碲水解的影響
水解時間10 min,水解終點溶液pH為4左右,攪拌速度300 r/min,水解溫度對碲水解的影響試驗結果如圖9所示。
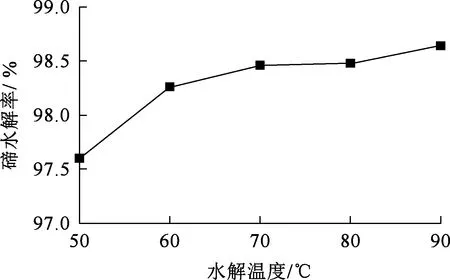
圖9 水解溫度對碲水解的影響
由圖9看出,溫度從50 ℃升至90 ℃,碲水解率提高幅度不大,表明溫度對碲的水解影響較小。但溫度升高有助于沉淀物顆粒長大,方便后續過濾,因此確定水解溫度以90 ℃為宜。
2.3.3 水解終點溶液pH對碲水解及TeO2純度的影響
水解時間10 min,水解溫度90 ℃,攪拌速度300 r/min,溶液終點pH對碲水解及TeO2純度的影響試驗結果如圖10所示。
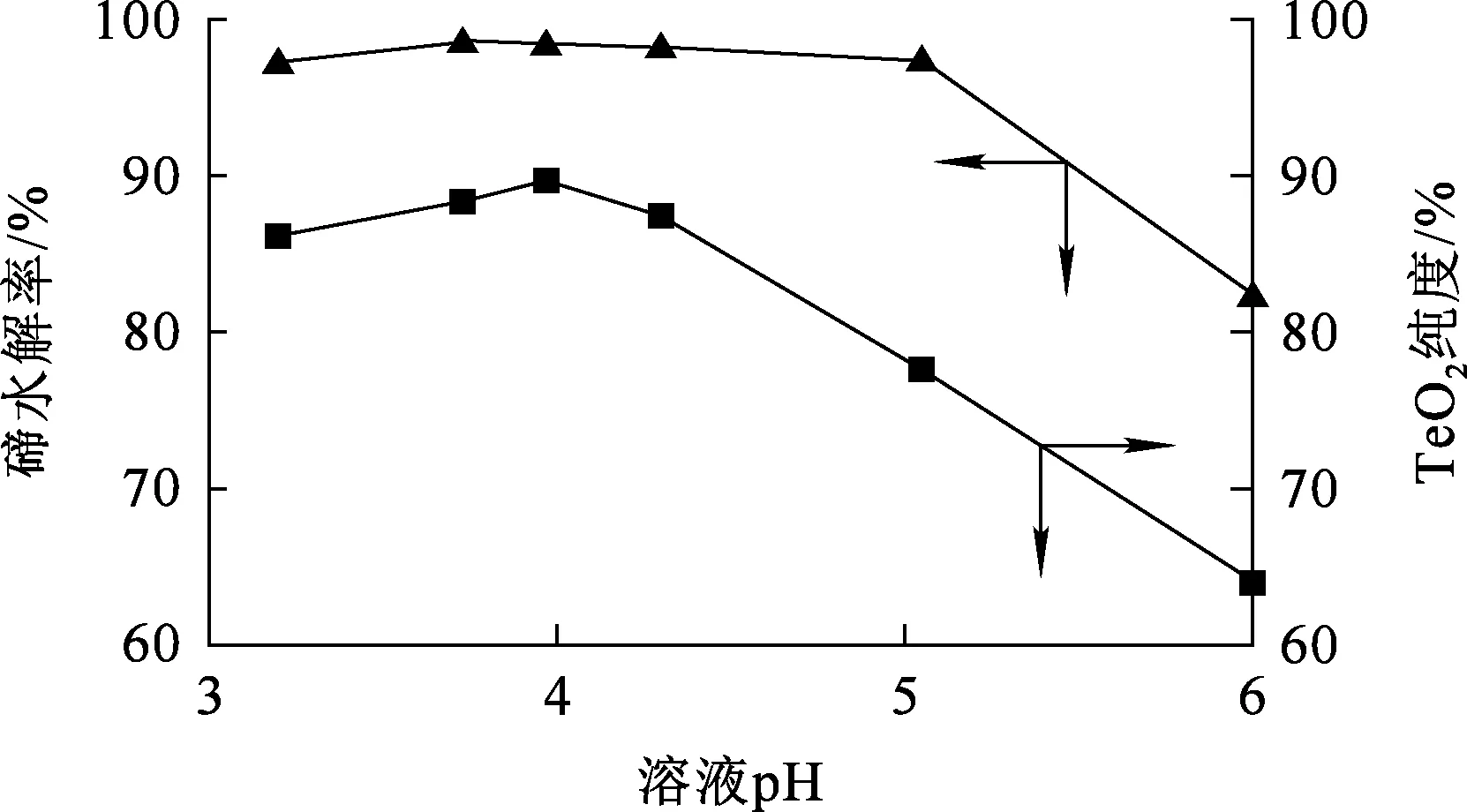
圖10 水解終點溶液pH對碲水解及TeO2純度的影響
由圖10看出:隨水解終點溶液pH降低,碲水解率提高明顯,并在溶液終點pH為4左右達最大,為98.44%;終點pH繼續降低,則碲水解率下降。這是由于水解產物TeO2會溶于強酸,此結果與前面的理論分析結論基本一致。為得到較多的碲沉淀物應控制水解終點溶液pH為4左右。
最佳條件下獲得的碲水解產物經過濾、烘干,并進行XRD、SEM-EDS分析,結果如圖11~13所示。可以看出:水解產物主要是TeO2,顆粒大小不一,純度為89.69 %。
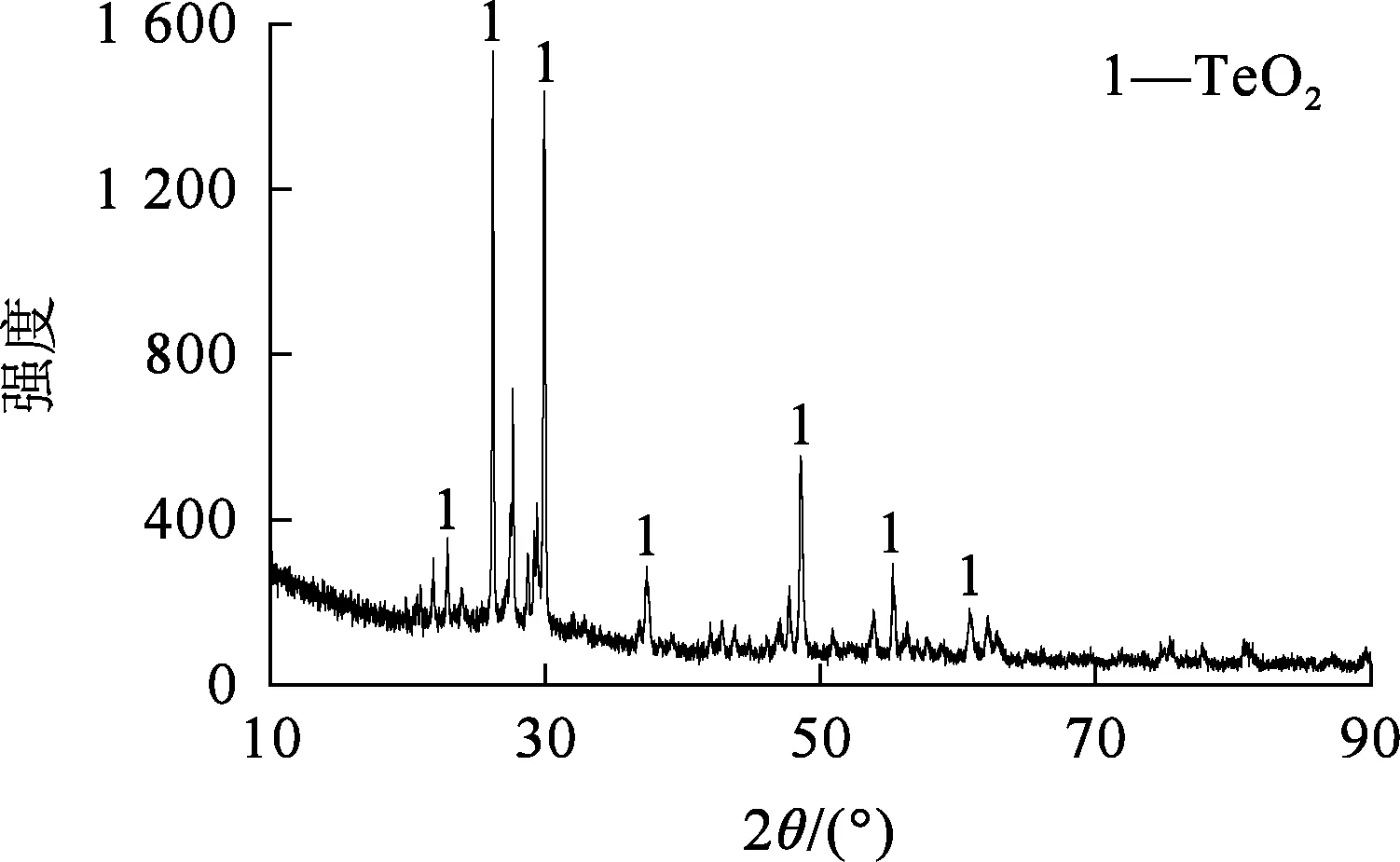
圖11 水解產物的XRD圖譜
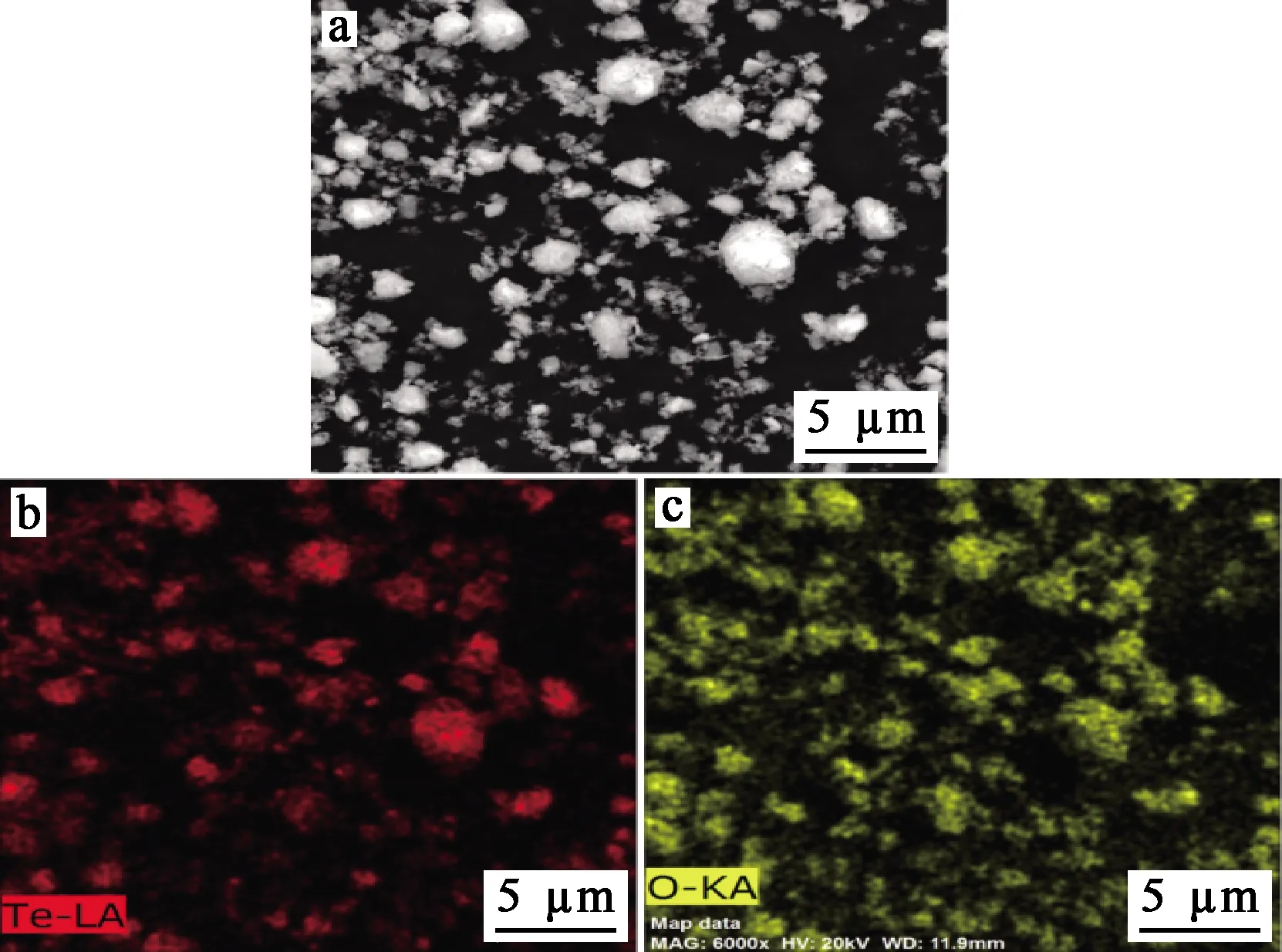
a—水解產物SEM形貌(6 000倍);b—Te元素面掃;c—O元素面掃。圖12 水解產物的SEM形貌及面掃描
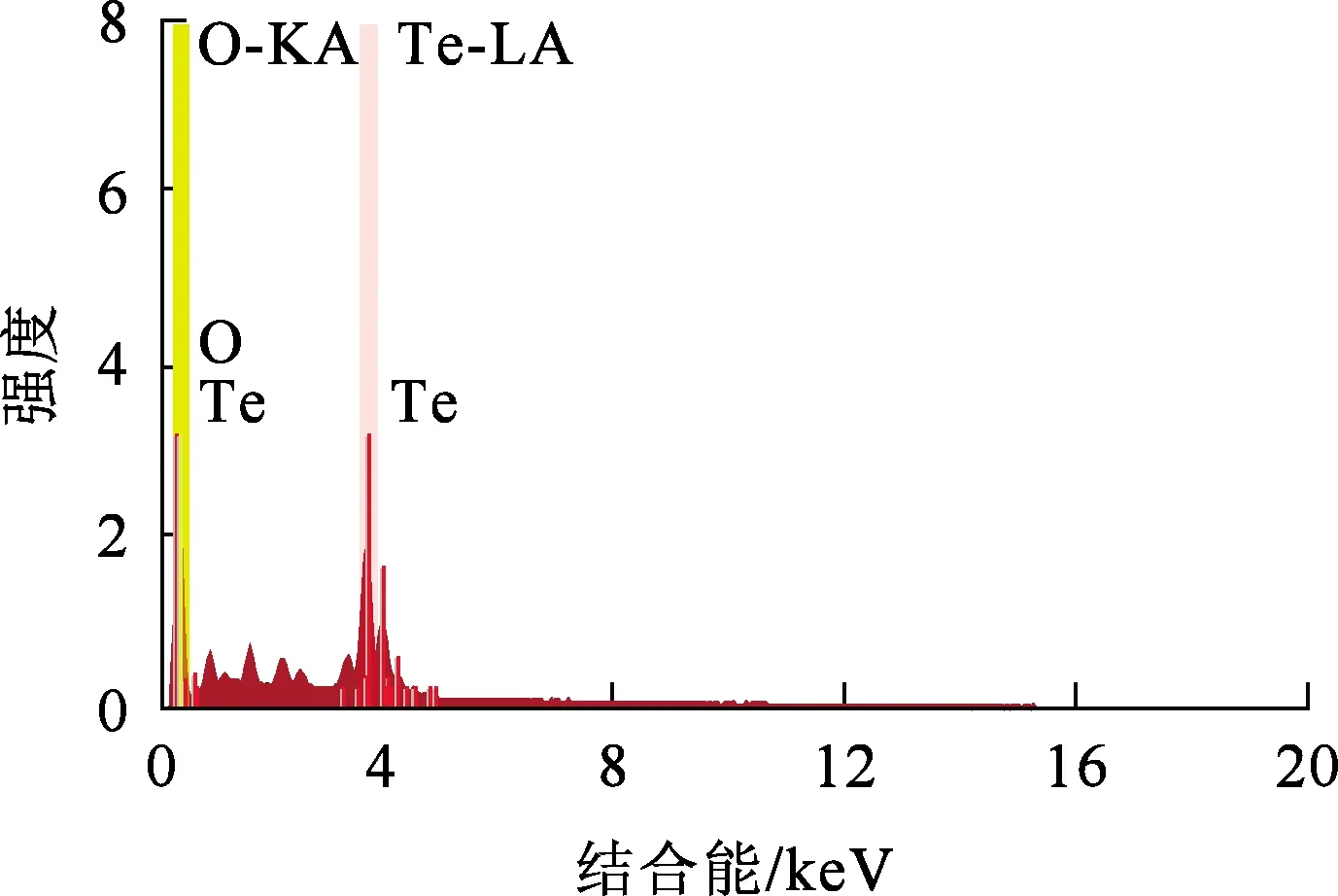
圖13 水解產物的EDS分析結果
3 結論
對銅陽極泥分銅渣超聲強化氧化堿浸所得含碲溶液,先進行預還原,再對還原后液除雜、調終點pH進行水解,最終獲得TeO2粉末。適宜條件下,碲還原率為92.27%,Pb2+、Cu2+脫除率86.8%、95.7%,碲水解率達98.44%,所制得TeO2粉末純度為89.69%。

