丹參酮ⅡA抑制軟骨細胞炎癥、軟骨基質降解的機制及對大鼠骨關節炎的影響
張建業,張衛華,韓 俊,陳 東
骨關節炎(osteoarthritis, OA)是一種常見的膝關節疾病,多見于老年患者。OA的主要特征包括軟骨退變、關節內炎癥和軟骨下骨重建[1]。OA的病因尚不清楚,但最近研究表明,炎性細胞因子參與了OA的發生和發展。白細胞介素-1β(IL-1β)在OA的發生發展中起關鍵作用[2]。IL-1β的釋放促進了多種炎性介質和分解代謝因子,如一氧化氮合酶(iNOS)、環氧化酶-2(COX-2)、前列腺素E2(PGE2)、腫瘤壞死因子-α(TNF-α)和基質金屬蛋白酶(MMPs)的產生和釋放,這些炎性介質和分解代謝因子可導致軟骨細胞功能障礙和細胞外基質降解[3-4]。因此,抑制IL-1β和IL-1β誘導的炎癥反應可能是治療OA的有效策略。β-arrestin2是arrestin家族成員之一,在哺乳動物中廣泛表達。研究表明,β-arrestin2通過降低炎性介質的表達,參與抑制脂多糖(LPS)誘導的TLR4/NF-κB信號通路激活[5]。雖然甾體類和非甾體類抗炎藥可用于治療OA,但是其不良反應嚴重,療效欠佳[6]。因此,具有多種抗炎作用和低毒作用的植物性天然治療藥物越來越受到人們的關注。丹參酮ⅡA(Tan ⅡA)是丹參酮的主要活性成分,其水溶性衍生物可抑制內皮細胞NF-κB信號通路,抑制LPS誘導的炎癥反應[7]。此外,Tan ⅡA通過下調促炎癥因子的產生減輕LPS誘導的急性肺損傷[8],提示Tan ⅡA在炎癥性疾病治療中起潛在作用。然而,Tan ⅡA對關節軟骨細胞炎癥及軟骨基質降解的影響及其作用機制尚不清楚。因此,本研究旨在探究Tan ⅡA通過調節β-arrestin2對軟骨細胞炎癥及軟骨基質降解的影響,進一步明確Tan ⅡA對OA大鼠的影響,以期為明確Tan ⅡA在OA中的作用機制提供新的科學資料。
1 材料與方法
1.1材料 大鼠關節軟骨細胞和大鼠關節軟骨細胞專用完全培養基購自武漢普諾賽生命科技有限公司;Tan ⅡA購自成都普利斯生物科技有限公司;RIPA裂解液和特超敏ECL化學發光試劑盒(BeyoECL Star)購自上海碧云天生物技術有限公司;一氧化氮(NO)測定試劑盒購自南京建成生物工程研究所;collagen Ⅱ、p65和基質金屬蛋白酶1(MMP1)抗體購自武漢三鷹生物技術有限公司;β-arrestin2、iNOS、Aggrecan和基質金屬蛋白酶13(MMP13)抗體購自美國Abcam公司;基質金屬蛋白酶3(MMP3)、COX-2和p-p65抗體購自美國Cell Signaling Technology;GAPDH抗體和二抗購自武漢博士德生物工程有限公司;大鼠PGE2酶聯免疫吸附法(ELISA)檢測試劑盒購自上海酶聯生物科技有限公司;軟骨染色液購自北京索萊寶科技有限公司。
1.2細胞培養 大鼠關節軟骨細胞用大鼠關節軟骨細胞專用完全培養基,于37℃、5% CO2培養箱中培養。每隔2 d更換1次培養基。
1.3細胞增殖檢測軟骨細胞活力 將對數生長期大鼠關節軟骨細胞接種于96孔板中,5×103個/孔,細胞置于37℃、5% CO2培養箱中培養24 h。隨后IL-1β(10 ng/ml)處理細胞12 h(IL-1β組),對照組大鼠添加磷酸緩沖鹽溶液。將細胞培養基更換為含有不同濃度Tan ⅡA(6.25、12.50、25.00、50.00、100.00 μmol/L,分別作為A、B、C、D、E組)的完全培養基,細胞置于37℃、5% CO2培養箱中培養24 h。向每孔細胞內加入CCK-8溶液10 μl,37℃條件下孵育3 h。酶標儀測定450 nm處的吸光值。細胞活力=[(實驗組OD450-空白組OD450)/(對照組-空白組)]×100%,OD450為450 nm波長處的吸光度值。
1.4Western blot檢測 收集大鼠關節軟骨細胞,RIPA裂解液裂解細胞,12 000 r/min 4℃條件下離心取上清,BCA法測定蛋白濃度。取樣本蛋白25 μg于十二烷基硫酸鈉聚丙烯酰胺凝膠電泳中分離,隨后轉至聚偏二氟乙烯膜上。10%脫脂奶粉封閉,隨后加入一抗iNOS(1︰2000)、COX-2(1︰5000)、MMP1(1︰1000)、MMP3(1︰5000)、基質金屬蛋白酶13(MMP13,1︰2000)、Ⅱ型膠原(1︰1500)、Aggrecan(1︰1000)、β-arrestin2(1︰2000)、p-p65(1︰5000)、p65(1︰3000)和GAPDH(1︰10000)稀釋液,4℃條件下過夜孵育。TBST清洗后,加入二抗(1︰5000稀釋)室溫孵育1 h后,滴加BeyoECL Star工作液到膜上,用化學發光成像儀檢測。
1.5ELISA檢測 對數生長期大鼠關節軟骨細胞接種于6孔板中,接種密度為4×105個/ml,細胞置于37℃、5% CO2培養箱中培養24 h。按照“1.3”中步驟,向細胞中分別添加IL-1β(10 ng/ml)和Tan ⅡA(25 μmol/L和50 μmol/L),細胞置于37℃、5% CO2培養箱中培養24 h。收集細胞培養上清液,按照ELISA試劑盒說明書檢測上清液中PGE2含量。
1.6NO含量檢測 取對數生長期大鼠關節軟骨細胞接種于6孔板中,接種密度為4×105個/ml,細胞置于37℃、5% CO2培養箱中培養24 h。按照“1.3”中步驟,向細胞中分別添加IL-1β(10 ng/ml)和Tan ⅡA(25 μmol/L和50 μmol/L),細胞置于37℃、5% CO2培養箱中培養24 h。收集細胞培養上清液,根據NO測定試劑盒說明書檢測上清液中NO含量。
1.7OA大鼠模型的建立及給藥處理 24只10周齡雄性SD大鼠購自武漢市萬千佳興生物科技有限公司,實驗動物許可證號SCXK(鄂)2016-0011,飼養于無菌環境中,飼養溫度(22±2)℃,晝夜交替,提供充足飲水及飼料。待大鼠適應環境1周后,隨機分為對照組、模型組和Tan ⅡA組,每組8只。模型組和Tan ⅡA組采用改良Hulth法[9]建立膝骨關節炎大鼠模型,大鼠腹腔注射3%戊巴比妥鈉(2 ml/kg),于大鼠左髕骨上方正中做一切口,切除內側半月板及內側副韌帶。對照組大鼠進行相同手術操作,但不切除內側半月板及內側副韌帶。術后連續3 d予青霉素20萬單位肌內注射預防感染。術后1周,Tan ⅡA組大鼠予Tan ⅡA 0.5 mg/kg灌胃[10],對照組和模型組予等量0.9%氯化鈉注射液灌胃,均連續4周。
1.7.1組織取材:末次灌胃24 h后,3%戊巴比妥鈉(2 ml/kg)腹腔注射麻醉大鼠。無菌條件下打開膝關節腔,刀片矢狀位切取股骨內側髁及脛骨平臺約3 mm厚關節軟骨標本,于10%多聚甲醛中固定,隨后進行后續實驗。
1.7.2HE染色及Mankin評分:10%多聚甲醛固定軟骨標本48 h,20%EDTA脫鈣4周。常規石蠟包埋、切片。石蠟切片常規脫蠟至水,蘇木素染色10 min,0.7%鹽酸乙醇分化數秒,流水洗滌后,伊紅液浸染3 min。梯度酒精脫水,二甲苯透明,中性樹膠封片。切片于光學顯微鏡下進行觀察。Mankin法[11]評估軟骨組織病理學變化。
1.7.3甲苯胺藍染色:10%多聚甲醛固定軟骨標本48 h,20%EDTA脫鈣4周。常規石蠟包埋、切片。石蠟切片常規脫蠟至水,軟骨染色液浸染30 min。自來水洗2 min后,丙酮分化軟骨細胞呈紫藍色。梯度酒精脫水,二甲苯透明,中性樹膠封片。切片于光學顯微鏡下進行觀察。
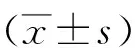
2 結果
2.1Tan ⅡA對大鼠軟骨細胞活力的影響 Tan ⅡA在6.25、12.50、25.00、50.00 μmol/L濃度下對大鼠軟骨細胞活力無明顯影響(P>0.05),Tan ⅡA在100.00 μmol/L濃度下可抑制大鼠軟骨細胞活力(P<0.05),見表1。因此后續的細胞實驗Tan ⅡA使用濃度為25.00 μmol/L和50.00 μmol/L。與對照組相比,IL-1β可顯著降低軟骨細胞活力(P<0.05),與IL-1β組相比,Tan ⅡA(25.00 μmol/L和50.00 μmol/L)呈劑量依賴性升高軟骨細胞活力(P<0.05)。見表2。
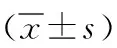
表1 丹參酮ⅡA對大鼠軟骨細胞活力的影響
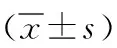
表2 丹參酮ⅡA對白細胞介素-1β誘導大鼠軟骨細胞活力的影響
2.2Tan ⅡA對IL-1β誘導大鼠軟骨細胞NO、PGE2、iNOS和COX-2表達的影響 與對照組相比,IL-1β顯著升高大鼠軟骨細胞中NO、PGE2、iNOS和COX-2的表達(P<0.05);與IL-1β組相比,Tan ⅡA(25.00 μmol/L和50.00 μmol/L)呈劑量依賴性降低大鼠軟骨細胞中NO、PGE2、iNOS和COX-2的表達(P<0.05)。見圖1和表3。
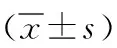
表3 丹參酮ⅡA對IL-1β誘導大鼠軟骨細胞NO、PGE2、iNOS和COX-2表達的影響

圖1 丹參酮ⅡA對IL-1β誘導大鼠軟骨細胞iNOS和COX-2蛋白表達的影響 iNOS為一氧化氮合酶,COX-2為環氧化酶-2;IL-1β組僅予白細胞介素-1β處理,C、D組分別予25.00、50.00 μmol/L丹參酮ⅡA處理
2.3Tan ⅡA對IL-1β誘導的大鼠軟骨細胞MMPs表達的影響 與對照組相比,IL-1β可顯著升高大鼠軟骨細胞中MMP1、MMP3和MMP13的表達(P<0.05);與IL-1β組相比,Tan ⅡA(25.00 μmol/L和50.00 μmol/L)呈劑量依賴性降低大鼠軟骨細胞中MMP1、MMP3和MMP13的表達(P<0.05)。見圖2和表4。
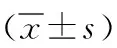
表4 丹參酮ⅡA對白細胞介素-1β誘導的大鼠軟骨細胞基質金屬蛋白酶表達的影響

圖2 丹參酮ⅡA對白細胞介素-1β誘導的大鼠軟骨細胞基質金屬蛋白酶表達的影響 對照組予白細胞介素-1β+磷酸緩沖鹽溶液處理,IL-1β組僅予白細胞介素-1β處理,C、D組分別予25.00、50.00 μmol/L丹參酮ⅡA處理;MMP1為基質金屬蛋白酶1,MMP3為基質金屬蛋白酶3,MMP13為基質金屬蛋白酶13
2.4Tan ⅡA對IL-1β誘導的大鼠軟骨細胞Ⅱ型膠原和Aggrecan的影響 與對照組相比,IL-1β可顯著降低Ⅱ型膠原和Aggrecan的表達(P<0.05);與IL-1β組相比,Tan ⅡA(25.00 μmol/L和50.00 μmol/L)呈劑量依賴性升高Ⅱ型膠原和Aggrecan的表達(P<0.05)。見圖3和表5。
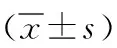
表5 丹參酮ⅡA對白細胞介素-1β誘導的大鼠軟骨細胞Ⅱ型膠原和Aggrecan的影響

圖3 丹參酮ⅡA對白細胞介素-1β誘導的大鼠軟骨細胞Ⅱ型膠原和Aggrecan的影響 對照組予白細胞介素-1β+磷酸緩沖鹽溶液處理,IL-1β組僅予白細胞介素-1β處理,C、D組分別予25.00、50.00 μmol/L丹參酮ⅡA處理
2.5Tan ⅡA對對IL-1β誘導的大鼠軟骨細胞β-arrestin2和NF-κB通路的影響 與對照組相比,IL-1β可顯著降低β-arrestin2的表達,升高p-p65/p65的表達(P<0.05);與IL-1β組相比,Tan ⅡA(25.00 μmol/L和50.00 μmol/L)呈劑量依賴性升高β-arrestin2的表達和劑量依賴性降低p-p65/p65的表達(P<0.05)。見圖4和表6。
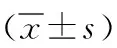
表6 丹參酮ⅡA對白細胞介素-1β誘導大鼠軟骨細胞β-arrestin2和NF-κB通路的影響

圖4 丹參酮ⅡA對白細胞介素-1β誘導大鼠軟骨細胞β-arrestin2和NF-κB通路的影響 對照組予白細胞介素-1β+磷酸緩沖鹽溶液處理,IL-1β組僅予白細胞介素-1β處理,C、D組分別予25.00、50.00 μmol/L丹參酮ⅡA處理
2.6各組大鼠膝關節軟骨組織病理學及相關指標變化 對照組大鼠軟骨表面光滑,軟骨細胞排列整齊,模型組大鼠軟骨表面明顯粗糙,軟骨層變薄,軟骨細胞排列紊亂,提示Tan ⅡA可明顯改善OA大鼠軟骨組織病理學變化。見圖5、圖6。與對照組相比,模型組大鼠Mankin評分顯著升高(P<0.05);與模型組相比,Tan ⅡA組大鼠Mankin評分顯著降低(P<0.05)。見表7。

表7 各組大鼠關節損傷相關指標比較分)

圖5 各組大鼠膝關節軟骨組織HE染色所示(標尺=50 μm) Tan ⅡA組造模成功后予丹參酮ⅡA 0.5 mg/kg灌胃,模型組造模成功后和對照組(未造模)予等量0.9%氯化鈉注射液灌胃

圖6 各組大鼠膝關節軟骨組織甲苯胺藍染色所示(標尺=50 μm) Tan ⅡA組造模成功后予丹參酮ⅡA 0.5 mg/kg灌胃,模型組造模成功后和對照組(未造模)予等量0.9%氯化鈉注射液灌胃
3 討論
OA是最常見的退行性關節炎,以關節功能障礙和身體殘疾為特征。OA的臨床特征包括關節痛、關節僵硬和活動能力喪失。炎癥反應和代謝紊亂對OA的發展至關重要[12]。盡管近年來,我們對OA的治療取得了極大的進步,但自20世紀中葉以來,OA的患病率已翻了一番[13]。已有研究證明Tan ⅡA在其他疾病中具有抗炎作用[14],然而Tan ⅡA在OA中的作用機制尚不明確。因此,本研究旨在探究Tan ⅡA對OA軟骨細胞及軟骨基質的作用,以期為OA的治療提供新的科學資料。
在OA過程中,IL-1β刺激NO、iNOS、PGE2、TNF-α和COX-2等炎性介質的產生和分泌,導致軟骨細胞功能障礙[3-4]。MMPs和ADAMTS-5是參與軟骨降解的關鍵酶[15]。益母草能明顯抑制IL-1β誘導的軟骨細胞中炎性因子NO、PGE2和TNF-α的產生,降低iNOS、COX-2、MMP3、MMP13和ADAMTS-5的表達[16]。研究表明,Tan ⅡA通過促進谷胱甘肽二硫化物的分解,誘導谷胱甘肽的再生,參與線粒體凋亡途徑在過氧化氫(H2O2)誘導的人臍靜脈血管內皮細胞損傷中發揮保護作用,保護細胞免受H2O2引發的炎性介質的影響[17]。本研究結果顯示,Tan ⅡA可抑制軟骨細胞活力,抑制IL-1β誘導的軟骨細胞中NO和PGE2的產生,抑制iNOS、COX-2、MMPs的表達,表明Tan ⅡA可抑制IL-1β誘導的軟骨細胞炎癥及軟骨基質降解。軟骨細胞外基質主要由纖維蛋白組成,包括膠原蛋白、蛋白多糖和透明質酸。關節軟骨中90%的蛋白多糖是Aggrecan[18]。進一步研究結果顯示,Tan ⅡA也可逆轉IL-1β誘導的Ⅱ型膠原和Aggrecan的下調,表明Tan ⅡA可促進軟骨細胞外基質生成,在IL-1β誘導的軟骨細胞損傷中發揮保護作用。
ERK/NF-κB途徑激活可導致COX-2和白細胞介素-8水平升高,從而導致關節軟骨細胞的過度炎癥反應[19]。IL-1β可誘導軟骨細胞NF-κB通路的激活,大黃素可以抑制IL-1β誘導的NF-κB通路的激活,以改善OA軟骨降解[20]。已有研究表明,Tan ⅡA通過抑制NF-κB通路的激活,抑制成骨細胞中H2O2水平、活性氧積累和細胞凋亡,在骨質疏松小鼠成骨分化過程中發揮保護作用[21]。β-arrestin2是NF-κB通路的上游細胞因子,敲低β-arrestin2可誘導NF-κB通路的激活,β-arrestin2過表達則可抑制NF-κB通路的激活[22]。證據顯示,Tan ⅡA通過上調β-arrestin2的表達來抑制類風濕關節炎患者外周血單核細胞的炎癥反應[23]。本研究結果顯示,Tan ⅡA可促進IL-1β誘導的軟骨細胞中β-arrestin2的表達,抑制NF-κB通路的激活。為進一步證實Tan ⅡA在OA中的作用,我們建立了OA大鼠模型,體內實驗結果顯示,Tan ⅡA可明顯改善OA大鼠病情。
綜上,Tan ⅡA通過調節β-arrestin2表達抑制軟骨細胞炎癥及軟骨基質降解,明顯改善OA大鼠病情。該結果為明確Tan ⅡA在OA中的作用機制及研發新的OA治療藥物提供了新的科學資料。

