牛鼻支原體新疆南疆株分離鑒定
趙金玉,周 鵬,唐軍林,宋亞萍,劉慶國,武軍元*
(1.塔里木大學動物科學學院,新疆阿拉爾 843300;2.塔里木畜牧科技兵團重點實驗室,新疆阿拉爾 843300;3.新疆生產建設兵團塔里木動物疫病診斷與防控工程實驗室,新疆阿拉爾843300)
牛鼻支原體(Mycoplasma bovirhinis)屬于柔膜體綱、支原體目、支原體科、支原體屬,是導致牛呼吸系統疾病綜合征和乳腺炎的病原之一[1]。1965 年,Harbourne 等[2]從英格蘭患有乳房炎的奶牛上首次分離到該病原。牛鼻支原體是一種致病性較弱的繼發性感染原,通常可與其他病原體混合感染,在機體抵抗力減弱的情況下,發揮致病作用引起繼發性感染使宿主病情加重[3]。牛鼻支原體的分離來源并不唯一,通常在患有肺炎犢牛的鼻拭子、肺臟組織中有較高的分離率,在健康犢牛的鼻腔中分離率則較低。從病牛的腎臟、奶樣、耳道中也有分離出牛鼻支原體的相關報道[4-7]。目前,國內對牛鼻支原體的研究甚少,僅有對牛鼻支原體GS01 株全基因組序列分析的報道[8]。本研究使用支原體屬通用引物以及多種支原體特異引物對采集到的病牛鼻拭子和病死牛肺臟組織進行檢測,并使用支原體培養基進行分離培養,旨在確定臨床病例中支原體的感染分布,為牛養殖生產中支原體相關疾病的防控提供資料,為相關支原體的深入研究提供參考菌株。
1 材料與方法
1.1 病料
采集新疆南疆某規模化奶牛場發病犢牛鼻拭子30份,病死犢牛病變肺臟組織1份。發病犢牛出現咳嗽、氣喘、黏性鼻液等臨床癥狀;病死犢牛剖檢見:肺臟實變、大小不一的結節狀病灶。
1.2 試劑和儀器
支原體培養基PPLO Broth、PPLO Agar 均購自BD 公司;馬血清購自HyClone 公司;2×PCR Mix、基因組DNA提取試劑盒、pGM-simple-T fast 載體、瓊脂糖凝膠回收試劑盒、質粒小提試劑盒均購自天根生化科技(北京)有限公司;PCR擴增反應儀購自BIO-RAD公司;超凈工作臺購自上海博訊實業有限公司;電泳儀購自北京六一生物科技有限公司。
1.3 樣本處理
鼻拭子樣本:使用無菌鑷子將鼻拭子中的棉簽擠干。肺臟使用無菌外科剪從肺臟病健交界處剪開一小口,從深部取黃豆樣大小組織塊于1.5 mL離心管中加1 mL生理鹽水充分研磨。
1.4 病原分離
將處理過的鼻拭子和肺組織研磨液1 500 r/min 離心3 min,取500 μL 上清液至含有酚紅指示劑的支原體液體培養基中,放入37 ℃恒溫培養箱中培養,待培養基顏色變黃后,使用0.45 μm濾膜過濾傳入新的液體培養基,待液體培養基顏色變黃且澄清后,取200 μL培養液接入支原體固體培養基,37 ℃、5%CO2培養箱中培養48~72 h,使用光學顯微鏡鏡檢,挑取“煎蛋狀”單菌落進行純培養,經3次純化后保菌。
1.5 PCR鑒定
支原體屬16S rRNA通用引物、牛支原體特異引物、牛鼻支原體特異引物、殊異支原體特異引物均由生工生物工程(上海)股份有限公司合成,引物信息見表1。

表1 引物信息Tab.1 Primers information
1.5.1 DNA提取
取鼻拭子菌液、純培養液,使用細菌基因組提取試劑盒提取基因組DNA,取肺臟組織研磨沉淀,使用組織基因組提取試劑盒提取基因組DNA。
1.5.2 PCR擴增
使用表1 中的引物分別擴增對應的目的基因片段。PCR 反應體系25 μL:2×PCR mix12.5 μL、ddH2O 8.5 μL、上下游引物各1 μL、DNA 模板2 μL。支原體通用引物反應條件:95 ℃預變性5 min,95 ℃變性30 s,58 ℃退火30 s,72 ℃延伸1 min,35個循環;72 ℃終延伸5 min。牛支原體特異引物反應條件:94 ℃預變性5 min,94 ℃變性30 s,52 ℃退火30 s,72 ℃延伸1 min,35 個循環;72 ℃終延伸5 min。牛鼻支原體特異引物反應條件:94 ℃預變性5 min,94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸1 min,35個循環;72 ℃終延伸5 min。殊異支原體特異引物反應條件:94 ℃預變性5 min,94 ℃變性1 min,53.6 ℃退火1 min,72 ℃延伸1 min,35個循環;72 ℃終延伸5 min。
1.5.3 克隆和測序
使用瓊脂糖凝膠回收試劑盒回收PCR陽性產物,經連接、轉化后提取質粒送往生工生物工程(上海)股份有限公司進行測序。
1.5.4 序列分析
登陸NCBI網站對測序完成的序列進行BLAST比對,并下載相似度較高的序列使用DNA star 軟件進行同源性比較分析,使用MEGA 6.0軟件構建遺傳進化樹。
2 結果與分析
2.1 病原分離純化結果(見圖1)

圖1 分離株菌落形態(40×)Fig.1 Colony morphology of isolates(40×)
由圖1可知,將處理過的病料接種于液體培養基,培養48~72 h后,取顏色變黃的培養液使用0.45 μm濾膜傳代培養,直至液體培養基顏色變黃且不渾濁,然后取200 μL培養液接種至固體培養基上,培養3 d 后在光學顯微鏡下鏡檢可觀察到“煎蛋狀”菌落。
2.2 分離株支原體屬引物PCR擴增結果(見圖2、圖3)
由圖2、圖3 可知,提取分離純化后菌落基因組DNA,以支原體屬通用引物和牛鼻支原體特異引物分別擴增出1 021 bp 和315 bp 的目的片段,與預期片段大小相符。以牛支原體、殊異支原體特異引物擴增未能擴增出任何條帶。
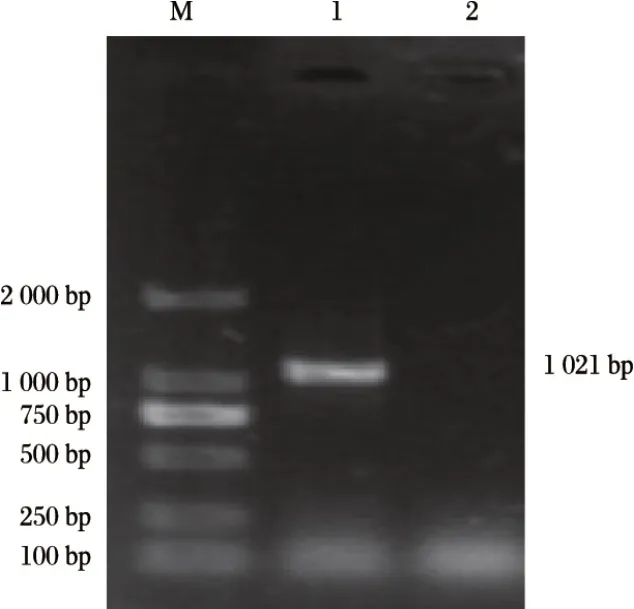
圖2 分離株支原體屬引物PCR擴增結果Fig.2 PCR amplification results of Mycoplasma isolates with universal primers
2.3 序列分析
2.3.1 分離株同源性分析(見圖4)
將分離株的16S rRNA基因序列與GenBank已公布的7株支原體16S rRNA基因序列進行同源性對比。由圖4可知,分離株與牛鼻支原體甘肅株GS01(NZCP024049.1)的同源性為98.2%,與牛鼻支原體日本株HAZ141-2(NZAP018135.1)的同源性為97.9%;與牛支原體PG45 株(NZCP007589.1)、HB0801-P115 株(NC014760.1)的同源性分別為85.5%和85.8%;與犬支原體PG14 株(NR028813.1)、LV 株(NZCP011368.1)的同源性分別為94.9%和95.2%;與殊異支原體ATCC 27140株(NZCP007229.1)的同源性為80.6%。
2.3.2 分離株系統進化樹分析(見圖5)

圖3 分離株牛鼻支原體特異引物PCR擴增結果Fig.3 PCR amplification results of Mycoplasma bovirhinis isolates with specific primers
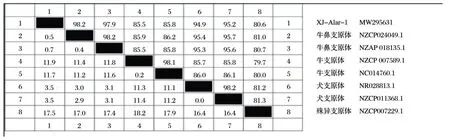
圖4 基于16S rRNA核苷酸序列的同源性比較Fig.4 Homology comparison based on 16S rRNA nucleotide sequence
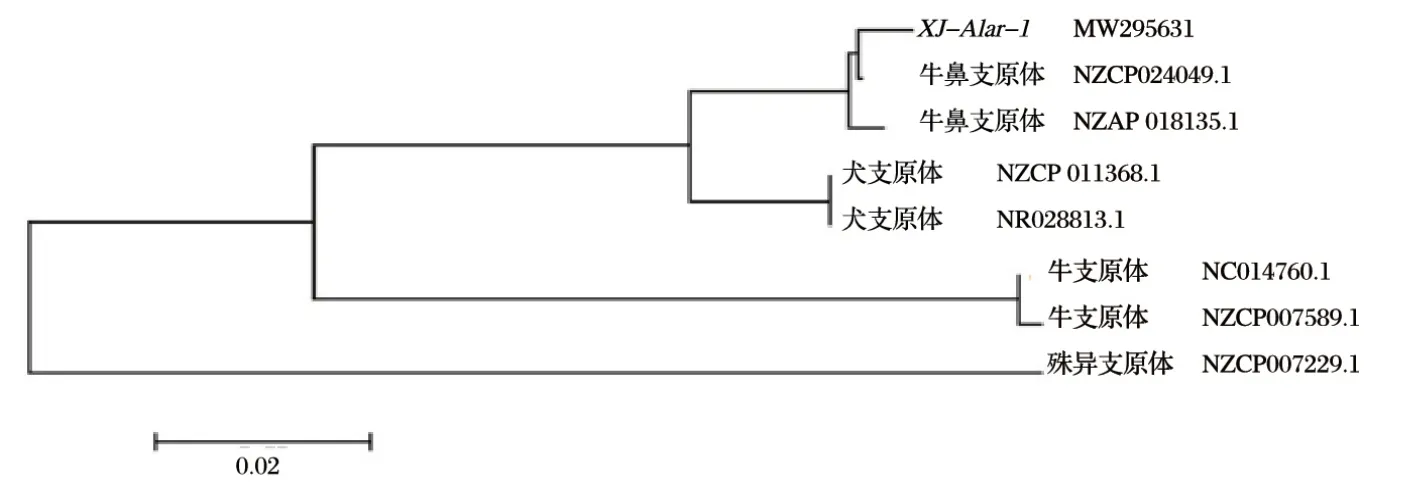
圖5 基于支原體16S rRNA核苷酸序列構建的系統遺傳進化樹Fig.5 Phylogenetic tree based on Mycoplasma 16S rRNA nucleotide sequence
由圖5 可知,本研究分離株與牛鼻支原體GS01 株(NZCP024049.1)、牛鼻支原體HAZ141-2 株(NZAP018135.1)在同一分支,親緣關系最近,與犬支原體PG14株(NR028813.1)、LV株(NZCP011368.1)親緣關系較近,與牛支原體PG45 株(NZCP007589.1)、HB0801-P115株(NC014760.1)的親緣關系較遠,與殊異支原體ATCC27140株(NZCP007229.1)親緣關系最遠。
3 討論
1981年,Friis[9]對牛鼻支原體的致病性進行研究,嘗試通過人工感染牛鼻支原體導致犢牛肺炎,但并未成功。2017年,Hata等[10]首次公布牛鼻支原體日本株的全基因組序列。2018年,我國學者完成牛鼻支原體甘肅株的全基因組測序,并對其遺傳進化關系和假定的毒力因子進行分析,發現與牛支原體相比,牛鼻支原體甘肅株GS01缺少多個毒力基因,由此推測相關毒力基因的缺失造成其致病性低于牛支原體[8]。2020年,Catania等[11]對意大利新進口的公牛進行支原體感染情況的監測,發現牛鼻支原體的感染率與季節有一定關系,夏季的感染率高于冬季,但環境因素的改變對牛支原體的感染率無顯著的影響。本研究中,犢牛發病集中在8月份,可能與季節轉換造成的應激相關。
支原體屬的16S rRNA核苷酸序列具有較高的種間差異性和種內保守性,可用于支原體的菌種鑒定[12]。對牛呼吸系統具有較強致病性作用的支原體有牛支原體、殊異支原體等。本研究對發病犢牛的鼻拭子和病死牛的肺臟組織進行支原體檢測、分離,結果顯示病牛牛鼻支原體鼻拭子陽性率為70%,并成功從病死牛肺臟組織中分離到1 株牛鼻支原體,未檢測分離到其他支原體。同源性分析顯示,分離株的16S rRNA 核苷酸序列與牛鼻支原體甘肅株GS01 和牛鼻支原體日本株HAZ141-2 的同源性分別為98.4%和98.2%。16S rRNA核苷酸序列構建的遺傳進化樹顯示分離株與牛鼻支原體甘肅株GS01和牛鼻支原體日本株HAZ141-2的遺傳關系最近,從分子水平上證實該分離株為牛鼻支原體。本研究未對除支原體以外的其他病原進行檢測,所以不能斷定該病原造成采樣牛場犢牛的發病及死亡。盡管牛鼻支原體的致病性與牛支原體相比較弱,但對該病原進行流行病學監測,病原分離仍有重要意義。
4 結論
本研從新疆南疆某規模化牛場病死牛肺臟組織中分離到1株支原體,確定為牛鼻支原體,病牛鼻拭子牛鼻支原體檢測陽性率為70%。本研究可為新疆地區牛場牛鼻支原體的感染情況提供參考。

