先天性巨結腸根治術后非計劃再入院原因分析
王大佳 張志波 白玉作
先天性巨結腸(Hirschsprung"s disease,HSCR)是引起嬰兒消化道梗阻的常見原因之一,主要病理改變是狹窄段肌間神經叢和黏膜下神經叢內神經節細胞缺如[1]。 巨結腸的外科治療一直堅持Swenson 手術原則,切除痙攣狹窄的病變腸管,拖出神經正常腸管與肛管吻合,從而解除癥狀[2]。 1998 年Torre 等[3]報道了經肛門直腸內拖出術(transanal endorectal pull-through,TEPT) 治療HSCR,使HSCR手術快速、簡單、有效。 近期調查結果發現,常見型HSCR 行Soave 手術最多,采用短段肌鞘、后壁V 形切除[4-6]。 經過不斷發展,HSCR 外科治療住院時間縮短,術后排便控制更好,但是仍有許多患者術后出現便秘和巨結腸相關小腸結腸炎(Hirschsprung-associated enterocolitis,HAEC)等并發癥[7,8]。目前有關巨結腸術后再入院原因分析及處理的文獻數量相對較少,本文對中國醫科大學附屬盛京醫院新生兒外科近十年收治的先天性巨結腸患者手術后再次入院資料進行整理,對再入院的原因進行分析總結。
材料與方法
一、臨床資料
回顧性分析中國醫科大學附屬盛京醫院新生兒外科2011 年10 月至2020 年9 月接受手術治療的1 至6 月齡HSCR 患者臨床資料。 患者均在本院實施手術,術后再次入本院診治。 共納入資料完整的HSCR 患者326 例,對其中再入院患者的臨床資料、病理分型、手術方式、再入院原因、再入院時間等進行統計分析。 HSCR 診斷標準:有胎便排出延遲史;有便秘、腹脹、嘔吐等典型病史;肛診裹手感陽性,拔指則肛門排氣排便;鋇灌腸見狹窄段、移行段和擴張段腸改變;肛門直腸測壓無內括約肌松弛反射;術中病理檢查證實為巨結腸病變。 手術方式:病變位于直腸和乙狀結腸的常見型HSCR 行經肛門結腸拖出術;部分病變腸管較長的常見型HSCR、長段型和全結腸型HSCR 行腹腔鏡輔助經肛門結腸拖出術。 出院標準:一般情況良好;便秘、腹脹等癥狀消失;切口愈合良好,無出血、感染;無其他需住院處理的并發癥。 術后2 周開始擴肛訓練,根據具體情況訓練3 ~6 個月后停止擴肛,以后每年復查1 次。 再次入院指征:出現需要靜脈補液治療的HSCR 相關術后并發癥。 HAEC 為Ⅱ級以上,一般采取禁食水、靜脈補液、洗腸、甲硝唑保留灌腸、廣譜抗生素治療[8]。 腸梗阻通常采取保守治療,必要時手術治療。 電解質紊亂一般根據血氣分析結果糾正水電解質紊亂和酸堿平衡,對癥治療。 病例排除標準: ①出生未滿28 天即接受手術; ②手術時月齡超過6 個月; ③隨訪過程中死亡; ④于外院接受手術。
二、統計學處理
應用SAS 9.3 進行統計學分析。 采用χ2檢驗對326 例患者中再次入院相關因素進行比較分析。服從正態分布的計量資料變量采用(±s)表示,分類變量用數字和百分比表示。 P <0.05 為差異具有統計學意義。
結 果
先天性巨結腸根治術后再入院患者詳細臨床資料見表1。

表1 先天性巨結腸根治術后再入院患者臨床資料Table 1 Clinical data of readmitted infants after pull-through for Hirschsprung disease
本研究326 例中,51 例出院后非計劃再次入院,再入院率15.64%,再入院64 次,其中10 例多次入院。 再入院患者體質量(5.75 ±1.54)kg,月齡(2.45 ±1.24)個月。 出院后再入院時間:1 個月內再入院28 例(54.9%);1 個月至1 年12 例(23.5%),1 ~3 年11 例(21.57%)。 再入院主要原因:HAEC 56 例次(87. 5%),腸梗阻6 例次(9.4%),電解質紊亂2 例次(3.1%),見圖1。 具體統計分析結果見表2。
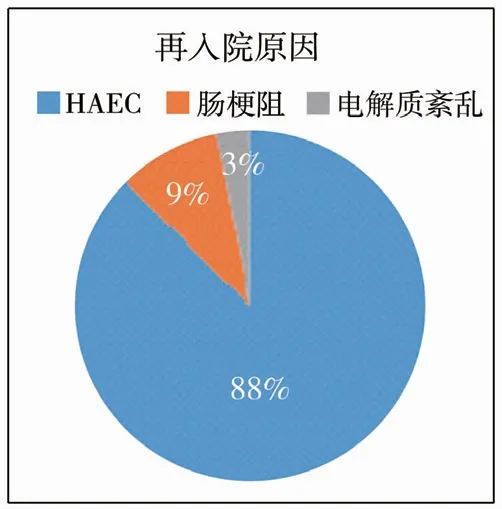
圖1 先天性巨結腸根治術后患者再入院原因構成比Fig.1 The composition ratio of reasons for re-admission of patients with Hirschsprung"s disease after radical resection
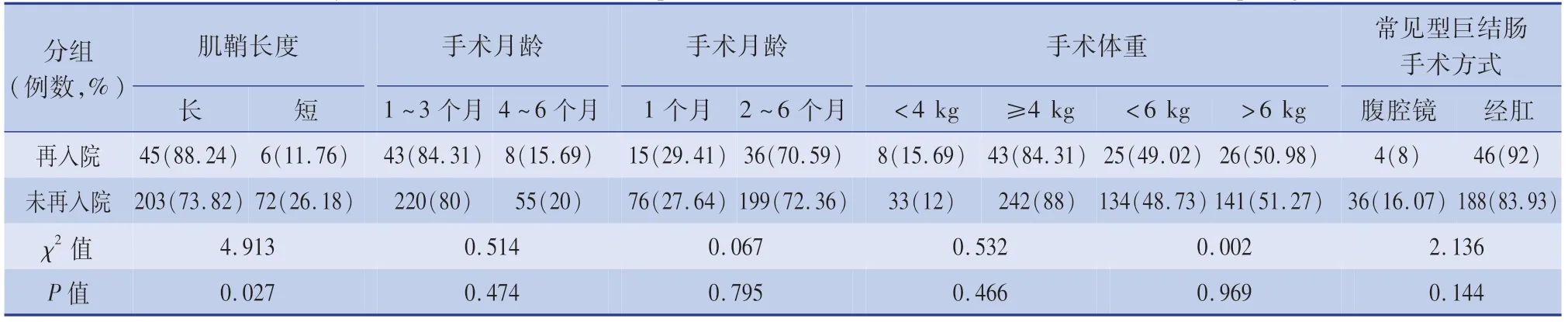
表2 先天性巨結腸根治術后再入院相關因素分析Table 2 Analysis of factors related to hospital readmission after radical resection of Hirschsprung"s disease
2017 年以前248 例保留肌鞘較長(大于3 cm),其中再入院45 例(18.1%);2018—2020 年保留肌鞘較短(小于2. 5 cm),手術78 例,再入院6 例(7.7%),差異有統計學意義(χ2=4. 913,P =0.027)。 根據手術月齡,按1 ~3 個月和4 ~6 個月分組(χ2=0.514,P =0.474),1 個月與2 ~6 個月分組(χ2=0.067,P =0.795),差異均無統計學意義。根據手術時體重分組,按是否超過4 kg 分組(χ2=0.532,P =0.466),是否超過6 kg 分組(χ2=0.002,P =0.969),差異均無統計學意義。 常見型巨結腸根據是否應用腹腔鏡手術分組(χ2=2. 136,P =0.144),差異無統計學意義。
再次入院患者中有2 例(0.6%)行手術治療,1例為根治術前因新生兒期結腸穿孔行結腸造瘺術,巨結腸根治術后3 個月因腸梗阻行腸粘連松解術。另1 例為術后3 年巨結腸復發行腹腔鏡下結腸次全切除及結腸翻轉術,此患者根治術時病變段位于乙狀結腸近端,腹腔鏡輔助游離腸系膜,術中吻合口處可見神經節細胞,術后曾因小腸結腸炎再入院3次,患者3 歲半時便秘復發,復查鋇灌腸可見痙攣段、移行段和擴張段改變,遂行手術治療。
討 論
本研究中再次入院HAEC 56 例(87.5%)、腸梗阻6 例(9.4%),HAEC 和腸梗阻是再入院的主要原因。 2020 年Quiroz[9]統計了美國HSCR 術后近期最常見的再入院原因,包括:胃腸道相關因素(51%),感染性疾病(42%),手術操作相關并發癥(13%)。因胃腸道相關因素再入院的患者中,HAEC 占35%,電解質紊亂占28%,胃腸功能紊亂占13%,這提示HAEC 是HSCR 術后近期再入院的重要原因,需引起高度重視。 本研究按照年齡和體重進行了分組分析,雖然月齡和體重越低,再次入院的比例越高,但差異無統計學意義,這可能需要擴大樣本量進行進一步研究。
一、再入院時間
本研究中術后1 個月內再入院病例占54.9%,因此認為需要再入院治療的術后并發癥可能大多出現在術后早期。 HAEC 的發生率相對較高,必須重視預防策略。 一般術后2 周開始擴肛,在未開始擴肛時,如出現肛門排氣排便減少、腹脹等情況需及時就診,并做好家長的宣教工作。 本組無一例3歲后因HAEC 再入院病例,與文獻報道一致,這可能是因為腸神經節在出生后3 ~4 年逐漸發育成熟,對于HSCR 的并發癥HAEC,年齡的增加似乎可以降低其發生率[10]。 基于以上分析,嬰兒巨結腸根治術后近期增加隨訪頻率可能會減少術后早期再入院的發生。
二、病理分型
常見型巨結腸患者再入院率高于長段型和全結腸型患者。 一些較嚴重的長段型和全結腸型HSCR 患者選擇在6 個月以后手術,未納入本組病例中。 排除以上情況,分析原因可能是長段型和全結腸型患者家長更加重視患者的病情變化,及時就醫。 部分長段型和全結腸型HSCR 患者有術前HAEC 病史,所以術后一旦出現腹脹、發熱和腹瀉的典型癥狀,以及嘔吐、糞便中帶血并出現特殊的臭味、稀便、頑固性便秘和嗜睡、狀態欠佳等表現,往往會選擇及時就診,避免病情加重入院。 教會家長擴肛、洗腸、甲硝唑保留灌腸、口服補液鹽等治療方法,一般長段型巨結腸和全結腸型巨結腸患者家長多在行根治術前就已掌握這些方法。 這可能是本組患者中,長段型巨結腸和全結腸型巨結腸患者再入院率反而比常見型巨結腸患者更低的原因[11]。
三、腹腔鏡手術
326 例中,腹腔鏡手術92 例,再入院8 例,與非腹腔鏡手術組比較差異有統計學意義。 但是按照病理類型分組來看,因為52 例長段型巨結腸和全結腸型巨結腸患者全部應用腹腔鏡手術,考慮與病理類型相關。 在常見型巨結腸中應用腹腔鏡40 例,再入院4 例(10%),與經肛手術的常見型巨結腸再入院率(19.7%)比較,雖然采用腹腔鏡手術的病例再入院比例較低,但差異無統計學意義。 回顧性研究發現經肛門手術后近期肛門靜息壓低,長期隨訪排便評分與腸功能評分低于腹腔鏡組,隨著時間的延長,約75%的患者排便控制功能可逐漸改善,生活質量接近正常對照組[12]。 直腸內鏡超聲發現超過半數患者存在肛門括約肌損傷,提示術中暴力牽拉可能是導致手術損傷的原因[13]。 目前對于常見型HSCR 仍缺乏經肛門與腹腔鏡輔助的前瞻性多中心隨機對照研究。
四、肌鞘保留
HSCR 手術后效果與根治術中內括約肌處理以及近端腸管腸神經功能直接相關。 傳統Soave 術會遺留一段無神經節細胞的直腸肌鞘,被認為與術后便秘及小腸結腸炎有關,目前對HSCR 內括約肌的認識仍然有限,肌鞘保留長短仍有爭議。 2018 年國內調查統計,約2/3 的醫生保留肌鞘長度小于3 cm[4]。 2019 年澳大利亞新西蘭和2020 年北美學者報道,常見型巨結腸均采用保留短肌鞘作為主流手術方式,術后并發癥及排便功能均優于保留長肌鞘病例[5,6]。 本組中2017 年以前的手術保留肌鞘略長,根據患者具體情況一般保留3 cm,背側“V”形切除1/3,再入院率為18.1%;2018 年以后的手術保留短肌鞘,長度小于2.5 cm,背側“V”形切除約五分之二,再入院率為7.7%,差異有統計學意義。 雖然保留短肌鞘后有患者需要口服止瀉劑1 ~3 個月,但是沒有出現因腹瀉、脫水、電解質紊亂等而再次住院的病例。 目前比較公認的觀點是,巨結腸根治術是一種姑息手術,或多或少會殘留無神經節細胞腸管,因此保留肌鞘越短越好[14]。 保留長肌鞘的觀點認為,長肌鞘對防止遠期污糞、便失禁有益,短肌鞘者術后這類并發癥是否升高還有待于大樣本多中心研究驗證。 肛門內括約肌不松弛可能是術后梗阻、復發以及HAEC 的原因[15]。 術中切除部分括約肌理論上有必要,但應慎重選擇,目前迫切需要研究HSCR 患者內括約肌病理生理及其在控制排便中的作用。
五、再手術
本組有2 例再次行手術治療,占0.6%,其中1例在根治術前因新生兒期結腸穿孔行結腸造瘺術,巨結腸根治術后3 個月因束帶粘連行腸粘連松解術。 對于巨結腸術前有腸穿孔病史的患者需要重點隨訪。 另1 例再手術患者為術后3 年巨結腸復發行腹腔鏡下結腸次全切除、結腸翻轉術。 分析原因,可能與目前術中冰凍病理檢查僅能提供近端腸管有無腸神經節細胞,病理診斷神經節細胞數量及功能尚欠缺,且不能說明神經節細胞成熟度和不能準確預示腸功能有關。 術中正確確定內括約肌和近端腸管的切除范圍仍然是HSCR 根治術的難點和重點[16]。 考慮到內括約肌和近端腸管腸神經系統在出生后存在繼續發育成熟的過程,術后便秘和HAEC 的處理有助于控制便失禁[17]。 因此,完全切除病變組織、最大限度保護括約肌功能和維持正常排便之間需達到最佳平衡。 對于術后反復出現HAEC 和腸梗阻的患者,要進行詳細的體格檢查,仔細評估吻合口瘢痕狹窄程度、肛門括約肌功能以及是否能夠觸及Soave 肌鞘。 完善鋇灌腸檢查,仔細識別可引起梗阻的任何機械性原因。 調取根治術的手術記錄和再次復查根治手術時的病理切片至關重要,可行直腸活檢,排除脫出物是否為移行段腸管。 如果存在引起梗阻和HAEC 復發的解剖因素,應行手術治療。
本研究局限性在于:HSCR 術后HAEC 的診斷主要依靠臨床癥狀和體征,而這些癥狀和體征往往是非特異性的,并且再入院的入院標準存在較大差異,這可能導致患者出現過度治療或者治療不足,也導致收集資料和統計分析的困難。 本研究中近幾年收治的先天性巨結腸患者隨訪時間較短,需要延長隨訪時間。 關于巨結腸術后的效果評價,本組病例只是提供了一個再住院評價的新視角,全面的效果評價尚需前瞻性多中心的隨機對照研究。

