嬰幼兒奶粉中阪崎腸桿菌增菌培養對PCR快速檢測的影響
張清平,張懿翔,劉洋
(上海市質量監督檢驗技術研究院國家食品質量監督檢驗中心(上海),上海 200233)
0 引言
阪崎腸桿菌(Enterobacter sakazakii)是一種自然界中普遍存在的微生物,它能夠從多種介質和環境中分離得到,包括食品、奶粉原料、廢水、食品生產線以及家庭和醫院等,奶粉和其生產加工環境是該菌傳播的主要媒介[1-4]。該菌是一種食源性條件致病菌,主要引起嬰幼兒,尤其是早產兒發生腦膜炎、敗血癥和壞死性結腸炎的感染,死亡率高達50%~80%[5-7],近些年來爆發了多起阪崎腸桿菌的重大感染事件[8-10]。2006年,針對嬰幼兒配方奶粉受阪崎腸桿菌污染的高風險和污染后的巨大危害,原國家質檢總局頒布了嬰幼兒配方奶粉中阪崎腸桿菌每批必檢的市場準入要求。
GB4789.40-2016作為阪崎腸桿菌檢測的金標準,一直被廣泛采用,但該方法檢測周期長,滿足不了阪崎腸桿菌快速篩選的需求,因此,多年來針對阪崎腸桿菌的快速檢測技術也一直在不斷發展,其中以DNA為基礎的PCR檢測技術發展最為迅速[11-15]。而這些快速檢測方法的一個共同特征即是需要從待測樣本中獲取阪崎腸桿菌的基因組DNA。由于從待測樣本中提取阪崎腸桿菌DNA,需要一定數量的目標菌,所以目前已發布的阪崎腸桿菌檢測方法標準中,其首要步驟就是對待檢樣本進行增菌培養[16-17]。
據調查,實際流通食品中致病菌的含量通常較低,多數奶粉中阪崎腸桿菌的污染水平小于1 CFU/100 g[18],目前與阪崎腸桿菌相關的快速測方法都達不到如此低的檢出限。已報道的基于DNA檢測的阪崎腸桿菌快檢方法的檢出限達到103CFU/mL(g)[19-20],因此,采用傳統的增菌培養方法對目標菌進行增殖,使其快速達到一定的數量是目前各快速檢測方法必不可少的關鍵步驟。據報道,阪崎腸桿菌的最適生長溫度為35~40℃,在36℃的培養條件下,該菌的生長延滯期較短[21]。目前國家標準中阪崎腸桿菌的前增菌時間為18±2 h,為了摸索出適合熒光PCR快速檢測方法的阪崎腸桿菌最佳前增菌時間,本研究對嬰幼兒奶粉中阪崎腸桿菌的前增菌培養條件及影響因素進行全面研究,以期建立穩定的阪崎腸桿菌快速檢測技術。
1 材料與方法
1.1 材料與試劑
實驗菌株:阪崎腸桿菌ATCC25944;干擾菌株:大腸桿菌ATCC8099,沙門氏菌ATCC 13311,金黃色葡萄球菌ATCC6538,陰溝腸桿菌ATCC 35030。選用的3種嬰幼兒奶粉均購自市場,采用GB4789.40的檢測方法進行檢測,均未檢出阪崎腸桿菌。
培養基及試劑:緩沖蛋白胨水(BPW)、營養肉湯,營養瓊脂、平板計數瓊脂及阪崎腸桿菌顯色培養基均購自北京陸橋技術有限公司;細菌DNA提取試劑盒DP302-02來自天根生化科技(北京)有限公司;Premix Ex TaqTM (Probe qPCR)(Cat#RR 390A)購自大連寶生物公司;熒光PCR引物及探針由上海生工合成:上游引物5’-GGCGAGCGGCGAATATTAT-3’;下游引物5’-CGGGTTTTCCCAGTTGAGATC-3’;探針5’-CACCAGTTTTCGGTGCGCCAGC-3’。
1.2 儀器與設備
生化培養箱(Shellab,G16-2),美國Shellab公司;生物安全柜(labconcoB2),美國Lanconco;麥氏比濁儀,法國梅里埃;臺式高速冷凍離心機(Eppendorf,5430R),德國Eppendorf公司;超微量紫外可見分光光度計(DeNovix DS-11),美國DeNovix公司;熒光定量CR儀(ABI 7500 Fast),賽默飛世爾科技(中國)有限公司;Vortex Genie2漩渦振蕩器,德國Heidolph公司;移液器(2,10,100,1 000μL)(Eppendorf Research Plus),德國Eppendorf公司。
1.3 實驗方法
1.3.1 阪崎腸桿菌平板計數
阪崎腸桿菌的計數采用兩種平板計數法(傾注培養法和阪崎腸桿菌顯色培養基涂布法),傾注培養法按GB4789.2的操作進行,阪崎腸桿菌顯色培養基涂布法參照GB4789.2的要求進行梯度稀釋后,取0.2 mL涂布兩塊阪崎腸桿菌顯色培養基,倒置于36±1℃培養24±2 h后進行計數。
1.3.2 實驗菌株菌懸液的制備
阪崎腸桿菌標準菌株及干擾菌株經營養肉湯復活后轉接營養瓊脂斜面,36±1℃培養24±2 h,用生理鹽水將營養瓊脂斜面上的菌苔洗下,制成菌懸液,用比濁儀測定各菌懸液的麥氏濃度,并按GB4789.2和阪崎腸桿菌顯色培養基涂布法進行回收計數,實驗證明平板計數法所回收的菌落數與比濁儀參考表推算出的初始菌液濃度基本吻合,如表1所示。在人工染菌實驗時,奶粉樣品中的人工加菌量將按照比濁儀測得的比值進行估算。
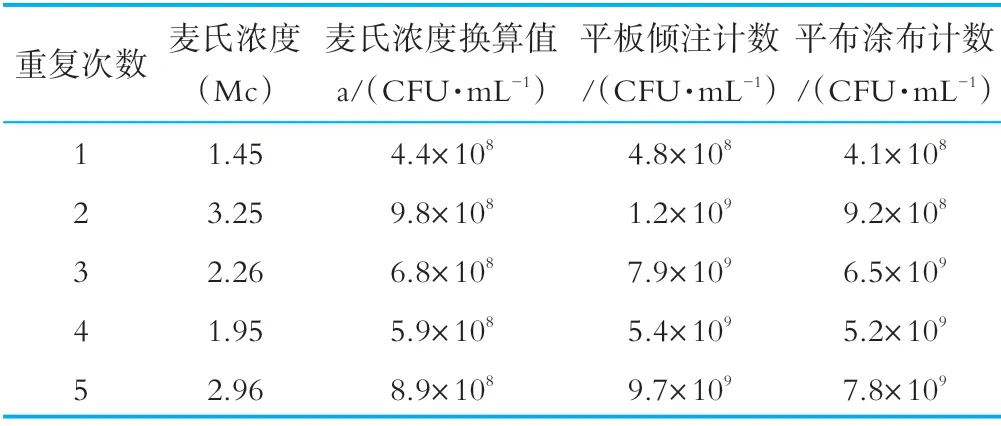
表1 菌液濃度計算預實驗
1.3.3 不同初始菌量下阪崎腸桿菌的生長實驗
稱取100 g奶粉加入到900 mL的BPW增菌液中,充分均勻后,分別加入菌液濃度為103、102、101CFU/mL及1~9 CFU/mL菌液各1 m L,每種加菌量重復3次。人工染菌后的BPW增菌液經充分混勻后置36±1℃培養。
1.3.4 奶粉基質對阪崎腸桿菌的生長實驗
分別以3種不同品牌奶粉做基質,稱取100 g奶粉加入到900 mL的BPW中,每種奶粉重復3次,同時以不添加奶粉樣品的900 mL BPW增菌液做背景基質對照。然后將制備好的阪崎腸桿菌菌懸液稀釋,選取1~9 CFU/mL濃度的菌液,取1 mL添加到已制備好的BPW增菌液中,充分混勻后,置36±1℃培養。
1.3.5 不同干擾菌背景下阪崎腸桿菌的生長實驗
在含有奶粉基質的900 mLBPW增菌液中,按照表2的實驗設置人工添加阪崎腸桿菌、大腸桿菌、沙門氏菌、金黃色葡萄球菌及陰溝腸桿菌的菌懸液(濃度約為1~9 CFU/m L),每個試驗設置進行3次重復,充分混勻后置36±1℃培養。

表2 不同干擾菌背景下阪崎腸桿菌的生長實驗設置
1.3.6 阪崎腸桿菌的熒光PCR檢測方法
分別取1.3.4及1.3.5兩步前增菌培養后的BPW增菌液2 m L,3 000 rpm離心10 min后棄去上層的奶粉脂肪層,然后13 000 rpm離心10 min,棄去上清液,保留底部沉淀,采用細菌DNA提取試劑盒抽提基因組DNA,將提取后的樣品DNA測定其濃度和質量,然后采用熒光PCR方法進行檢測。
2 結果與分析
2.1 不同初始菌量條件下阪崎腸桿菌的生長情況
含有奶粉基質的BPW增菌液的4種不同的起始菌量分別約為103、102、101及1~9 CFU/1 000 m L,經過4、6、8、10、12、14、16 h增菌培養后,計數結果見圖1,可以發現,初始菌量不同,阪崎腸桿菌生長的延滯期長短不同,隨著初始菌量逐漸減少,阪崎腸桿菌生長的延滯期變長。初始菌量在1~9 CFU/1 000 m L數量級時,培養4 h時阪崎腸桿菌計數<1 CFU/mL,增菌培養10 h時,阪崎腸桿菌的數量才能達到103CFU/mL。樣品中初始菌含量是影響阪崎腸桿菌快速增殖到一定數量的關鍵因素。目前我國市場上嬰幼兒配方奶粉的整體衛生狀況較好,即便有阪崎腸桿菌的污染,其污染量極低,因此,采用阪崎腸桿菌快速檢測方法所需要的增菌培養時間至少在10 h以上。

圖1 不同初始菌量下阪崎腸桿菌生長變化
2.2 奶粉基質對阪崎腸桿菌的生長影響
含有奶粉基質的BPW增菌液與未含有奶粉基質的BPW增菌液,在預設的增菌時間培養后,取增菌液采用熒光PCR法檢測阪崎腸桿菌,不含奶粉基質的BPW增菌液與含有奶粉基質的BPW增菌液所獲取的擴增Ct值均存在顯著性差異。增菌培養8 h時,熒光PCR擴增的Ct值大于40,未檢出阪崎腸桿菌;增菌培養10 h時,熒光PCR擴增的Ct值小于35,能夠有效地檢出阪崎腸桿菌。此外,隨著增菌時間的延長,熒光PCR擴增的Ct值逐漸減小,如圖2所示。值得注意的是,未添加奶粉基質的BPW增菌液與添加3種不同品牌奶粉基質的BPW增菌液的生長增殖有明顯的差異,相同初始菌量在增菌時間相同的情況下,未添加奶粉基質的BPW增菌液中目標菌的生長明顯多于添加奶粉基質的,如圖3所示。這可能是奶粉中含有一定量的雜菌,在培養的過程中由奶粉帶入的非目標菌一定程度上抑制了阪崎腸桿菌的生長,使阪崎腸桿菌的生長速度減緩,當阪崎腸桿菌增殖到一定數量后,抑制效果不明顯。

圖2 不同基質對阪崎腸桿菌熒光PCR檢測的影響

圖3 不同基質對阪崎腸桿菌增殖數量的影響
2.3 不同干擾菌條件下阪崎腸桿菌的生長情況
以奶粉為基質的BPW增菌液中添加相同數量級的目標菌和干擾菌,在經過不同時間的增菌培養后,增菌液中目標菌的增殖數量及熒光PCR檢測所獲取的Ct均存在顯著差異,如圖4所示,通過比較發現,奶粉中大腸桿菌、沙門氏菌和金黃色葡萄球菌的存在數量與阪崎腸桿菌的數量在同一數量級別時,這3種食品中常見的致病菌對阪崎腸桿菌基本沒有抑制作用。但以奶粉為基質的BPW增菌液中添加相同數量級的阪崎腸桿菌和陰溝腸桿菌時,阪崎腸桿菌的生長增殖將受到一定程度的抑制,增菌液中目標菌的增殖數量明顯減少,增菌培養12 h后熒光PCR檢測的Ct值才小于35,采用快速檢測方法能夠有效檢出阪崎腸桿菌的培養時間被延長。

圖4不同干擾菌對阪崎腸桿菌增殖生長的影響
3 結論
目前嬰幼兒乳粉中阪崎克羅諾桿菌的快速檢測均需要增菌培養,按照國家標準GB4789.40的增菌培養條件,通常需要1~2 d的培養時間,考慮到PCR檢測方法靈敏度較高,摸索出能夠達到快速檢測所需的最短增菌培養時間將可以更快獲得檢測結果。阪崎腸桿菌的生長模型預測和實時監測均顯示阪崎腸桿菌的生長延滯期較短[22-25],培養8 h即進入穩定生長期,本研究模擬奶粉中阪崎腸桿菌污染水平較低的現狀,將初始加菌量控制在1~9 CFU/1 000 mL的極低濃度,增菌培養后發現阪崎腸桿菌的生長延滯期延長,初始菌量是影響阪崎腸桿菌快速到達一定數量的關鍵因素。采用熒光PCR方法對人工染菌后的增菌液進行檢測,最快增菌培養10 h即可檢出阪崎腸桿菌。然后綜合考慮不同嬰幼兒奶粉基質的差異及可能含有的常見干擾菌的影響,采用快速檢測方法對嬰幼兒奶粉進行阪崎腸桿菌檢測時,增菌培養12 h才不會出現假陰性結果。
因此,對于目前市場上銷售的嬰幼兒奶粉,采用傳統增菌培養方法,增菌培養10~12 h后,奶粉中污染的阪崎腸桿菌數量即可達到PCR檢測方法的檢出限,滿足PCR快速檢測的需求,此培養時間比傳統的培養時間節省了約30 h。本研究結果也可用于奶粉生產企業的日常監控,一定程度上可節省檢測時間,還可有效減低生產成本,為社會帶來一定的經濟效益。

