酞菁鋅衍生物摻雜人血白蛋白的分子模擬研究
江蘇衛生健康職業學院 江蘇 南京 211800
酞菁鋅衍生物(Znic phthalocyanine derivatives,ZnPc)具有高熒光量子產率、高單線態氧生成率、高效細胞吞噬以及體外高效抗癌活性[1-3]。因此,ZnPc被作為光敏劑廣泛應用于光動力學治療(光療,PDT),并在光療方面具有很大潛力。光療時,ZnPc通過靜脈注射進入體內,通過血漿蛋白運輸后被體內的正常細胞和腫瘤細胞吸收。因此,ZnPc進入體內后與血漿中生物大分子的相互作用對其在體內的吸收、分布和代謝有著極其重要的影響。人血漿中約有100種不同的蛋白質,但與其他蛋白質組分相比,僅13種蛋白質含量>1g/L,其中,僅人血白蛋白(HSA,35-40 mg/mL),α-1酸性糖蛋白(α-1 acid glycoprotein),低密度脂蛋白(VLDL,0.2-0.4 mg/mL),和高密度脂蛋白(HDL,0.35-0.85 mg/mL)五種蛋白質具有藥物結合能力[4],藥物在體內能夠與其中一種多種蛋白質結合而被運輸到身體各部位,但是ZnPc與血漿蛋白質的相互作用研究甚少。因此,ZnPc與血漿蛋白質的相互作用研究對藥物在體內的結合、運輸、分布、藥物穩定性及藥物安全劑量等方面具有重要的指導意義。
本章以血漿中含量最豐富的人血白蛋白(HSA)為模型,研究酞菁鋅衍生物(ZnPc)與HSA的相互作用。HSA是人體循環系統中含量最為豐富的一種蛋白質(約占血漿濃度的52~60%),主要承擔許多氨基酸分子、藥物分子、脂肪酸和代謝物等的結合運輸。從結構上看,HSA是由585個氨基酸殘基組成的單多肽鏈,且僅在其IIA結構域中存在一個特征色氨酸殘基(Trp214)。HSA分子中包含了3個結構相似的結構域:α-螺旋結構域I,II和III(I:1~195;II:196~383;III:384~585)α-螺旋,每個結構域又分別包含了2個由4~6個螺旋結構組成的亞結構域(IA,IB;IIA,IIB;IIIA,IIIB)[4-6]。HSA能夠結合多種光敏劑(PS),如華法令、地高辛、布洛芬、紫紅素18、吩噻嗪和二氫卟吩 p6等,并且PS在HSA分子中的兩個高效結合位點分別是I和II結構域[7-8],但是大多數研究僅側重于PS與HSA的結合位置,沒有深入研究其相互作用機理。
1 實驗方法
人血白蛋白(HSA)晶體結構從PDB蛋白質結構數據庫獲得(PDB ID:1N5U)。HSA晶體結構(圖1)由一條具有585個氨基酸殘基的肽鏈組成,主要為α螺旋結構,其空間結構由三個結構域組成:domain I、domain II、domain III,每個結構域又含有A、B兩個亞結構域,以槽口相對的方式形成圓筒狀結構,幾乎所有疏水性氨酸殘基都包埋在圓筒內部,構成疏水腔。大多數藥物在HSA上的結合部位為亞結構域IIA 和 IIIA,即site I和 site II。使用Discovery Studio 2.5軟件除去晶體結構中的配體分子、結晶水分子和其他無關的共因子(cofactor),并對受體蛋白進行加氫、加GASTEIGER電荷處理。
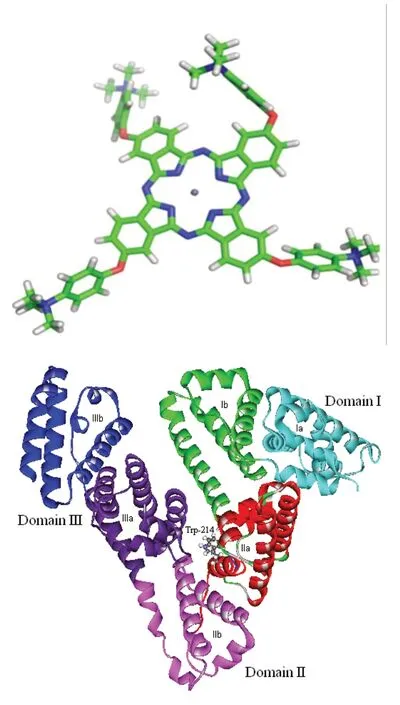
圖1 人血白蛋白(HSA)晶體結構和酞菁鋅衍生物(ZnPC)結構
酞菁鋅分子的結構模型采用量子化學半經驗方法PM6優化酞菁鋅分子ZnPc的結構(圖1)。然后基于優化結構,在m062x/6-31g*水平下計算這些酞菁鋅分子的ESP電荷,用于分子對接和靜電勢分析。所有計算使用Gaussian 09軟件完成。
本章使用Autodock Vina軟件對酞菁鋅小分子和受體HSA作用過程進行研究。由于酞菁鋅分子與HSA的結合位點可能位于HSA的IIA 和 IIIA區域,即site I 和 site II,故本文將酞菁鋅分子與HSA的IIA 和 IIIA區域進行對接。受體對接區域分別包含IIA和IIIA兩個空腔,中心坐標分別為23.589,5.710,7.870和3.419,5.808,17.517,大小均為40×40×40,保留對接的優勢構像10個,其他參數采用默認值。對接得到的酞菁鋅小分子和受體HSA所形成的復合物體系,采用雜化的量子力學/分子力學(QM/MM)方法進行結構優化(Gaussian 09計算關鍵字為ONIOM)。復合物體系中,酞菁鋅小分子被設置為高層并以半經驗的PM6方法進行處理,剩余部分則分別由低水平AMBER力場處理。此外,在優化含HSA蛋白體系前,均加入適當數量的Na+離子,使HSA蛋白維持電中性。酞菁鋅分子與HSA的結合能ΔE 的計算如式(4.3)所示:
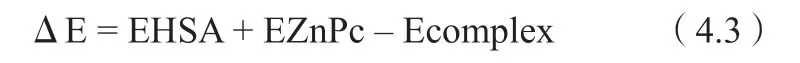
式中,EHSA 為HSA能量,EZnPc為酞菁鋅分子能量,Ecomplex 為復合物能量。
2 結果與討論
圖2是ZnPc與HSA的IIA域對接結果。由圖可看出ZnPc衍生物進入了HSA的IIA域疏水口袋,并形成了穩定的復合物。酞菁分子都呈風車型,有一個中心平面酞菁環和四條柔性側鏈,其中三個分子的中心酞菁環部分相同,而側鏈基團不同。分析三個酞菁鋅分子與HSA的結合模型,三個小分子的中心平面酞菁環均插入HSA的同一位置,而四條柔性的側鏈則在相應結合區域與氨基酸殘基產生相互作用而發生一定的彎曲扭轉。三個酞菁鋅分子結合到HSA的IIA位點后:小分子的酞菁環結合到HSA的IIA與IIIA兩個區域之間;小分子上的四條側鏈中的兩個側鏈插入HSA的空腔,其中一個側鏈插入site I位點,另一個結合插入到HSA的IIA與IIIA兩個區域之間;小分子的另外兩個側鏈則向HSA外伸展并結合在HSA的其他疏水表面。三個酞菁鋅分子插入HSA內部的兩個側鏈基團所處的位置一致,由于插入空腔較小,而側鏈基團較大,兩者的空間位阻作用使柔性的側鏈無法向其他位置伸展,發生一定彎曲扭轉結合在HSA內部。
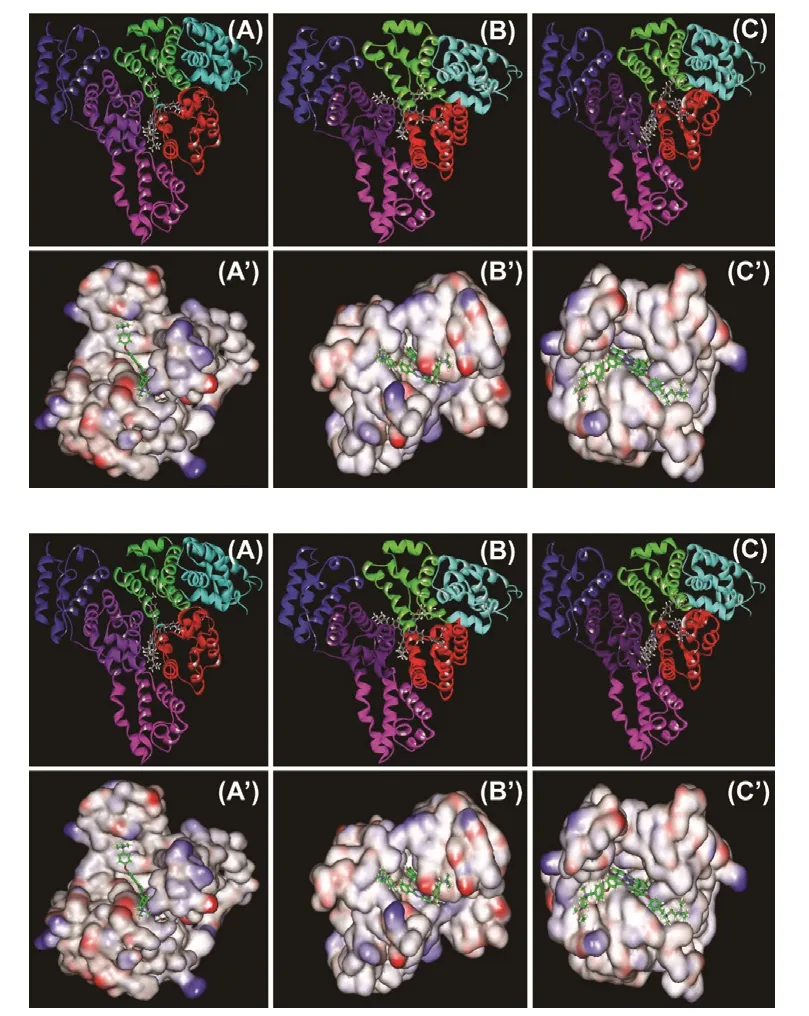
圖2(A)ZnPc與HSA分子對接結果示意圖,(A’) ZnPc在HSA活性口袋的界面圖(HSA用界面圖表示,紅色表示負電荷,藍色表示正電荷),表面電荷范圍為–0.1~ 0.1 e.
為進一步研究酞菁鋅分子與HSA的結合機制,我們對酞菁鋅分子與HSA結合后與其周圍氨基酸殘基的相互作用進行分析(圖3):酞菁鋅分子結合到HSA的site I位點后,酞菁環的中心位于氨基酸殘基GLU292,VAL293,GLU294前方;插入site I位點的側鏈,結合到含Trp 214的螺旋附近,插入到IIA與IIIA之間的側鏈結合到Tyr 150所在的螺旋附近。表1列出了與酞菁鋅分子作用距離為3 ?的內部氨基酸殘基和空腔外部氨基酸殘基,可以看出隨著側鏈基團體積的增加,與酞菁鋅分子作用的氨基酸殘基數目也增加。此外,隨著酞菁分子與HSA的相互作用的基團增多,兩者間的空間位阻也會不斷增大,反而可能會削弱了酞菁鋅分子與HSA的結合,導致結合能降低。而向外伸展的兩個側鏈基團則空間位阻相對較小,側鏈基團可以柔性伸展,結合位置有所不同。
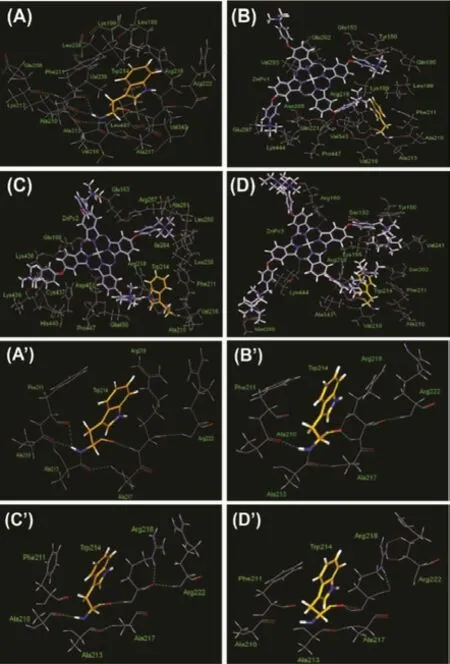
圖3(A)HSA分子IIA域內Trp214殘基周圍氫鍵;(B)ZnPc摻雜后HSA分子IIA域內Trp214殘基周圍氫鍵變化情況
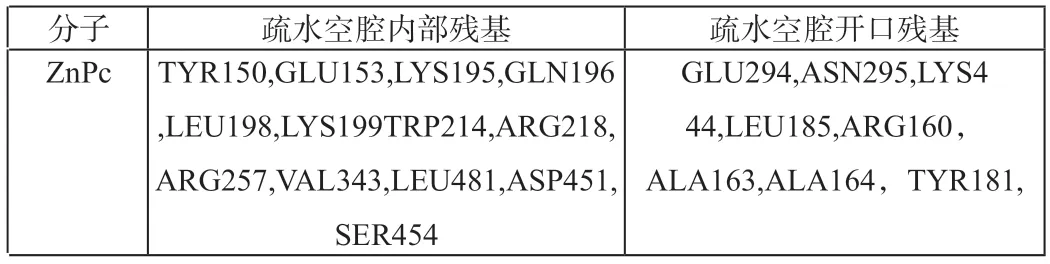
表1 ZnPc3?范圍內的氨基酸殘基
Trp 214位于HSA中IIA空腔中的一個α螺旋中部,是HSA中唯一的色氨酸殘基,實驗中可通過測定Trp 214光譜變化來測定小分子與HSA的site I位點的相互作用。因此通過分子模擬研究ZnPc衍生物與Trp 214的相互作用可以很好地解釋光譜實驗結果。
從圖3上可以看出,在ZnPc-HSA復合物中,酞菁鋅中插入site I的側鏈與HSA上的疏水氨基酸Trp 214相鄰,表明酞菁鋅小分子的疏水側鏈與HSA的Trp 214殘基之間可能存在疏水作用。另外,由于Trp 214殘基側鏈N原子帶負電荷,而與之相鄰的酞菁鋅側鏈上的季銨陽離子帶正電荷,表明酞菁鋅小分子與HSA的Trp 214殘基之間可能存在靜電作用。此外,在ZnPc-HSA復合物體系結構中,小分子和HSA之間沒有形成氫鍵。綜上所述,根據ZnPc-HSA復合物結構可知,小分子與HSA的Trp 214之間可能主要存在疏水作用和靜電作用。
酞菁鋅的四條側鏈均帶有正電荷的季銨陽離子(圖4)。故ZnPc與Trp 214殘基之間的產生了靜電作用,可能對Trp 214殘基的熒光光譜產生影響。Trp 214殘基與酞菁鋅分子相鄰部分的分子表面帶較大負電荷。與HSA結合后,Trp 214靜電勢的分布并沒有明顯變化,但其最小負電勢在不斷增加,HSA、HSA-體系中Trp 214殘基的最小負電勢分別為-47.104和-46.587。表明HSA與酞菁鋅分子結合后,酞菁鋅與Trp 214殘基相互之間存在靜電作用。

圖4 ZnPc分子的靜電勢圖
綜上所述,酞菁鋅衍生物分子摻雜人血白蛋白時主要通過一條側鏈插入人血白蛋白HSA的IIA位點,使得Trp 214殘基附近的結構和環境發生改變。兩者間有較強的相互作用,主要包括疏水作用和靜電作用。此外,結合能計算結果表明酞菁鋅分子可結在HAS的IIA和IIIA區域,且摻雜后形成了穩定的復合物。

