RTN4對于結腸癌細胞增殖的調控作用
楊夢恬, 袁菊懋
1.暨南大學生命科學技術學院, 廣州 510000;2.珠海中科先進技術研究院, 廣東 珠海 519000
結腸癌是發生于結腸部位的消化道惡性腫瘤,據2018年的全球癌癥統計調查顯示,全球新增結腸癌病例約為180萬,結直腸癌的新增病例約占患癌新增病例的12.1%[1]。全球約有88萬例結腸癌的死亡病例,死亡率大概占全球癌癥死亡率的9.2%[2-3]。有研究表明,我國約54%的人口存在腸道問題[4]。結腸癌的發生有飲食因素和遺傳因素,其中遺傳因素對于結腸癌的發生尤為重要。導致未滿25歲的青少年患結腸癌的首要誘發條件便是遺傳性的結腸疾病[4]。現階段關于結直腸癌的基因治療包括原癌基因沉默治療、抑癌基因治療、免疫基因治療和抑制腫瘤血管生成基因治療等[5]。然而,由于基因的多態性,靶向基因治療仍有風險,所以目前仍需進一步研究有效治療結腸癌的策略。因此,尋找與新的結腸癌發生有關的基因顯得尤為迫切。同時,這也為揭示結腸癌病理、發現新的治療靶點以及提高臨床預后提供了理論和依據。
RTN4基因(reticulon 4)屬于網紋網基因編碼家族,此家族與內質網有關,參與神經分泌或者神經內分泌細胞的膜運輸。RTN4與促生存以及細胞骨架相關過程有關,其下調降低了鞘磷脂的合成,能夠干擾AKT的質膜定位以及影響微管蛋白的穩定性[6],這提示其可能參與調控細胞自噬。除此之外,RTN4基因在人類的多種癌癥細胞中發生突變[6]。
有研究表明,在正常組織中可以通過自噬介導的損傷緩解來抑制腫瘤細胞。因此,正常細胞激活自噬可以抑制腫瘤的發生,在腫瘤治療中,激活自噬可能有助于腫瘤治療[7]。自噬小體中存在的LC3-I和LC3-II是細胞發生自噬的分子標志。在自噬發生的過程中,LC3先通過切除C端的氨基酸轉化為產生胞漿定位的LC3-I、LC3-I,再通過結合磷脂酰乙醇胺(phosphatidyl ethanolamine, PE)產生LC3-II[8]。LC3-II的含量和發生自噬的程度成正比,LC3-II/I比值的大小可估計自噬水平的高低。
由此,本文對與結腸癌細胞相關的RTN4基因進行生物信息學數據分析,通過設計構建敲低的RTN4基因質粒,將其轉染進結腸癌細胞HCT116,觀察被轉染了敲低RTN4基因的質粒的結腸癌細胞的增殖能力以及檢測自噬相關蛋白標志物,以期探索RTN4基因與結腸癌發生發展的關系,為結腸癌的防治研究提供參考。
1 材料與方法
1.1 材料
1.1.1細胞株 本次研究所用到的細胞系主要有:HCT116、HEK293T。其中培養HCT116細胞的培養基為GIBCO 1640完全培養基,培養HEK293T的培養基為GIBCO DMEM完全培養基。
1.1.2實驗試劑 1640培養基、胎牛血清購自美國GIBCO公司;DMSO購自美國Sigma公司;細胞培養板購自美國Corning公司;Lipofectamine 3000、無血清培養基Opti-MEM ?、細胞增殖檢測Cell TraceTMCFSE Cell Proliferation Kit購自美國Invitrogen公司;質粒DNA小提試劑盒、DNA膠回收試劑盒購自天根生化公司。
1.1.3主要儀器設備 二氧化碳細胞培養箱購自香港Heal Force公司;熒光定量PCR儀、凝膠成像分析儀、PCR儀購自美國Bio-Rad公司。
1.2 方法
1.2.1通過生物信息學網站分析基因功能 通過The Human Protein Atlas(https://www.proteinatlas.org/)查詢RTN4基因的生存曲線,查看RTN4基因的表達水平與患者生存率的聯系。
1.2.2構建RTN4敲低質粒 利用Thermo Fisher公司RNAi網站設計出針對RTN4基因特異性敲減的片段,然后通過對pLKO.1載體進行雙酶切,膠回收純化后,經T4連接酶將雙酶切線性化載體與設計的目的片段進行連接、轉化和質粒提取,采用雙酶切和測序的方法對重組質粒進行序列鑒定。
1.2.3RTN4敲低質粒轉染至HCT116細胞 通過胰酶消化收集細胞,用適當的完全培養基平鋪HCT116細胞于35 mm 培養皿上,當細胞貼壁完全后即可開始轉染。轉染前2 h換液(用1.5 mL 完全培養基置換舊的培養基)。收集病毒上清。將細胞平鋪于6孔板,最佳密度為30%~70%。加入病毒上清和8 g·mL-1polybrene, 充分搖勻后置于37 ℃溫箱孵育。12~24 h 后換液,長滿后傳代。經嘌呤霉素篩選獲得穩定株,并通過實時熒光定量PCR對穩定轉染細胞株的敲減效率進行驗證。引物設計為:RTN4:F:5’-TCTTCCTGCTGCATCTGAGCCT-3’,R:5’-GCAGTTTCAAGCAGGACAGATGG-3’; ACTIN:F:5’-CACCATTGGCAATGAGCGGTTC-3’,R:5’-AGGTCTTTGCGGATGTCCACGT-3’。
1.2.4WST-1檢測細胞增殖實驗 96孔板每孔加入5 000個細胞。分別于培養48和72 h檢測細胞活性。每孔加入10 μL WST-1溶液。用加了相應量細胞培養液和WST-1溶液但沒有加入細胞的孔作為空白對照。在細胞培養箱內繼續孵育0.5~4 h,把96孔板置于130 r·min-1搖床上1 min,以充分混勻待檢測體系,在450 nm測定吸光度。
1.2.5Western blot實驗 配置分離膠為12% SDS-PAGE凝膠,接著加入適量的電泳緩沖液在電泳槽中。取出蛋白樣品,用移液器移入凝膠孔中上樣。蓋上電泳槽,設置電泳參數進行電泳。剪出與凝膠相同尺寸的PVDF膜,將凝膠放在濾紙中間且浸在都是緩沖液的轉移槽中貼膜,接著合上轉移槽,通電,在裝滿冰的盆中放入轉移槽,恒壓90 V轉膜1.5 h。將轉移好的膜移至含有封閉液的平皿中,室溫下封閉1 h。將一抗稀釋至適當濃度,4 ℃孵育過夜。從一抗中取出膜,用TBST洗滌共3次,每次5 min。將膜放置于裝有二抗的平皿中室溫孵育1 h。1 h后,從二抗中取出膜,用TBST洗滌共3次,每次5 min。顯影液的配置:放入等體積的發光試劑A液和B液混勻于EP管中。最后用濾紙吸干膜上殘留水分,顯影盤上擺放膜,加入適量顯影液后,用圖像處理軟件Image J,進行顯影、拍照,并分析結果。
2 結果與分析
2.1 結腸癌相關基因與結腸癌患者生存率分析
為了更好地了解RTN4與結腸癌的關系,根據The Human Protein Atlas數據庫分析,查詢RTN4基因與結腸癌患者生存率的關系,發現RTN4基因表達水平高的結腸癌患者的生存率高于RTN4基因表達水平低的結腸癌患者(圖1)。這說明,RTN4基因有可能是潛在的抑癌基因。
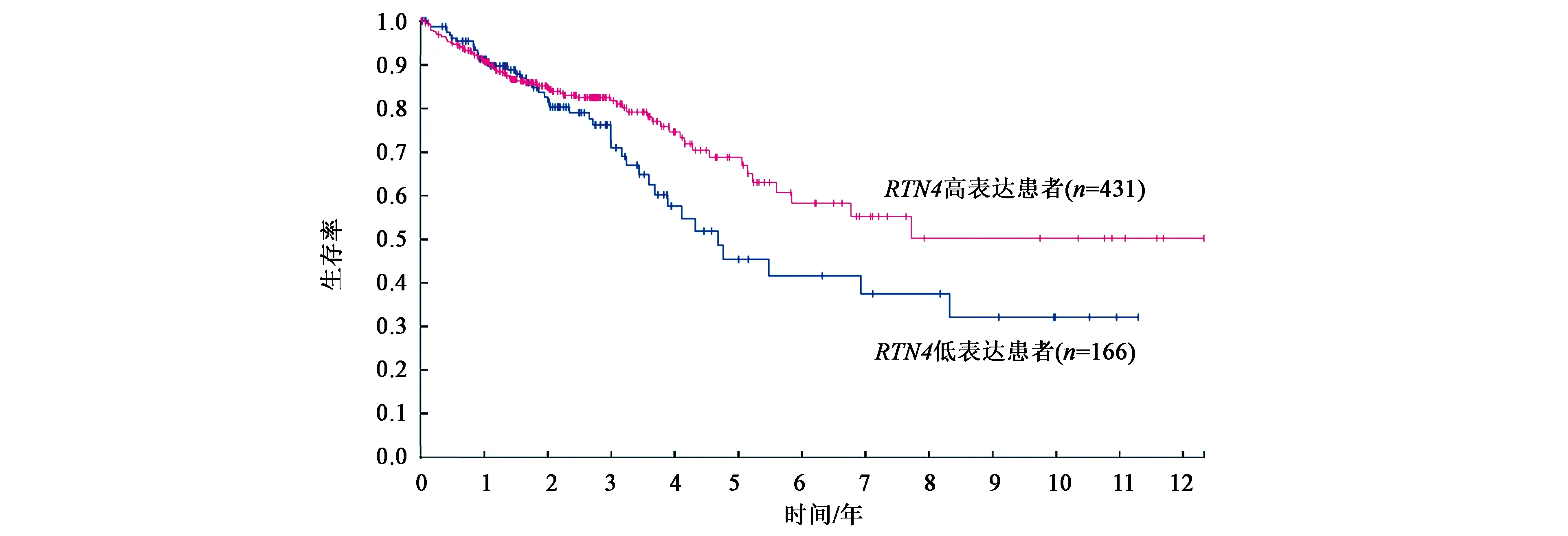
圖1 RTN4基因與結腸癌患者的生存率分析Fig.1 Survival analysis of colon cancer patients with RTN4 gene
與此同時,本研究根據The Human Protein Atlas數據庫分析,發現69%的病人在5年內生存情況下RTN4基因表達水平較中位數高,45%的病人在5年內生存情況下RTN4基因表達水平較中位數低。
2.2 RTN4基因表達在結腸癌組織中的表達情況
為了系統地觀察RTN4基因是否對于結腸癌細胞的增殖有作用,本研究通過比較正常人與結腸癌病人的結腸組織(圖2),利用The Human Protein Atlas數據庫,分析表達譜數據,發現RTN4基因在結腸癌患者組織中表達水平偏低。
2.3 RTN4基因的敲低對結腸癌的影響
2.3.1獲得低表達RTN4的細胞株 為了進一步驗證RTN4基因對結腸癌細胞增殖能力的影響,本研究構建了低表達RTN4的細胞系。通過qPCR檢測RTN4基因mRNA水平的表達量,結果顯示RTN4在細胞中的表達量顯著下調(圖3),證明成功構建了低表達RTN4的HCT116細胞系。
2.3.2RTN4基因的敲低對細胞增殖能力的影響
為了驗證敲低RTN4基因是否對結腸癌細胞的增殖產生影響,通過WST-1細胞增殖實驗,結果(圖4)顯示,敲低RTN4基因促進了HCT116細胞增殖,結果有統計學意義(P<0.05)。
2.3.3敲低RTN4基因后對自噬蛋白表達情況的影響 通過對比對照組(圖5),發現RTN4基因敲低組的LC3-II/LC3-I蛋白的轉化量增多,p62蛋白減少。本研究發現結腸癌細胞的增殖能力變強,驗證了敲低RTN4基因會顯著增強結腸癌細胞的增殖能力,并且可能通過激活LC3/p62蛋白自噬來誘導自噬。
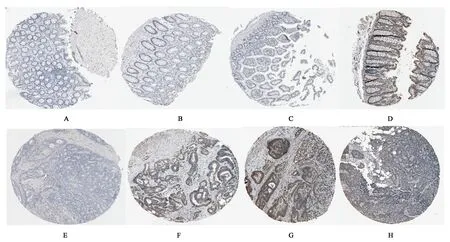
A:女性,62歲,正常結腸組織;B:男性,14歲,正常結腸組織;C:男性,73歲,正常結腸組織;D:女性,61歲,正常結腸組織;E:男性,87歲,結腸癌組織;F:男性,55歲,結腸癌組織;G:男性,82歲,結腸癌組織;H:女性,86歲,結腸癌組織圖2 正常結腸組織與結腸癌組織Fig.2 Normal colon tissue and colon cancer tissue
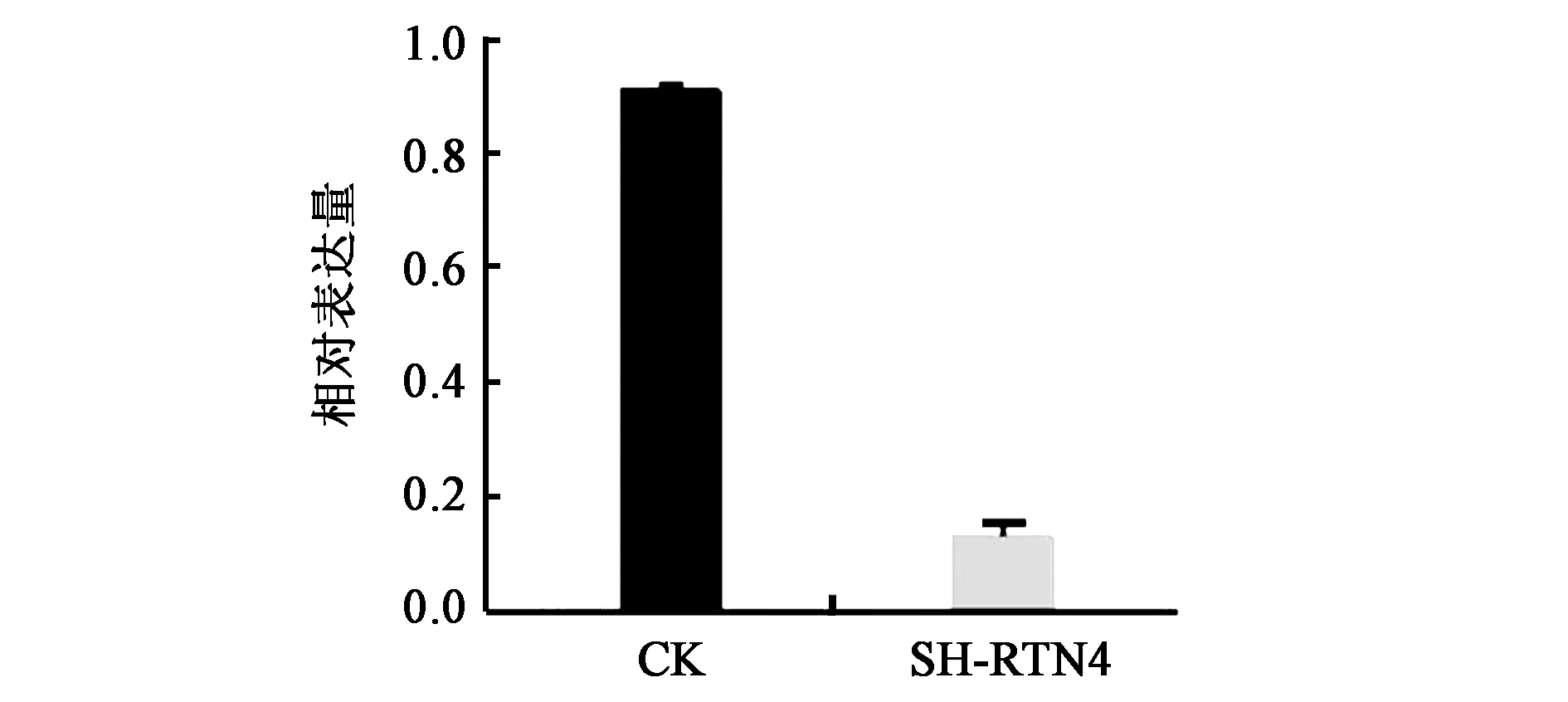
注:SH-RTN4—RTN4低表達細胞系。圖3 插入RTN4敲低質粒后細胞內RTN4基因mRNA的表達情況Fig.3 Expression of RTN4 mRNA in cells after insertion of RTN4 knock-down plasmid
3 討論
將生物信息學大數據分析應用于腫瘤相關的研究是近年來炙手可熱的手段之一。有研究團隊利用生物信息學分析對甲狀腺癌癥患者的病理組織與正常人進行對比,通過高通量測序分析,發現甲狀腺癌癥患者1 133位氨基酸處的Nebulin gene(NEB)突變頻率高于正常人[9]。也有研究利用生物信息學分析了與免疫相關的長鏈非編碼RNA,通過評估其預后,發現它在免疫治療效果方面具有潛力[10]。本團隊通過文獻查閱以及使用大數據分析平臺The Human Protein Atlas在線數據庫(https://www.proteinatlas.org/)分析,發現PRKCB、SLC9A3R1、CYB5A以及RTN4基因與結腸癌患者生存率具有顯著的相關性,是潛在的抑癌基因,CYB5A和SLC9A3R1目前研究較多。有關胰腺癌的研究通過實驗與分析發現CYB5A可誘導自噬,且同時抑制胰腺癌腫瘤細胞的生長與轉移來提高生存率[11];有研究表明,在惡性卵巢癌腫瘤中的SLC9A3R1基因剪接識別位點的突變會影響癌細胞行為[12]。這與我們通過數據庫分析的結果一致。本研究通過數據分析,發現高表達RTN4基因的病人的生存率高于低表達RTN4的病人的生存率,因而選取RTN4基因研究其在結腸癌發生發展中的功能。后續實驗仍有待進一步研究PRKCB、SLC9A3R1和CYB5A在結腸癌中的作用。
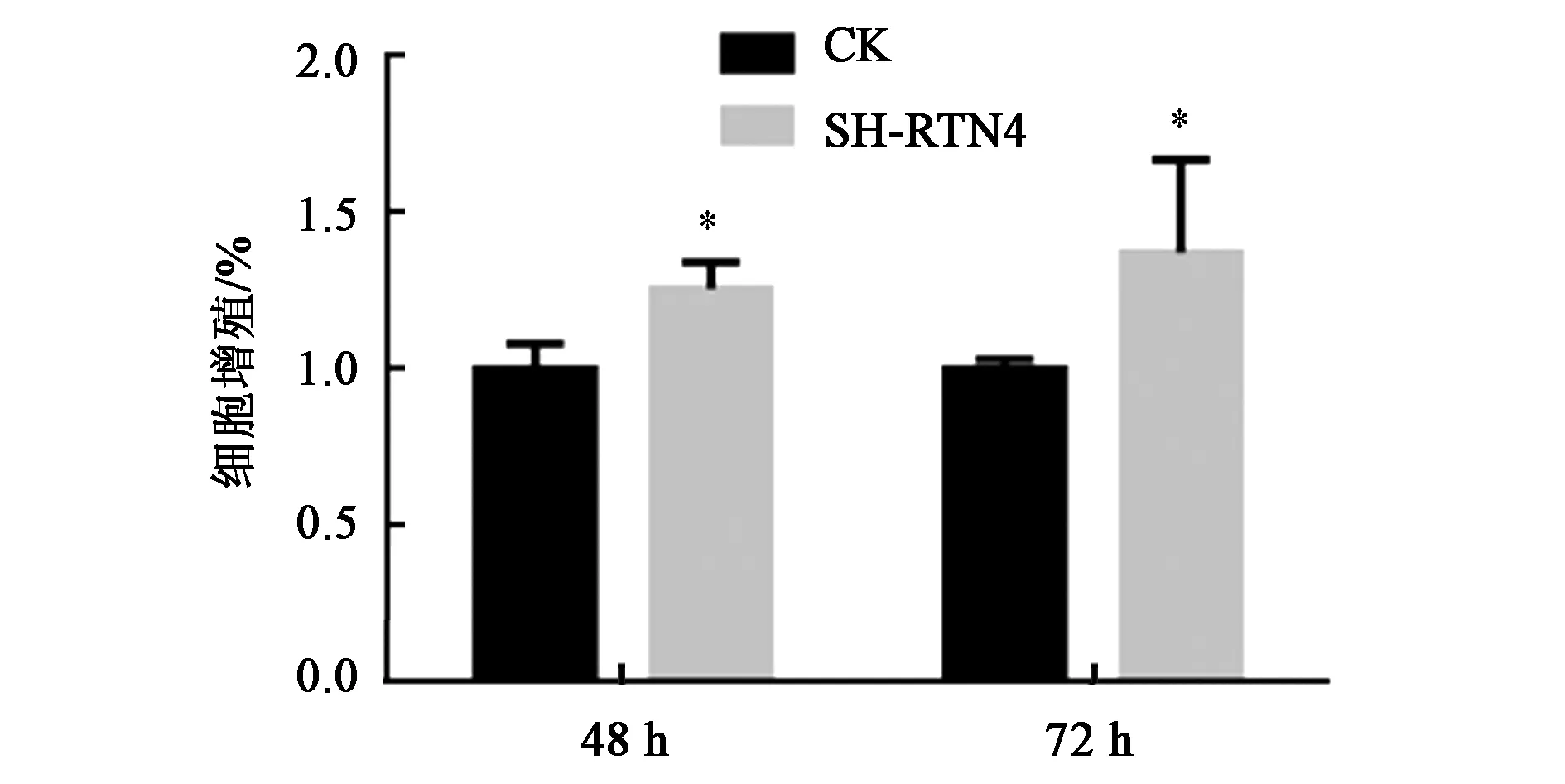
注:SH-RTN4—RTN4低表達細胞系。*—同一時間處理內與對照相比,差異具有統計學意義(P<0.05)。圖4 RTN4敲低后結腸腫瘤細胞在不同時間的增殖情況Fig.4 Proliferation of colon tumor cells at different time after RTN4 knock-down
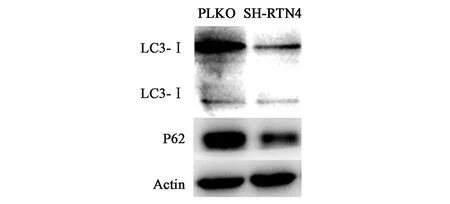
圖5 RTN4基因敲低后自噬蛋白的表達情況Fig.5 Expression of autophagy proteins after RTN4 knock-down
在與鼻咽癌相關研究中,RTN4基因中的rs292081多態性與鼻咽癌易感性的增加有顯著關聯[13]。在相關的前列腺癌研究中,通過實驗表明,慢病毒介導的RTN4過表達可以顯著抑制前列腺癌細胞(DU145以及LNCaP),RTN4過表達前列腺癌細胞在細胞周期阻滯G2/M期明顯衰老,這些結果表明RTN4基因以某種方式參與了前列腺癌腫瘤的進展[14]。在胃癌、肺癌、腎癌、乳腺癌等相關研究中,RTN4的基因表達會影響病人的存活率,RTN4基因高表達會顯著提升病人的存活率。由此可見,RTN4在腫瘤形成中參與了重要的作用[6]。
本研究成功構建了RTN4干擾質粒,通過慢病毒轉染構建了敲低RTN4的直結腸癌細胞系HCT116,發現了敲低RTN4基因的表達后,會促進結腸癌腫瘤細胞的增殖。這些結果提示RTN4基因在結腸癌中的低表達與結腸癌腫瘤的發生和增殖有著密切的關系,同時說明了RTN4基因對結腸癌HCT116細胞的生長具有抑制作用,揭示了該基因是潛在的治療結腸癌的基因靶點。
自噬分子通路也與惡性腫瘤密切相關。目前有3種自噬測量方法:電鏡觀察、Western blot蛋白免疫印跡技術以及LC3免疫熒光顯微鏡技術。其中,主要通過在不同條件下觀察LC3蛋白(微管相關蛋白1的輕鏈3,microtubule-associated protein1 light chain3)的濃度變化來研究。在自噬發生過程中,LC3蛋白合成后立即在其羧基端被Atg4所剪切,Atg7和Atg3在內的泛素樣本體系會修飾和加工產生細胞漿定位的LC3-I,產生分子量為14 kD的LC3-II,并定位到自噬小體中。LC3的表達以及LC3-I到LC3-II的轉化程度已在檢測自噬水平中成為重要標志[15]。自噬可以保護休眠的腫瘤細胞,在乳腺癌相關研究中,發現腫瘤細胞通過上調自噬水平表達,可以抑制TRAIL(腫瘤壞死因子相關凋亡誘導配體,TNF-related apoptosis-inducing ligand),而TRAIL可以抑制腫瘤轉移[16]。有研究發現,自噬會促進腫瘤細胞的增殖。在缺氧、營養缺失的腫瘤微環境下,激活自噬有助于肝腫瘤干細胞CD133+的存活[17]。因此,研究自噬表達水平對觀察腫瘤細胞的侵襲和轉移有著重要作用。研究表明,RTN4基因的下調會影響鞘磷脂的合成以及削弱AKT的質膜定位,同時也會在體外抑制癌細胞的增殖。本研究中敲低RTN4基因后,p62蛋白表達顯著下調,LC3-I到LC3-II的轉化程度提高,表明敲低RTN4促進了結腸癌細胞HCT116發生自噬,可能是潛在的抑制腸癌細胞增殖的機制,然而其具體的關鍵效應分子仍待進一步研究驗證。
本研究對結腸癌相關基因RTN4進行生物信息學大數據分析,查詢了RTN4基因的功能信息,然后構建了敲低RTN4基因的質粒并轉染進腸癌HCT116細胞,觀察腫瘤細胞的生長速度。研究發現RTN4基因與結腸癌腫瘤細胞有密切聯系,敲低RTN4基因轉染進腸癌細胞會促進其生長,同時激活了自噬通路。因此,本研究為進一步探索RTN4基因對于結腸癌細胞的影響機制提供了研究方向和理論基礎。

