食用植物油中常見真菌毒素及其脫除方法
紀俊敏,呂雅芳,張 巖,劉玉蘭,汪學德
(河南工業大學 糧油食品學院,河南 鄭州 450001)
食用油作為消費必需品,與人類生活息息相關,它不僅供給人體能量(1 g油脂在體內完全氧化時,大約可產生39.8 KJ的熱量,比糖和蛋白約高1倍),還提供人體必需脂肪酸;此外,它也是用于制備食物的基本成分之一,具有改善和提高食品的風味,促進脂溶性維生素(VA、VD、VE、VK)吸收的作用。按來源可分為植物油和動物油,與動物油相比,植物油含有更多的不飽和脂肪酸,有益于健康,并且某些食用油適用于高溫烹飪和直接用于色拉調味料[1],因而更受消費者青睞。盡管植物油具有良好的健康益處,但有許多報道表明植物油和油料種子存在真菌毒素感染的風險。
1 食用植物油中常見真菌毒素
目前已鑒定出400多種真菌毒素,在植物油中常見的是黃曲霉毒素(AFT)[2]、玉米赤霉烯酮(ZEN)[3]、嘔吐毒素(DON)[4]、赭曲霉毒素A(OTA)[5]、T-2毒素(T-2)和伏馬毒素(FUM)[3],并且受到了政府立法的高度重視和嚴格的監管[4,6]。
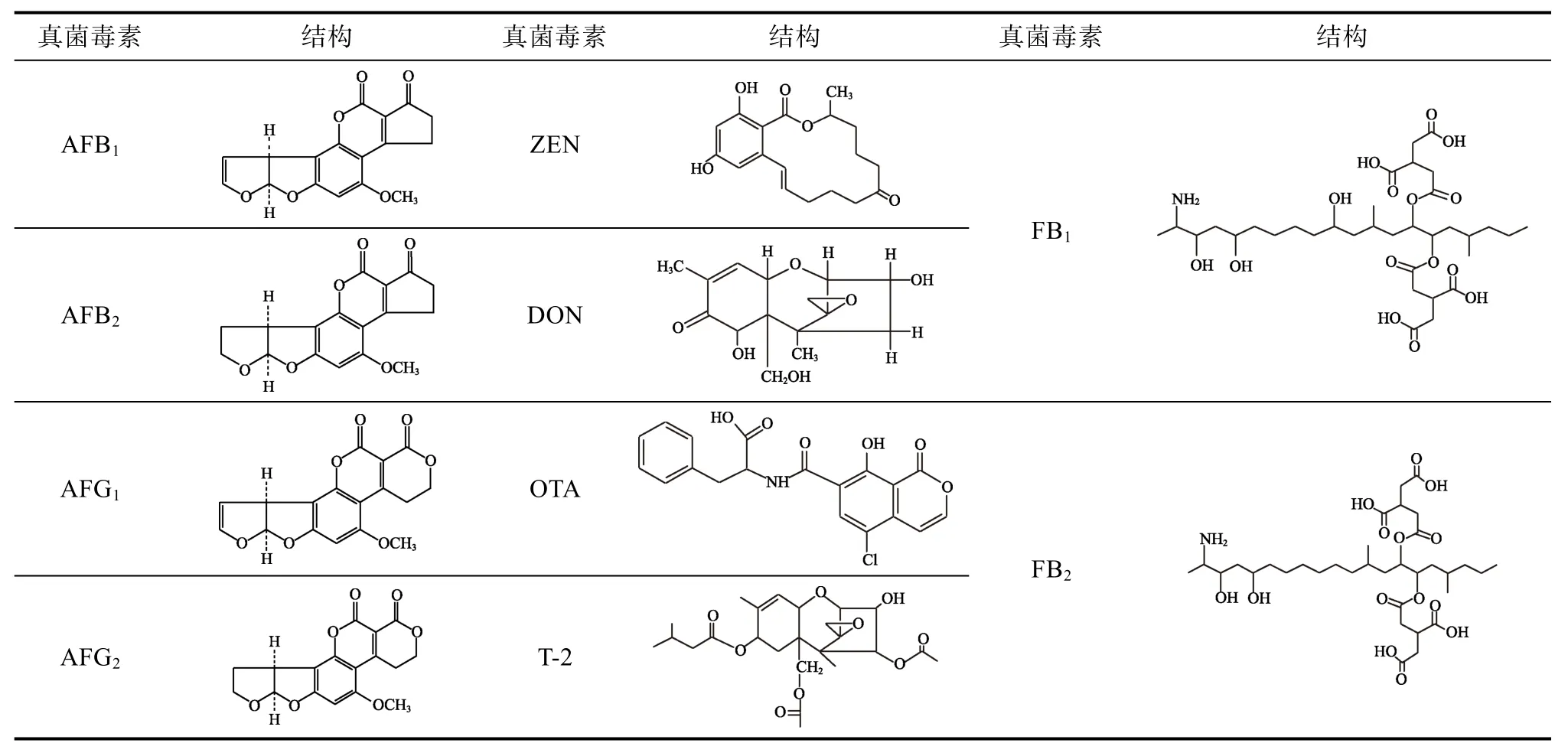
表1 植物油中常見的真菌毒素Table 1 Primary mycotoxins in vegetable oils
1.1 黃曲霉毒素(AFT)
AFT主要是由真菌黃曲霉菌(A.flavus)、寄生曲霉菌(A.parasiticus)、溜曲霉菌(A.tamari)和集蜂曲霉菌(A.Nonius)等污染農作物時產生的一類毒性較高的次級代謝產物[7],也是到目前為止發現的毒性最大的真菌毒素[8]。植物油中主要存在的AFT是黃曲霉毒素B1(AFB1)、B2(AFB2)、G1(AFG1)和 G2(AFG2)[9]。AFB1是植物油中含量最多的一種 AFT,也是毒性最強的AFT。大量研究報告了世界上多個地區的食用油中AFT的發生率很高。Elzupir 等[10]于2009年對蘇丹喀土穆州的81個食用植物油樣品(包括 14個市售芝麻油、21個市售花生油、19個市葵花籽油、27個當地工廠取樣的混合油)的調查發現,98.8%的食用植物油樣品受到 AFT污染,且總 AFT(AFB1+AFB2+AFG1+AFG2)的含量為 0.4~339.9 μg/kg,平均為 57.5 μg/kg。Daradimos等[11]在 50份希臘市售橄欖油樣品中發現 AFB1的檢出率為72%,含量在 2.8~46.3 ng/kg。Ferracan 等[12]測得意大利橄欖油中的AFT含量為未檢出~2.4 μg/kg。Sahay等[13]分析了100個印度北部烹飪的芥末油,發現33 個油樣品中含有 AFB155~87 μg/kg。Karunarathna等[14]報道了椰子油中 AFT 的檢出率為 37.5%,含量為 2.25~72.70 μg/kg。徐文靜等[15]對中國 8省 738份市售食用植物油中 AFT 污染狀況進行調查,發現食用植物油樣品中AFT總含量為0.06~221.00 μg/kg,平均含量為 19.30 μg/kg。
1.2 玉米赤霉烯酮(ZEN)
ZEN 又名F-2毒素,化學名為6-(10-羥基-6-氧代-反式-1-十一烯基)-β-乙酰丙酸內酯,主要是由鐮刀菌屬的菌株產生的一種酚二羥基苯甲酸內酯,廣泛分布于奶制品、受污染的谷物及其農副產品中,尤其是玉米及其加工制品中。Kappenstein等[16]測得玉米胚芽油(n=38)、大豆胚芽油(n= 20)和小麥胚芽油(n=11)中ZEN檢出率為100%、70%和91%,平均含量分別為169、4和12 μg/kg,最高值分別達921、41和46 μg/kg。ZEN污染主要在玉米胚芽油和小麥胚芽油中存在[17]。
1.3 嘔吐毒素(DON)
DON 主體成分為脫氧雪腐鐮刀菌烯醇,又稱去氧瓜萎鐮菌醇,化學名為3,7,15-三羥基-12,13-環氧單端孢霉-9-烯-8-酮,通常是由生長在谷物(如小麥、玉米、大麥和秣草)中的霉菌鐮紅菌素生成的。Giménez[18]報道了小麥胚芽油(n=25)中 DON平均濃度為 41 μg/kg,最高達163 μg/kg,檢出率為40%。
1.4 赭曲霉毒素A(OTA)
OTA主要是由赭曲霉、碳黑曲霉和疣孢青霉等在濕度較大環境下產生的次級代謝產物。其基本結構骨架為異香豆素和β-苯基丙氨酸組成,化學名為 7-羧-5-氯-8-羥-3,4-二氫-3-R-甲基異香豆素-7-L-β-苯丙氨酸[19],存在于許多天然食品中,例如香料、咖啡、谷物、豆類、辣椒和葡萄中[20]。OTA在意大利南部(坎帕尼亞大區、西西里和普利亞大區地區)和摩洛哥的橄欖油(n=30)中檢出率高達80%,最高達到了17.0 μg/kg[12]。
1.5 T-2毒素(T-2)
T-2 毒素主要由鐮刀菌產生的一種次生代謝產物,它主要損害肝(致使肝臟生物膜形態和功能改變)、誘發皮炎,引起生物機體的急性或慢性中毒。Schollenberger等[21]對市售110個食用油樣進行檢測,發現16個葵花籽油中有3個檢出 T-2毒素(檢出率18.8%),含量都是2 μg/kg,17個玉米胚芽油中有 11個檢出 T-2毒素(檢出率64.7%),含量為 2~13 μg/kg,均值 6 μg/kg。
1.6 伏馬毒素(FUM)
FUM 是由串珠鐮刀菌產生的水溶性雙酯化合物。2017年10月27日,世界衛生組織國際癌癥研究機構公布的致癌物清單初步整理參考,伏馬毒素B1(FB1)和伏馬毒素B2(FB2)在2B類致癌物清單中。FUM 主要污染玉米及玉米制品。李杉等[22]對河南省18個市的食品調查發現,玉米油中FB1檢出率為6.98%,含量為未檢出~1.23 μg/kg(均值為 0.49 μg/kg),FB2檢出率為 0,均值為0.62 μg/kg;FB3檢出率為 0,均值為 0.62 μg/kg。
2 食用植物油中真菌毒素脫除(或消減)方法
已經有大量關于真菌毒素脫除的研究,但是很多脫毒技術都是基于在油料種子、飼料、水、土壤及空氣中的污染脫除中的應用,食用油與水、土壤和空氣不同,食用油的組成復雜,脫毒的過程中可能還會造成食用油品質的改變。以下主要是針對食用油中真菌毒素脫除采用的技術進行綜述。
2.1 醇提
Schwartzbord等[23]研究了分別用含有 50%海地產乙醇(簡稱為CL)和50%色譜級乙醇(簡稱為 HL)提取花生油中 AFT(AFB1+AFB2+AFG1+AFG2),結果表明,使用1:3(g/mL)的油:CL可以將花生油中的AFT從185 μg/kg(高污染的花生油)降至11 μg/kg,脫除率達94%;使用1:5(g/mL)的油:CL可以將油中的AFT從19 μg/kg(低污染)降至1.4 μg/kg,脫除率達93%;使用1:2(g/mL)的油:HL可以將花生油中的 AFT從152 μg/kg(高污染)降至 14 μg/kg,脫除率達 91%;使用1:3(g/mL)的油:HL可以將花生油中的AFT從33 μg/kg(低污染)降至3.8 μg/kg,脫除率達88%。
Karnofsky和 Hansotte[24]使用濃度為 80%~90%的醇(乙醇或異丙醇)溶液提取棉籽油,發現這些溶劑可用于去除 AFT 和棉酚。該方法還可以應用于其他具有高油含量的油料種子(如油菜籽和花生)的油脂提取。但實際應用時存在溶劑難回收、成本高、污染大等問題。
2.2 離心、過濾
通過離心可以去除花生油中 65%~70% 的毒素[25]。Banu等[26]也證明過濾可以清除葵花籽油中的AFB1。此外,一些油提純工藝也可以降低最終產品中的 AFT 濃度[27]。Jayaraman[28]、Abalaka[29]和 Schwartzbord[30]等報道了在制油過程中大多數AFT是保留在餅粕中的,只有一小部分(約占初始油料中總AFT的1%~35%)會轉移到提取的油中。這就說明AFT更易附著在固體上,離心過濾脫毒的原理可能也是基于此。
2.3 堿性電解水處理
Fan等[31]探索了一種堿性電解水(Alkaline electrolysed water,簡寫為AEW)降解AFB1的方法,在20 ℃時采用10 mL pH 12.2的AEW作用于40 μg/kg的花生油和橄欖油,只需5 min就能將 AFB1完全降解,且不會導致氯的遷移。但是該方法的脫毒效果受 AEW 特性、油的類型和AEW的體積等多種因素影響,距離實際應用還需進一步優化。
2.4 光催化降解
太陽光[32]、電子束(EB)[33]、等離子體[34-35]、微波[36]、γ-射線[37]、紅外輻射、脈沖光[38]以及紫外線(UV)[39-41]都會破壞真菌毒素的化學結構,其脫毒原理是真菌毒素分子吸收一定波長的光,一部分光能因激發熒光而消失,另一部分光能使毒素分子內部發生化學變化,熒光性消失,毒性也隨之消失(圖1)。
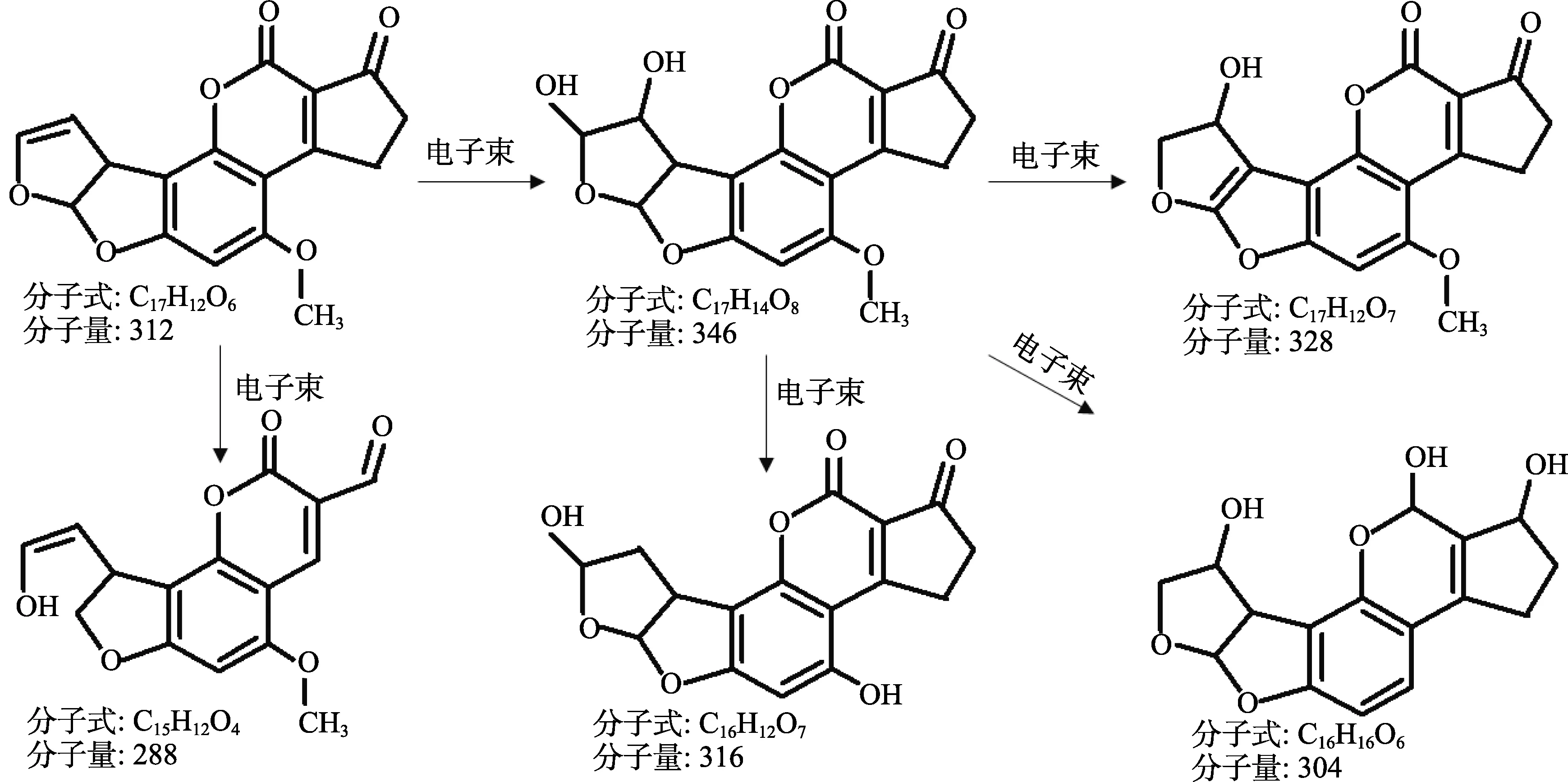
圖1 電子束降解機理[33]Fig.1 Electron beam degradation mechanism[33]
王辰龍等[36]分別以微波輻照和60Co輻照對花生油中的 AFB1降解,發現降解率隨輻照劑量的增加而增大;在相同輻照劑量下,降解率隨油中 AFB1初始含量的增加而緩慢降低。Magzoub等[42]用固定在玻璃載體上的TiO2和500 W高壓燈(920 W/m2的紫外線和2 000 W/m2的可見光)作為光催化劑,對蘇丹花生油中AFT進行光催化降解研究。結果表明,光催化優于UV-Vis照射(光解)作用,AFB1和AFB2在4 min的照射時間內在UV-Vis光下被有效解毒。固定化的 TiO2光催化劑對 AFB1和 AFB2的解毒率分別為 99.4%~99.5%和99.25%~99.40%。此外,TiO2光催化劑還可重復使用10次以上。但是新的研究發現強射線會對油脂的品質(如酸價、過氧化值升高,生物活性物質分解或失活)產生一定的影響,而且照射脫毒過程中,毒素大多只是被分解了,并未完全除去,某些條件下可能發生逆反應,重新生成毒素[39]。
2.5 堿處理
AFT在有機或無機堿的作用下,內酯環被破壞,水解生成無毒、水溶性的鄰位香豆素鈉鹽,部分鈉鹽隨皂腳一起從油脂中分離,其余的鹽可水洗后去除(機理見圖 2)[43]。Parker等[44]對含AFB1分別為 120 μg/kg和 812 μg/kg的花生毛油進行堿煉水洗后,發現油中 AFB1分別降至 10 μg/kg和14 μg/kg,即堿煉可以去除約98%以上的AFB1。不同的堿對 AFT消減順序為 KOH>NaOH>K2CO3>Na2CO3>KHCO3>NH4OH>NaHCO3>NH4HCO3[44-45]。
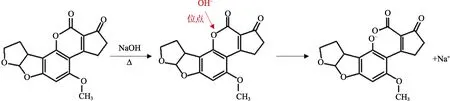
圖2 堿處理脫除黃曲霉毒素的機理Fig.2 Mechanism of aflatoxin removal by alkali treatment
堿處理法消減率高,是常用的油脂脫毒方法,但是,在酸性條件下,內酯環可以再次關閉并重新生成有毒的AFB1[46]。
2.6 吸附劑螯合
吸附作用是發生在吸附劑和吸附質的界面上,主要在吸附劑的孔隙中進行,因此吸附劑的多孔結構、孔徑、孔容分布和比表面積決定了吸附劑對吸附質的選擇性吸附能力。常用的脫毒吸附劑有活性炭、硅藻土、白土、凹凸棒石、蒙脫石等。
劉玉蘭等[47]對WY1活性炭、WY2活性炭、NORIT活性炭及普通活性炭在玉米毛油脫色過程中對 ZEN的脫除進行了研究并優化了吸附過程。發現添加油重2%的WY1活性炭對 ZEN的脫除率達到48.25%,ZEN含量從8 026.67 μg/kg降至4 153.77 μg/kg,具有一定的脫除效果,但仍高于歐盟400 μg/kg的限量。因此,該方法要想達到標準還需對處理后的油進一步精煉。而且活性炭用作霉菌毒素吸附劑時,活性炭可能對油脂中其他營養物質也具有吸附作用。有研究發現[48]活性炭孔徑大于吸附質分子直徑的 1.7~3倍時,活性炭對吸附質最有利于吸附。吸附劑的分子孔內表面積要遠大于分子外表面積,這樣才能提供大量結構位點捕捉霉菌毒素。
硅鋁酸鹽類吸附劑(AS)是指含有 Al2O3和SiO2的礦物質,常見的硅鋁酸鹽礦物有蒙脫土、硅藻土、沸石、高嶺土等,硅鋁酸鹽-AFB1復合物的模型如圖 3所示,即 AFB1可能在硅鋁酸鹽層間通道內或硅鋁酸鹽顆粒的邊緣上結合。李娟娟等[49]研究了 A、B、C三種不同吸附劑(A主要成分為酵母細胞壁提取物;B主要成分為水合鋁硅酸鹽;C為A和B的復合物)對AFB1吸附能力的比較,研究發現,在不同條件下,吸附劑B的吸附能力明顯優于另外兩種吸附劑,且吸附劑B在10 min之內對AFB1的吸附率達到97.69%。水合鋁硅酸鈉鈣在歐盟國家是一種通用的霉菌毒素吸附劑。但天然鋁硅酸鹽吸附力弱、吸附效率低、脫毒的同時對營養物質也有一定吸附能力,直接用于糧油制品效果不佳。對天然鋁硅酸鹽進行改性后,可改善它對真菌毒素的選擇性吸附能力。
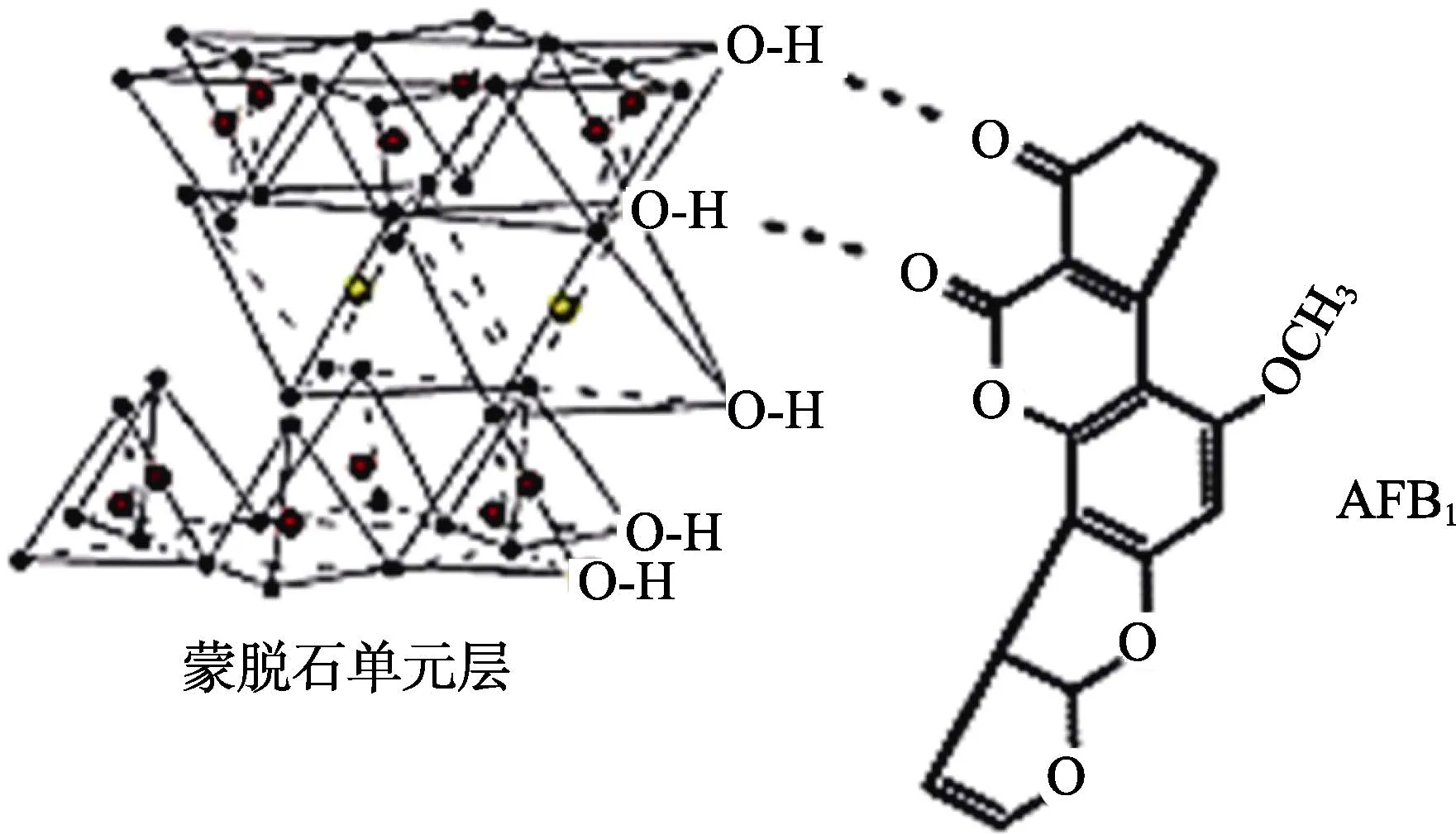
圖3 硅鋁酸鹽-AFB1復合物的模型Fig.3 Model of alumininosilicate-AFB1
蒙脫土是一種硅和鋁以1:1或2:1排列的層狀結晶的硅酸鹽土礦物,蒙脫土可分為鈣基、鈉基、鈉-鈣基等多種類型。Magnoli等[50]研究證實,AFT的吸附與蒙脫石結構及其表面靜電吸附作用有關,而與其孔徑大小無關。馬文文等[51]采用有機季銨鹽對鈉基蒙脫土迚行改性后用于花生油中AFB1的脫除,脫毒率可達84.69%。
沸石是一種含水的堿或堿土金屬硅鋁酸鹽礦物。葉盛群[52]研究發現,沸石作為菜籽油吸附脫色劑,在添加量為油重3%時,對AFB1的脫毒率達到了 75.95%,同時脫色率達到了 90.17%,但耗油率較高為20.69%。Markovic等[53]采用表面活性劑氯化十六烷吡啶來改性沸石,改性后對于ZEN的吸附從7%增加到90%左右。
Basappa等[54]向花生毛油中添加2%白土,發現黃曲霉毒素脫除率達 80%以上。Mahoney等[1]將Fuller粘土與壓濾機結合使用,可去除85%的AFT[54]。Parker和 Melnick[44]也表明使用粘土的脫色階段,花生油和玉米油的 AFT殘留濃度低于1 μg/kg。朱振海等[55]研究發現凹凸棒石粘土對菜籽油中的 AFB1具有非常好的脫除效果,凹凸棒石粘土的添加量為 1.6%時,可將菜籽油中 AFB1含量從50~200 μg/kg降低至5 μg/kg以下,添加量為3.2%時,對于含有500 μg/kg AFB1的菜籽油,也能將其降至5 μg/kg以下。
Kuk等[56]用4種脫色劑(蒙脫土、硅酸鎂、礬土、硅石)對棉籽油進行模擬處理,發現蒙脫土與硅酸鎂對 AFB1的脫除效果較礬土和硅石更好,可能的原因是 AFB1中吡咯環會與前兩種脫色劑中鎂原子結合。
葉盛群等[52]考察了活性白土、凹凸棒、沸石、活性炭和改性蒙脫石5種吸附脫色劑對菜籽油中AFB1含量及品質的影響,結果表明,在相同條件下,改性蒙脫石對AFB1的脫毒率最高(89.02%),活性白土最低(57.47%)。
Bai等[57]采用兩親分子二十二烷基二甲基溴化銨(DDAB)改性氧化石墨烯,研究了其在玉米油中對ZEN的吸附能力。在90 ℃時對ZEN的最大吸附量為23.75 mg/g,與其它碳質吸附劑相比其效果是最好的。吸附的原理主要是作為電子受體的 ZEN分子的官能團與改性后吸附劑的表面基團在體系中通過 π-π鍵結合和氫鍵作用形成電子給體。
油脂的黏度較大,吸附后小顆粒吸附劑的固液分離過程困難,因此吸附過程中容易造成中性油的大量損失,梁蘭蘭等[58]分析了磁性納米微粒選擇性吸附法的可行性,認為可將磁性納米微粒選擇性吸附法用于花生油中AFT的脫毒。利用磁性在外加磁場的作用下可以實現快速分離。本團隊合成并制備了磁性氧化石墨烯(MGO)和磁性石墨烯(MrGO),成功地用于食用油中 AFB1去除,而且MGO和MrGO在重復使用7次后,吸附活性沒有顯著降低[59]。
2.7 水蒸氣蒸餾脫臭降毒
AFT在 237~306 ℃分解,AFT熱降解受pH值和離子強度的影響,尤其取決于其中水分的含量[60]。Kamimura等[61]評估了在 240 ℃,2~5 mmHg的壓力下對經過人為污染的植物油中通入水蒸氣,進行脫臭,發現毒素濃度隨著時間的延長而降低。脫臭120 min后的脫除率為:AFB1∶86%、AFB2∶80%、AFG1∶72%、AFG2∶70%、ZEN∶7%。
2.8 膜技術
Li等[62]嘗試使用膜技術通過膜吸附器(通過在聚偏二氟乙烯微濾膜表面依次涂覆聚多巴胺(PDA)和聚乙烯亞胺(PEI)來制備膜吸附器)和生物催化膜(在制成膜吸附器的基礎上,將漆酶加載到膜上以制備生物催化膜)這兩種方案去除AFB1。結果表明膜吸附器具有更高的AFB1去除效率(71%)和滲透通量(60 L/(m2·h))。
氫鍵結合靜電吸引是膜吸附器的主要吸附機理。對于生物催化膜來說,固定化漆酶在膜中的催化反應需要足夠的動態空間和底物停留時間,因此要求濾膜孔徑適中(1 μm)。漆酶負載量的增加可以提高 AFB1的降解效率,但漆酶負載量的增加必然導致膜上有效吸附位點的減少,AFB1酶促降解的增強可能被膜上 AFB1吸附量的下降所抵消;且過多的漆酶負荷可能會增加反應的空間位阻,也會對 AFB1的去除產生負面影響。基于此,Li等[62]提出生物催化膜和膜吸附器結合用于去除液體中 AFB1的潛在應用。首先利用生物催化膜去除原料中的AFB1,在催化降解過程中,固定在膜上的漆酶會分離并釋放到被吸附液體中。一方面,釋放出的漆酶可以進一步降解AFB1;另一方面,漆酶釋放后的膜可作為膜吸附劑,通過吸附、解吸和堿降解進一步去除AFB1。
2.9 生物法
2.9.1 微生物吸附
某些菌體可以吸附真菌毒素,形成菌體-真菌毒素復合體,如Nagendra[63]發現雙歧桿菌和乳酸菌可以有效地吸附AFB1,它們能分別與AFB1反應形成穩定復合物。
2.9.2 微生物(酶制劑或生物發酵液)降解
微生物分泌的酶類型很多,對各種真菌毒素的降解方式主要有去環氧化、糖基化、去乙酰化和脫酸等。曾凡正等[64]從篩選的一種能夠固態發酵降解花生粕中 AFB1的菌種進行發酵培養,然后提取其胞內和胞外粗酶,將提取的胞內粗酶和胞外粗酶分別結合花生油脫膠工藝,發現該菌種的胞外酶比胞內酶具備更強的去除AFB1的能力。宋艷萍等[65]用吸附法將真菌粗酶分別固定在甘蔗渣、活性炭、殼聚糖三種介質上,研究其對花生油中 AFB1的去毒效果。結果表明:活性炭固定的真菌粗酶酶活力保持時間長,且有較好的去毒效果。陳本儀等[66]發現黑曲霉菌絲的提取物(BDA)對花生油AFT的降解很顯著,而不會影響油脂風味、酸價和過氧化值。微生物降解霉菌毒素的機理實質上就是在解毒酶作用下發生酶促降解,圖4為嘔吐毒素、玉米赤霉烯酮和赭曲霉毒素分別在脫環氧基酶、酯酶和黑曲酶作用下的降解產物。
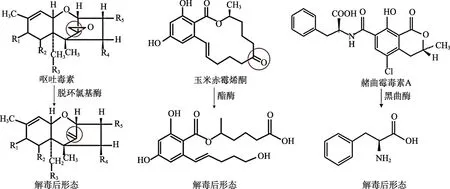
圖4 微生物降解脫毒機理Fig.4 Detoxification mechanism of microbial degradation
3 結語
綜上所述,在植物油中常見的真菌毒素有黃曲霉毒素(AFT)、玉米赤霉烯酮(ZEN)、嘔吐毒素(DON)、赭曲霉毒素 A(OTA)、T-2毒素(T-2)和伏馬毒素(FUM),其中AFT毒性最強、分布最廣。在食用植物油的脫毒方法中,離心、過濾最簡便,但是脫毒效果不太好;光催化降解的解毒率可達99%以上,但是可能發生逆反應重新生成毒素;生物法由于成本高,且酶具有專一性、酶易失活、反應條件較苛刻,在工業中的應用具有一定的局限性;堿處理和吸附法是目前最常用的脫毒方法,堿處理可能重新產生毒素;吸附法操作簡單,尤其是對于香型油脂(如濃香花生油、芝麻香油、濃香菜籽油等)不能進行堿煉,因此吸附法降解 AFT是目前對各種風味植物油AFT處理工藝中最好的方法;除此之外,植物油中的脫毒方法還有醇提、堿性電離水、脫臭降毒和膜技術。目前所用的各種脫毒方法都不太完善,希望本文可以對未來的研究提供一些參考。

