健康與患病大黃魚消化道微生物結構特征分析?
姜 燕, 于超勇, 徐永江, 柳學周??, 鄭煒強, 陳 佳, 劉 瑩, 王 濱, 史 寶
(1. 大黃魚育種國家重點實驗室 寧德市富發水產有限公司, 福建 寧德 352103;2. 中國水產科學研究院黃海水產研究所 青島海洋科學與技術試點國家實驗室海洋漁業科學與食物產出過程功能實驗室, 山東 青島 266071;3. 山東省海洋生物研究院, 山東 青島 266104)
大黃魚(Larimichthyscrocea)是中國主要經濟魚類之一,其繁育和養殖技術處于世界領先地位,在中國福建、浙江、廣東等沿海省份均有養殖,其中,福建省養殖規模相對較大,2017年產量占全國大黃魚總產量的84.75%,高達150 542 t,比2016年增長4 028 t[1-2]。養殖規模不斷擴大的同時,環境脅迫、養殖管理不規范等各種問題不斷涌現,導致大黃魚養殖病害頻發,嚴重限制產業的健康、持續發展。據統計,大黃魚病害種類達30余種,細菌性疾病占據80%以上,并且,弧菌是大黃魚潰瘍病和腸炎病的主要病原,可以說,弧菌病是危害最為嚴重的細菌性疾病之一[3]。
腸道中居住著大量微生物,其攜帶的基因被稱為機體的第二套基因組,能夠編碼合成多種消化酶參與消化道內營養物質的降解,并且,腸道微生物能夠通過營養競爭、粘附位點競爭和產物抑制等方式阻止外源微生物在腸道中的定植[4-6]。可以說,腸道微生物對宿主的營養、免疫方面均發揮重要作用。同時,宿主生理階段和環境因子等能夠不同程度的影響腸道微生物群組成與分布[7-12]。因此,養殖密度、溫度等環境因子的脅迫極易打破魚類腸道微生物群的平衡狀態,從而導致各種疾病的爆發,造成經濟損失。
本文作者在大黃魚室內工廠化養殖過程中,發現個別養殖池內的大黃魚出現游動緩慢和死亡現象,即刻隨機撈取幾尾瀕臨死亡的患病魚觀察,發現其消化道內無食糜,腸道積存大量淺黃色黏液,類似腸炎的癥狀。為認知大黃魚消化道微生物群結構與病害發生的關聯性,本研究以患病魚為對象,比較分析其消化道微生物群結構特征與健康魚體的差異,及其與環境菌群結構的聯系,明確主要致病菌,以期為大黃魚養殖過程中消化道生理健康判別及益生菌有效調控提供參考資料。
1 材料與方法
1.1 樣本采集與處理
試驗所采集大黃魚均來自于寧德富發水產有限公司的工廠化養殖池中,由同批受精卵孵化而來,養殖密度為60尾·m-3,水溫為13~16 ℃,體重為90~110 g。上午投喂前采集各樣本,患病大黃魚從發病池中隨機采集游動活力極弱的6尾作為平行樣本;從未出現任何病癥且魚體游動力較強的養殖池中隨機選擇一個作為健康魚樣本采集池,從中隨機撈取6尾作為平行樣本。
消化道樣本:健康組的試驗魚經MS-222 (Fluka, USA)麻醉后,同患病組試驗魚在無菌環境下采用75%酒精擦拭體表進行解剖,分別剪取大黃魚消化道各組織(胃、幽門盲囊、腸道),去除各組織周圍的脂肪等組織并擠去剩余的內容物,采用預冷的生理鹽水沖洗各組織,分裝后保存于液氮中備用。
水環境樣本:同一養殖車間的進水口相同,因此,對進水口的水樣采集 3次作為平行樣本,每次3 L,現場經0.22 μm的濾膜真空抽濾,濾膜分裝后液氮中保存,用于養殖用水微生物分析。
飼料樣本:試驗魚的規格相同,所用配合飼料也完全相同。分別稱取3份0.1 g的配合飼料作為3個平行樣本于液氮中保存備用。
1.2 微生物總DNA提取與高通量測序
將液氮保存的各試驗樣本分別取出,液氮研磨,消化道、飼料樣本通過QIAamp DNA mini kit (QIAGEN, Germany)試劑盒提取微生物總DNA;采用OMEGA Soil DNA kit (Omega Bio-Tek, USA)試劑盒提取水體微生物總DNA。共計提取24個生物樣本(見表1)的微生物總DNA,用于后續的微生物結構與功能分析。提取的DNA通過濃度和純度檢測后,采用PCR技術擴增16s rDNA V3~V4高變區的序列,擴增所用引物為338F (5’-ACTCCTACGGGAGGCAGCA-3’)和806R (5’-GGACTACHVGGGTWTCTAAT-3’),擴增產物經瓊脂糖凝膠電泳檢測合格后構建文庫,采用Illumina MiSeq PE300平臺進行高通量測序。
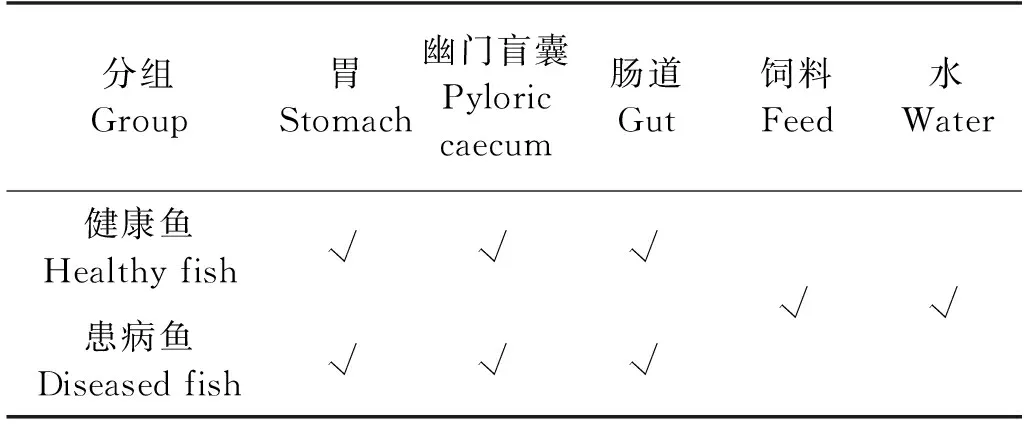
表1 高通量測序生物樣本信息
1.3 數據處理
將測序所得的原始數據通過Trimmomatic (v 0.35)、Flash (v 1.2.11)、Uchime (v 4.2)等軟件進行一系列的去雜、拼接、去嵌合體等處理得到有效序列。依據序列相似度≥97%的歸為1個可操作分類單元(Operational Taconomic Unit, OTU)的原則對有效序列進行歸類操作,選取各OTU的代表性序列,采用Silva數據庫(v 123)對OTUs代表序列進行物種注釋,保留置信區間大于0.7的注釋結果。采用tax4fun (0.3.1)對微生物組基因參與的KEGG通路進行比對分析。
采用單因素方差分析(One-way ANOVA)方法對結果數據進行統計分析,利用Duncan’s檢驗對同一處理組大黃魚不同消化道組織間的差異性進行多重比較,采用T-test檢驗對不同健康狀態大黃魚相同消化道組織間進行差異性分析,顯著性水平為P<0.05。所有數值均采用平均值±標準誤(Means±SE)表示。
2 結果
2.1 大黃魚消化道微生物多樣性
采集的24個生物樣本經高通量測序和數據處理,共得到814 494條有效序列,歸類分析后共得到2 239個OTUs。
在健康大黃魚消化道中,從胃到幽門盲囊直至腸道,其中的微生物群Chao1指數由812.01下降至311.22;香農指數同樣呈現逐漸下降趨勢,由胃部的7.32下降至6.23,胃中微生物群的多樣性均顯著高于幽門盲囊和腸道中的(P<0.05),但幽門盲囊和腸道中的多樣性指數差異不顯著(P>0.05) (見表2)。
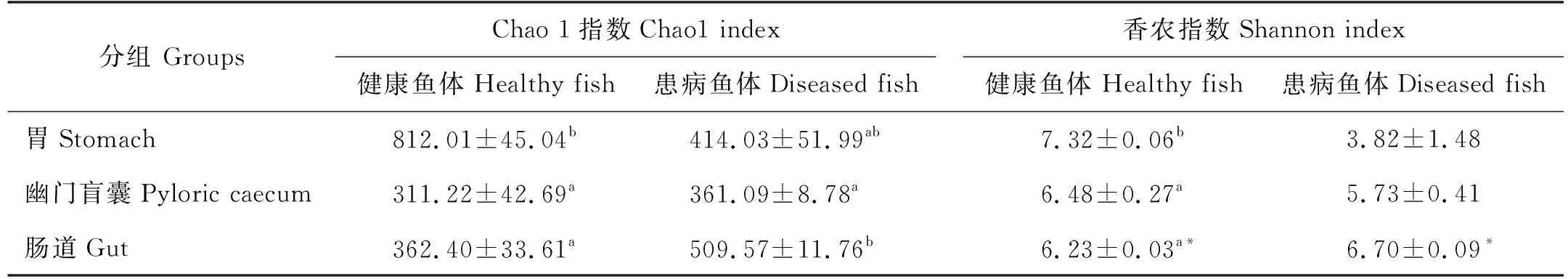
表2 兩種健康狀況大黃魚消化道菌群多樣性
患病大黃魚消化道中微生物群多樣性發生變化,Chao1指數呈現先下降后上升趨勢,在腸道中表現出最高值(509.57),顯著高于幽門盲囊中的(P<0.05);香農指數則逐漸升高,但是差異均不顯著(P>0.05)。
健康大黃魚胃中的多樣性指數高于病魚,但腸道中的香農指數則顯著低于病魚的(P>0.05)。
2.2 大黃魚消化道微生物群結構特征
圖1A顯示了兩種健康狀況大黃魚消化道微生物群門水平分布信息,在健康大黃魚消化道中,從胃到幽門盲囊和腸道,厚壁菌門(Firmicutes)豐度(31.59%~34.84%)波動不明顯,擬桿菌門(Bacteroidetes)(13.40%~39.88%)則呈現下降趨勢,而變形菌門(Proteobacteria)(21.34%~42.92%)則迅速上升并成為最優勢菌門。在患病大黃魚胃部,變形菌門優勢地位明顯(74.84%),而在幽門盲囊和腸道中則下降至46.72%~51.49%;擬桿菌門相對豐度變化較小;厚壁菌門的豐度則由胃中的5.60%到幽門盲囊和腸道中上升至24.95%~27.62%。
變形菌門、擬桿菌門和厚壁菌門為兩種健康狀況大黃魚相對豐度較高的物種,三者的豐度之和為85.03%~94.58%,并且幽門盲囊和腸道中的優勢菌群組成較為相近(見圖1A)。其中,厚壁菌門和擬桿菌門在健康大黃魚胃中的相對豐度顯著高于病魚的(P<0.05),變形菌門豐度則顯著低于病魚的(P<0.05);厚壁菌門和酸桿菌門(Acidobacteria)在健康大黃魚腸道中的豐度顯著高于病魚的(P<0.05),而變形菌門、疣微菌門(Verrucomicrobia)、芽單胞菌門(Gemmatimona-detes)和酸桿菌門的豐度則顯著低于病魚的(P<0.05) (見圖1B)。
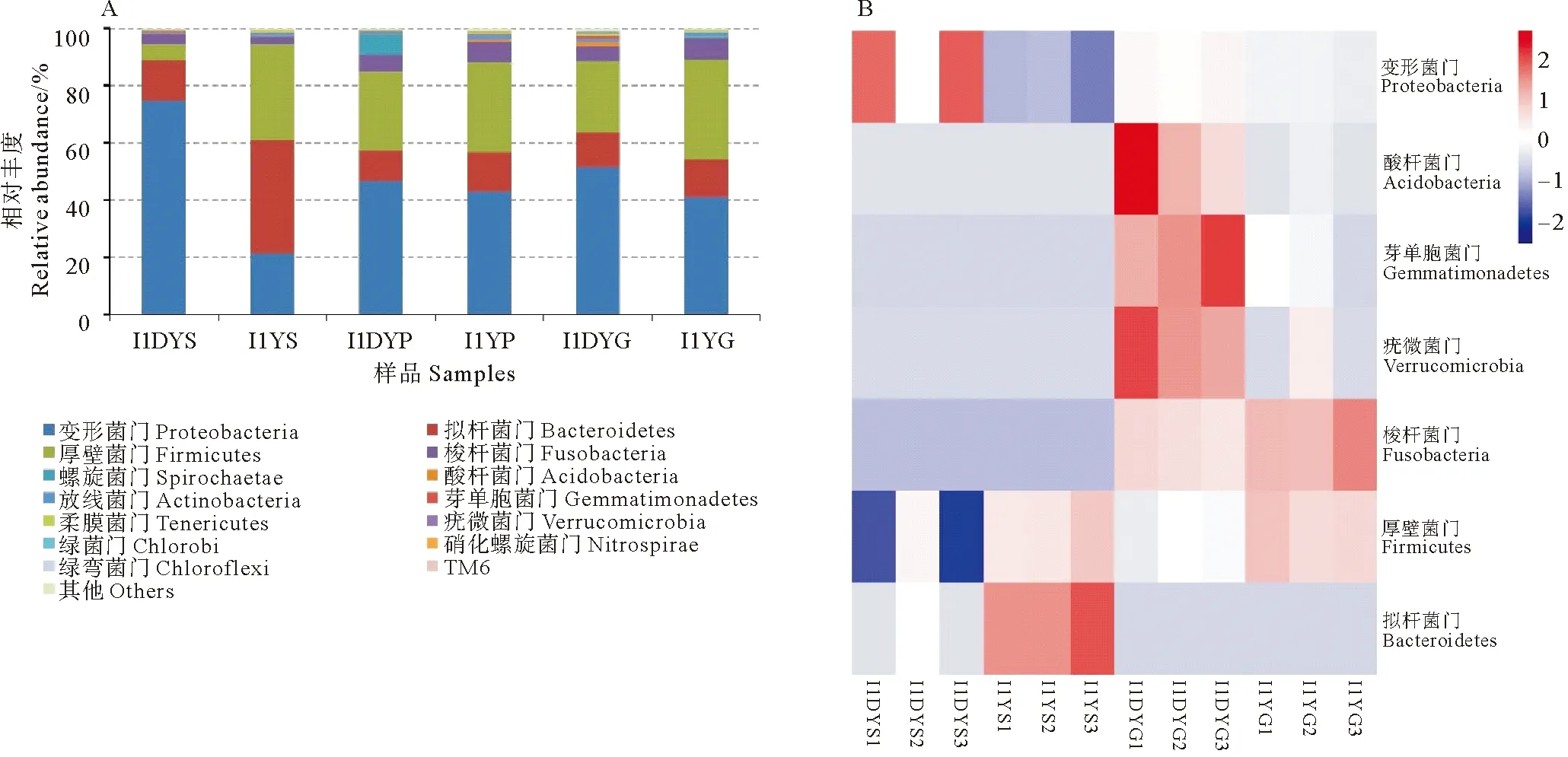
(A:各部位優勢菌群組成特征;B:健康和患病魚消化道差異菌群特征;I1YS、I1YP、I1YG分別表示健康大黃魚胃、幽門盲囊、腸道樣本;I1DYS、I1DYP、I1DYG分別表示患病大黃魚胃、幽門盲囊、腸道樣本;其中,I1YS1、I1YS2、I1YS3、……、I1DYG2和I1DYG3分別表示I1YS、I1YP、……、I1DYG的平行樣本。下同。A represents the composition of dominant microbiota of gastrointestinal tract; B represents the composition of gastrointestinal microbiota with significant differences between healthy and diseased large yellow croaker; I1YS, I1YP and I1YG represent stomach, pyloric caecum and gut of healthy large yellow croaker, while I1DYS, I1DYP and I1DYG represent those of diseased large yellow croaker; I1YS1, I1YS2, I1YS3, ……, I1DYG2 and I1DYG3 represent the parallel samples of I1YS, I1YP, ……, I1DYP and I1DYG. The same as below.)
圖2A顯示了每個樣本中相對豐度排列前十的菌屬,可以看出,在健康大黃魚胃中擬桿菌屬(Bacteroides)的相對豐度最高(23.70%),到幽門盲囊和腸道下降至1.16%~1.32%;幽門盲囊和腸道中的乳桿菌屬(Lactobacillus)的相對豐度由胃中的5.84%上升至15.75%~17.04%。在患病大黃魚胃中,Aliivibrio的相對豐度最高(33.68%),弧菌屬(Vibrio)的豐度(20.21%)次之,隨著消化道的延伸豐度分別下降至5.98%和3.69%;乳桿菌屬的豐度在胃中為6.72%,到幽門盲囊和腸道中則上升至11.99%~12.51%。
圖2B顯示了兩種健康狀況大黃魚消化道各部分差異均屬的組成情況,可以看出,健康魚胃中Alii-vibrio的相對豐度顯著低于病魚(P<0.05),擬桿菌屬、普氏菌屬(Prevotella)、Parabacteroides、Blautia和Faecalibacterium等的相對豐度則顯著低于病魚胃中的(P<0.05);健康魚幽門盲囊中,僅Aliivibrio的相對豐度顯著低于病魚的 (P<0.05);健康魚腸道中,Aliivibrio和鞘氨醇單胞菌屬(Sphingomonas)的相對豐度顯著低于病魚的(P<0.05),而乳桿菌屬、芽孢桿菌屬(Bacillus)、擬桿菌屬等的相對豐度則顯著高于病魚的(P<0.05)。
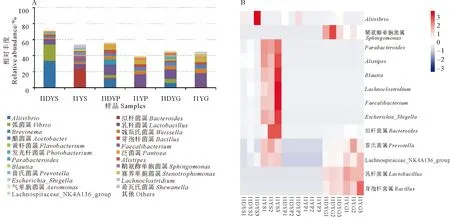
(A:各部位優勢菌群分布特征;B:健康與患病魚體消化道差異菌群特征。A represents the distribution of dominant microbiota of gastrointestinal tract; B represents the composition of gastrointestinal microbiota with significant differences between healthy and diseased large yellow croaker.)
2.3 大黃魚消化道微生物群功能特征
大黃魚消化道各部分微生物參與KEGG通路的基因數目分布情況基本相近,主要集中于新陳代謝和環境信息處理中(見圖3)。其中,在二級水平下,兩種健康狀況大黃魚胃中的微生物參與神經系統、免疫系統、循環系統方面基因數目差異顯著(P<0.05);在幽門盲囊中,參與異源物質生物降解于代謝、萜類和聚酮化合物代謝、脂類代謝、其他次級代謝物生物合成通路的基因數目差異顯著(P<0.05);腸道中,則參與核苷酸代謝和膜轉運通路等的基因數目差異顯著(P<0.05)。
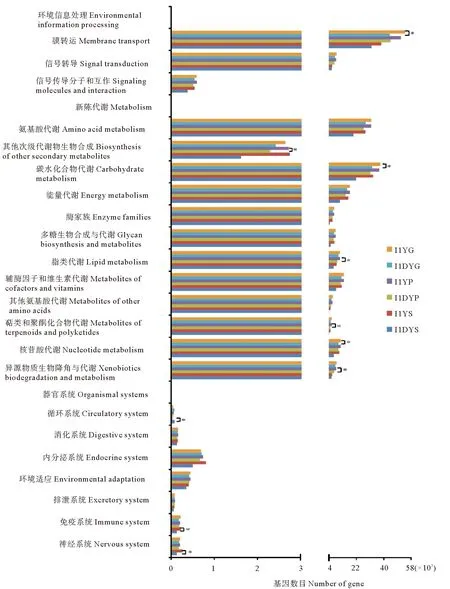
(*:差異顯著。*:Represents significant difference.)
2.4 大黃魚消化道微生物與環境微生物的相似性
分別對兩種健康狀況大黃魚消化道各部分與環境樣品進行主成分分析(Principal components analysis, PCA),從圖4中可以看出,健康大黃魚胃、幽門盲囊和腸道樣品分別相對比較聚集,與病魚消化道各部分之間形成一定的距離,說明病魚消化道各部分中的微生物組成與健康個體消化道各部分的微生物組成存在一定的差異。結合PC1和PC2的貢獻率,可以得出,兩種大黃魚消化道各部分與飼料樣品間的距離相對較近,說明消化道微生物組成與飼料微生物組成相近。
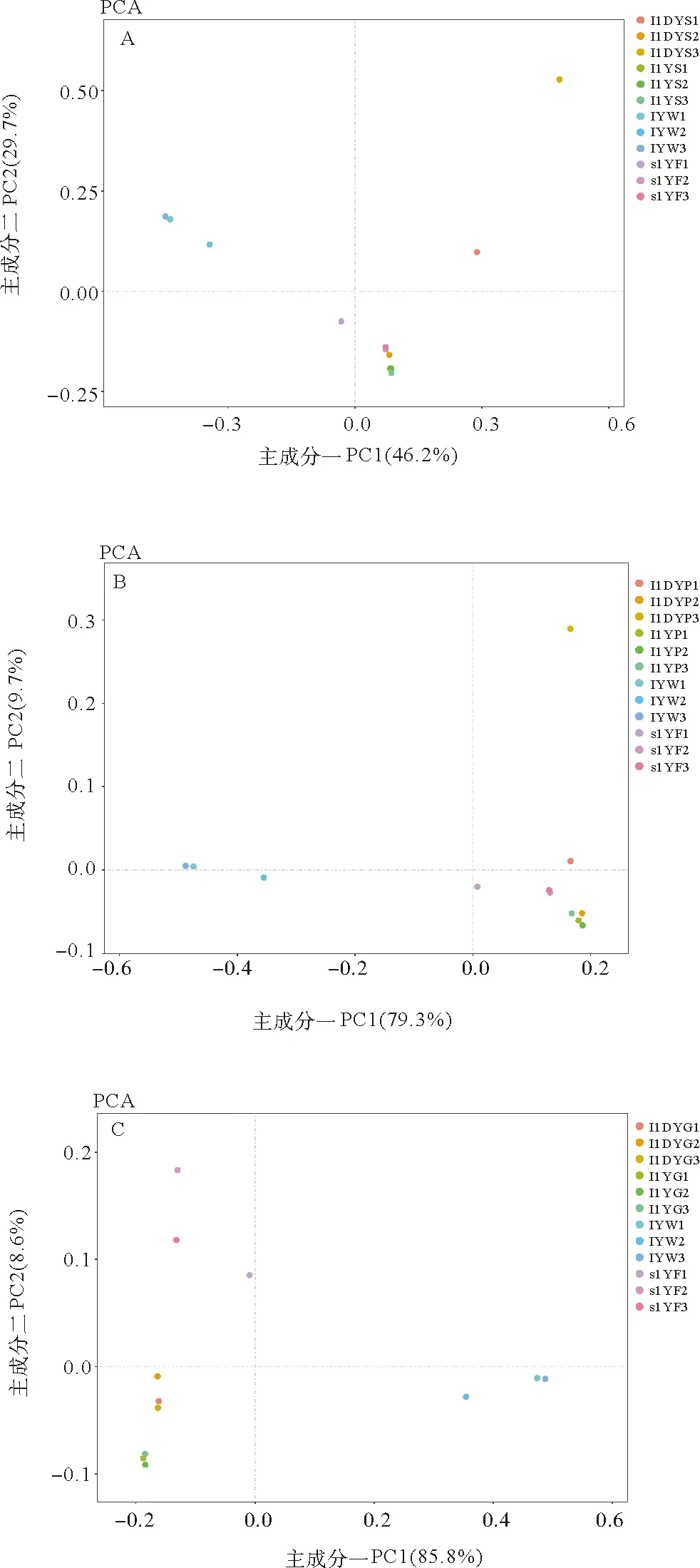
(A:大黃魚胃部菌群與環境菌群;B:大黃魚幽門盲囊菌群與環境菌群;C:大黃魚腸道菌群與環境菌群。IYW1、IYW2、……、s1YF3分別表示水環境樣本、飼料樣本的三個平行樣本。A: represents microbiota in large yellow croaker stomach and environment; B: represents microbiota in large yellow croaker pyloric caecum and environment; C: represents microbiota in large yellow croaker gut and environment. IYW1, ITW2, ……, s1YF3 represent parallel samples of water and feed.)
2.5 大黃魚消化道主要微生物群在各樣品中分布特征
大黃魚胃、幽門盲囊和腸道中相對豐度高于5%的微生物群在生物樣本中的分布特征如圖5所示,在健康魚消化道中Aliivibrio的相對豐度分別為0.020%、0.001%、0.005%,病魚消化道Aliivibrio的相對豐度則是健康魚的1 702.83~10 957.55倍,弧菌屬的相對豐度是健康魚的19.10~66.10倍;而健康魚胃中擬桿菌屬的豐度則是病魚胃中的80.59倍。這些主要菌屬在大黃魚攝食飼料中的相對豐度均高于水環境中的,其中,乳桿菌屬在飼料中的豐度(8.02%)相對較高,但僅為水環境中6.72倍;飼料中弧菌屬的豐度雖然僅為1.19%,但卻是水環境中的78.02倍。
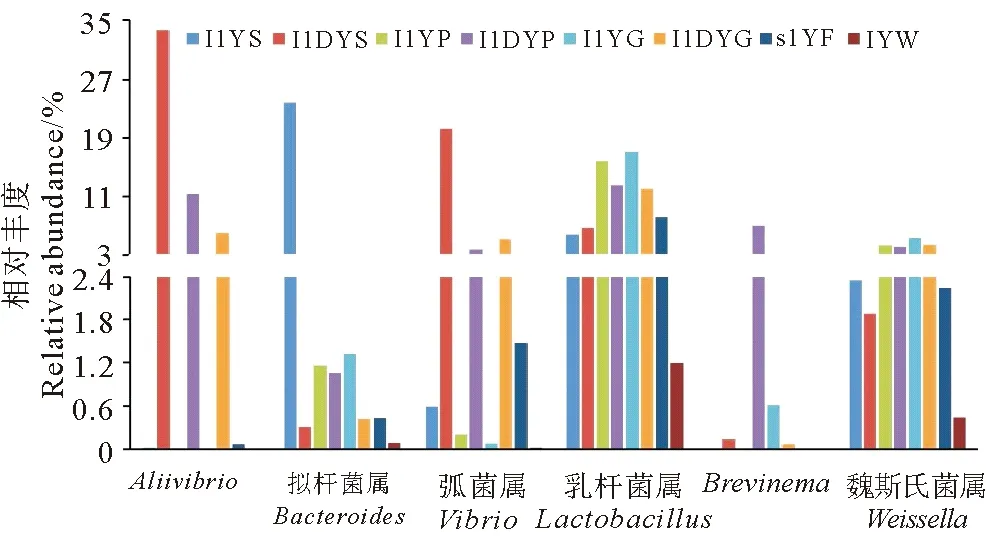
圖5 大黃魚主要微生物在消化道各部位和環境樣品中的分布
3 討論
3.1 患病對消化道菌群結構的影響
在健康大黃魚消化道/腸道中,變形菌門、厚壁菌門和擬桿菌門為主要的優勢物種[13]。本研究中,兩種健康狀態大黃魚消化道中主要優勢菌門依然為變形菌門、厚壁菌門和擬桿菌門,但是其相對豐度存在顯著性差異,說明這些菌門始終存在于大黃魚消化道中,并且伴隨著發病的過程其結構也發生了較大的改變[14]。擬桿菌屬、乳桿菌屬、Aliivibrio和弧菌屬為主要的優勢菌屬,其中,Aliivibrio在病魚整個消化道中的豐度顯著高于健康魚消化道中的,且差異懸殊;弧菌屬在病魚整個消化道中的豐度與健康魚中的相比,雖然差異不顯著,但也是健康魚中的19.10~66.10倍;并且Alii-vibrio和弧菌屬在病魚胃中的豐度均最高,隨著消化道的延伸,二者的豐度均呈現下降趨勢,在幽門盲囊和腸道中失去最優勢地位。推測Aliivibrio和弧菌屬是本研究中大黃魚的主要病原菌,在消化道中從胃部開始逐漸向下游感染,并引起疾病爆發。Aliivibrio和弧菌屬的豐度在胃中急劇上升可能也是導致病魚胃中微生物多樣性下降的一個主要原因。Aliivibrio和弧菌屬在健康魚消化道中也存在[12,15-16],但是豐度均較低,說明二者的豐度均在健康范圍內。
擬桿菌屬在健康魚胃中的豐度是病魚胃中的81倍,推測Aliivibrio和弧菌屬豐度的迅速上升突破了擬桿菌屬的屏障作用,持續侵入到幽門盲囊和腸道,并降低了幽門盲囊和腸道中的乳桿菌屬的豐度,同時有助于Brevinema的快速生長繁殖,也彰顯了擬桿菌屬和乳桿菌屬在維持消化道微生物群平衡中的重要作用。有研究顯示,通過實時熒光定量PCR法將結直腸癌、潰瘍性腸炎患者糞便中的部分菌群數量同健康人群的進行對比分析,發現疾病的發生可能與菌群失衡有關[17-18],說明維持消化道菌群的平衡狀態至關重要。
弧菌是弧菌病的主要病原菌,而且弧菌病也是大黃魚細菌性疾病中危害最嚴重的疾病之一,溶藻弧菌(V.algiolyticus)、哈維弧菌(V.harveyi)和副溶血弧菌(V.parahaemolyticus)是具有代表性的3株病原菌[3,19-20]。Urbanczyk等[21]將V.fischeri,V.logei,V.salmonicida和V.wodanis4株菌同弧菌科其他物種進行系統發育和表型差異性分析,提出將這4株菌歸為一個新的屬-Aliivibrio,由此Aliivibrio包含了A.fischeri、A.salmonicida、A.wodanis和A.logei4株菌。之后,通過實驗研究又分離出A.finisterrensis[22]、A.sifiae[23]等,使Aliivibrio屬的細菌種類不斷增多。在大西洋鮭(Salmosalar)、虹鱒魚(Oncorhynchusmykiss)等研究中發現Aliivibrio(以前為Vibrio)是弧菌病的主要病原菌[24-25]。從本研究角度推斷,Aliivibrio是本次大黃魚發病的主要病原菌。
另外,在對消化酶分布與活性的研究中發現,大菱鲆對蛋白質的消化主要集中在胃和腸道中,對淀粉的消化則主要依靠幽門盲囊和腸道,對脂肪的消化主要集中在腸道中[26]。消化酶活性的不同將導致消化道各部位食糜的營養水平的差異,而營養水平的不同將顯著影響定植菌群的組成結構[27]。因此,本研究中,通過對健康大黃魚消化道微生物群門和屬水平的組成結構分析發現,幽門盲囊和腸道中優勢菌群的種類和相對豐度相近,二者與胃中的存在一定差異。
但是,由于受測序片段長度的限制,高通量測序技術不能鑒定到消化道菌群的具體菌種;同時,本研究由于受當時條件限制未及時將消化道菌群進行分離培養,不能對疑似病原菌進行種類的鑒定,今后應該結合對消化道的疑似致病菌進行分離、培養、生理生化特征分析等研究,通過雙向判斷得出具體病原菌種類,可能更為準確。
3.2 患病對消化道菌群功能的影響
消化道作為營養消化吸收的主要場所,其內部定植著數以萬億計的微生物,其攜帶的基因數量龐大[28],被稱為機體的第二套基因組,參與宿主營養、免疫等多方面的生理功能[29-32]。目前,關于消化道菌群功能方面的前沿性研究主要集中在人和畜牧動物方面,由于受養殖環境、養殖動物自身等方面的影響,有關水產動物消化道功能方面的研究相對較少。研究發現,反芻動物能量的吸收依賴于腸道菌群[9],且在極端環境下,腸道菌群能通過調整自身結構以協同宿主更好的獲取能量適應極端環境[10]。但是,當環境因子脅迫超過一定界限時,魚體消化道微生物群平衡狀態極易被打破,微生物群基因富集的代謝通路情況也隨之改變,從而通過某一表型體現出來。本研究中,與健康魚相比,病魚消化道菌群結構發生了顯著的變化,其菌群基因富集的代謝通路也發生了較大改變,其中消化道菌群參與的大部分代謝通路的基因數目明顯低于健康魚的,可能受Aliivibrio和弧菌屬豐度大幅增加的影響比較明顯。也反映了微生物群結構與功能的統一。
3.3 大黃魚消化道菌群與環境菌群關系分析
水產養殖動物由于特殊的生活環境,外源微生物主要以水和飼料為載體對其進行生理影響。本研究中,飼料菌群對大黃魚消化道這些主要微生物群的貢獻相對較大,這與不同模式養殖大黃魚[6,15]、早期發育階段的牙鲆[12]和許氏平鲉[33]等研究結果相似。然而,本研究中的健康和患病大黃魚攝食飼料完全相同,說明大黃魚之所以出現消化道微生物群結構明顯改變,可能是由于環境微生物群效應長期累積的結果,也有可能是溫度、壓力或外源物質介入等環境因子突變打破消化道菌群動態平衡狀態[11],致使免疫水平較低的魚體發生病變。尤其是在苗種繁育時期,仔稚魚免疫器官發育不完全,免疫水平低下,極易受到病原微生物的侵染,一旦爆發疾病,將嚴重影響下游產業鏈的可持續發展。可見,保證養殖魚類生長發育過程中良好的環境和飼料微生物衛生質量是綠色、安全養殖的關鍵措施之一。
4 結語
本研究條件下,與健康大黃魚相比,病魚消化道微生物群結構發生明顯改變;推斷Aliivibrio和弧菌屬為主要病原菌,由胃部逐漸向幽門盲囊和腸道侵染并引發疾病。規模化養殖過程中,除了要有規范的操作技術外,養殖環境的微生物衛生質量也不容忽視。

