光學相干斷層掃描成像對急性中心性漿液性脈絡膜視網膜病變滲漏點的前瞻性觀察研究
吉宇瑩,張雄澤,李妙玲,甘雨虹,蘇永悅,米蘭,文峰
(中山大學中山眼科中心眼底內科,眼科學國家重點實驗室,廣州 510060)
中心性漿液性脈絡膜視網膜病變(central serous chorioretinopathy,CSC)是一種常見的眼底疾病[1],特征是漿液性視網膜脫離(serous retinal detachment,SRD),眼底熒光血管造影(fundus fluorescein angiography,FFA)顯示存在視網膜色素上皮(retinal pigment epithelium,RPE)滲漏[2-3]。既往研究[4-5]已觀察到CSC在光學相干斷層掃描(optical coherence tomography,OCT)上的特征,視網膜色素上皮脫離(pigment epithelium detachment,PED)是滲漏部位的常見表現[6],同時CSC患者的脈絡膜厚度和Haller層厚度增加[7-8]。但是到目前為止,很少有研究調查急性CSC滲漏點處PED形態和脈絡膜厚度隨著自然病程的演變過程。本研究使用頻域OCT(spectral domain,SD-OCT)觀察在自然病程狀態下,急性CSC滲漏點處脈絡膜和RPE的形態和厚度的情況,以期加深對急性CSC的發病機制的理解。
1 對象與方法
1.1 對象
本研究得到中山大學中山眼科中心醫學倫理委員會的批準,符合赫爾辛基宣言。受試者均簽署了書面知情同意書。
納入標準:首次在門診就診時被診斷為急性CSC的患者。急性CSC的診斷標準:局灶性漿液性視網膜脫離,累及黃斑,FFA可見1個滲漏點。FFA檢查方法:使用Carl Zeiss FFA 450 plus(FFA 450plus,Zeiss,德國)或Heidelberg HRA OCT Spectralis (Heidelberg Engineering Inc,德國)進行標準的眼底FFA檢查。
排除標準:患有角膜疾病、白內障、青光眼以及其他眼底疾病的患者,例如孔源性視網膜脫離、脈絡膜新生血管、息肉樣脈絡膜血管病變、視網膜靜脈阻塞、糖尿病視網膜病變、Vogt小柳原田綜合征、視盤小凹、鞏膜炎;1個月內有創傷史或手術的患者。
1.2 方法
1.2.1 治療及隨訪方法
在患者確診急性CSC后,采用修正危險因素和隨訪觀察的治療方法。隨訪時間為2~4周。每次訪視時都要進行眼底檢查,測量最佳矯正視力和SDOCT成像。如果隨訪時間至發病3個月后視網膜下液仍然存在,則建議患者接受其他治療,例如激光治療。如果視網膜下液完全吸收,則每2個月對患者進行1次隨訪,將至少參加了1次隨訪的患者納入研究。
1.2.2 檢查方法及定義
SD-OCT 的采集使用Heidelberg HRA OCT Spectralis機器進行。采集方法是通過中心凹及滲漏點處的水平和垂直線掃描,并且在增強深度成像(enhanced depth imaging,EDI)模式下將自動實時圖像平均設置為100張圖像。
脈絡膜厚度定義為從高反射R P E 的外邊緣到脈絡膜-鞏膜界面的最內高反射線的垂直距離(圖1)。在測量脈絡膜總厚度的位置處,識別出大于100 m m 的脈絡膜大血管[7]。然后,從脈絡膜大血管的最內點繪制1 條水平線(圖1)。Haller 層的厚度定義為從水平線到脈絡膜-鞏膜界面最內的高反射線的距離[9-10]。兩位研究者分別獨立在中央凹處和泄漏點進行測量并記錄。然后根據測量結果計算Haller 層與脈絡膜總厚度之比。
1.3 統計學處理
使用SPSS 19.0統計學軟件進行數據分析。使用t檢驗比較中央凹和滲漏點處Hal ler層與總脈絡膜厚度比的差異。P<0.05為差異有統計學意義。
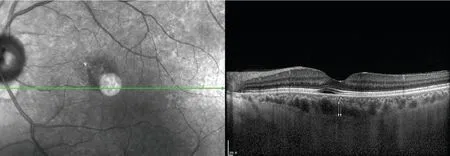
圖1 脈絡膜厚度和Haller層厚度的測量Figure 1 Measurement on choroidal thickness and Haller layer thickness
2 結果
本研究共納入20 例患者,其中男14 例,女6例,年齡33~59(中位數41)歲。14例出現墨漬樣滲漏,6例出現炊煙樣滲漏。大多數患者(19/20)在滲漏點處OCT可見到小的PED,其中2例患者可見PED內RPE層的微小缺陷。1例患者滲漏點處可見RPE小凸起。
患者的恢復時間為20 d~3個月(中位數55 d)。隨訪時間為5~13個月。在最后1次就診時,只有1例患者在泄漏點顯示RPE完全恢復(圖2)。在其他19名患者中,RPE和Bruch膜均存在不同程度的分離(圖3~4)。
在滲漏點處,可以看到脈絡膜大血管擴張,脈絡膜毛細血管和Sattler血管變薄。首次隨訪時,中心凹下脈絡膜厚度為(420.40±114.19) μm,最后1次隨訪時為(413.70±115.76) μm。首次隨訪時平均滲漏點處脈絡膜厚度為(406.50±103.55) μm,最后1次隨訪時為(415.80±102.67) μm。首次隨訪時,中央凹下Haller層的厚度為(339.85±110.03) μm,最后1次隨訪時為(332.15±98.28) μm。首次隨訪時,滲漏點Haller層厚度為(353.05±100.08) μm,在最后1次隨訪時為(355.55±96.02) μm。根據隨訪時間的不同,分為隨訪時間5~8個月組、9~13個月組。隨訪時間5~8 個月組的中心凹下脈絡膜厚度為(413.20±145.11) μm,滲漏點處的脈絡膜厚度為(448.00±135.99) μm,隨訪9~13個月組的評價中心凹下脈絡膜厚度為(413.87±110.31) μm,滲漏點處脈絡膜厚度為(405.07±92.35) μm,無論在初次就診時還是在不同的隨訪時間段,滲漏點處的Haller 層與脈絡膜總厚度比值均明顯高于中央凹處的比值,差異均有統計學意義(0.863±0.060 vs 0.806±0.080,P=0.003;0.890±0.060 vs 0.851±0.093,P=0.014;0.838±0.064 vs 0.785±0.064,P=0.039;0.851±0.060 vs 0.801±0.070,P=0.004;表1)。
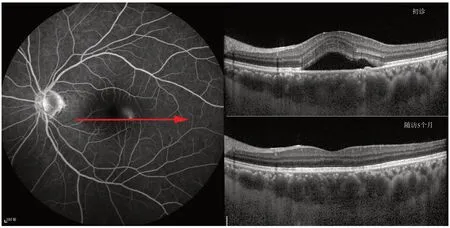
圖2 滲漏點PED完全恢復Figure 2 Complete recovery of pigment epithelial detachments at the leakage point
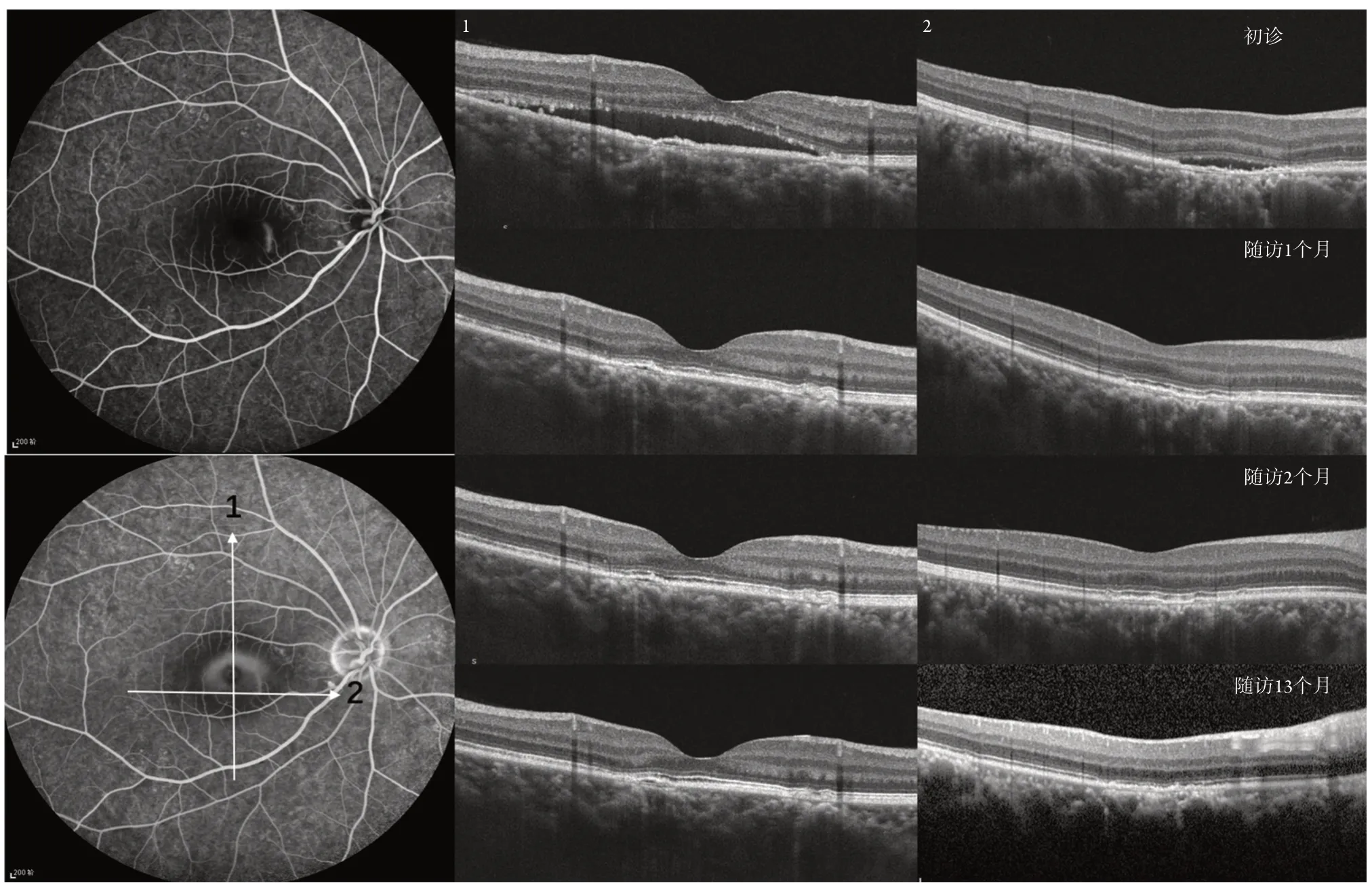
圖3 滲漏點處的PED在13個月的隨訪時間內持續存在Figure 3 PED at the leak point persisted during the 13-month follow-up time

圖4 滲漏點處的PED在9個月的隨訪時間內持續存在Figure 4 PED at the leak point persisted during the 9-month follow-up time
3 討論
本研究在對急性CSC進行了5~13個月的隨訪時,觀察到滲漏點處Haller層更加增厚,脈絡膜內層更薄,滲漏點處的小PED可長期持續存在,即使在視網膜下液吸收后,PED也無法完全恢復正常。
確切的CSC病理生理機制仍在探索中[1,3]。脈絡膜大血管擴張及通透性增強被認為是CSC的始發因素[1]。目前認為CSC是肥厚脈絡膜疾病譜的一種[11-12]。Branchini等[10]分析了正常人的脈絡膜厚度,發現在中央凹下的脈絡膜血管層厚度與總脈絡膜厚度之比約為0.70。在Chung等[7]的研究中,CSC患者的Haller層厚度與總厚度之比為0.78,遠高于正常對照組的0.71。本研究與既往研究的發現相符;同時在前期研究基礎上,我們還發現無論是在疾病發病時還是恢復時,滲漏點處Haller層厚度與脈絡膜總厚度之比明顯高于中央凹處的比值。此外,RPE功能障礙在CSC的發病機制中也起重要作用。滲漏點在OCT上可以顯示為PED,RPE突出或RPE的小凸起,PED內RPE層的微小斷裂缺陷[13-15],本研究結果與之一致。結合以上兩點可以推測:在滲漏點處,Haller層的擴張程度更明顯,脈絡膜毛細血管層及 Sattler層更薄,會在該部位產生更高的壓力,在某些誘因下,RPE出現撕裂或者脫離,液體流入視網膜下區域引起發病。
此外,本研究還有一個重要發現,即滲漏點處的PED可長期持續存在。既往有部分研究觀察了急性CSC滲漏點的形態變化。Fujimoto等[13]使用傅里葉域OCT系統(RTVue-100,Optovue)觀察了21位急性CSC患者的23個滲漏點,平均隨訪時間108 d,結果顯示:在用激光治療14個滲漏點后,所有患眼的視網膜下液均達到完全消退,5個滲漏點仍有PED存在。Gupta等[15]使用Zeiss Cirrus HD-OCT 4000,在13例急性CSC患者的11只眼的滲漏點發現了PED,到6個月隨訪結束時,PED仍然存在于3只患眼中,3只患眼中PED減小,5只患眼中PED消失。與上述研究相比,本研究中PED的完全消退比例要低得多。分析其原因如下:首先,Fujimoto等[13]對患者進行了滲漏點的激光光凝治療,而本研究觀察的是CSC的自然病程;其次,使用機器的分辨率及掃描方式不同。Gupta等[15]雖沒有進行激光治療,但是他的采集方式是Cirrus HD-OCT 4000的5行光柵掃描,Macular cube 200X 200和Macular cube 512 X128組合,清晰度與筆者團隊采取的Heidelberg的單線疊加掃描有所差別。
維持RPE和Br uch膜間的正常黏附力尚不清楚。在正常條件下,從玻璃體向脈絡膜存在液體流動,其產生取決于靜水壓和滲透壓。RPE和視網膜都會對此流體產生阻力。RPE由于其有限的水傳導性而具有更大的阻力,隨后會產生矢量力,將其推向遠離Bruch膜的方向[16],在急性CSC中,由于脈絡膜大血管擴張通透性增強,可能存在脈絡膜的靜水壓和滲透壓的改變,隨即影響到RPE與Bruch膜間的黏附。本研究結果顯示這種破壞可能是持續存在的。
本研究仍存在一些局限性:本研究納入病例數較少,隨訪時間有限。更長的隨訪時間和更多患者的納入將使結果更有說服力。CSC患者長期的隊列研究也是未來可以研究的方向。
綜上,本研究發現在急性CSC的滲漏點處存在更明顯的Haller層擴張及長期存在的PED,這些發現為CSC的發病機制提供了更多線索。