雙叉犀金龜表皮蛋白TdCPR12611與TdCPR7854的表達純化及特性分析
葉長青,包 涵,劉 田,楊 青
(大連理工大學生物工程學院,遼寧大連 116024)
仿生材料是材料學的重要研究方向,生物體各具特色的表面結構對于仿生材料的設計具有重要的借鑒意義。其中昆蟲表皮憑借高強度、輕量型的特性,一直是仿生材料研究的熱點。陳斌等(2000)通過研究蟬的表皮結構,設計出具有高強度高韌性的復合材料;Vincent和Wegst (2004)對昆蟲表皮的硬度強度進行研究,提出了仿昆蟲表皮的纖維復合材料設計方案。仿生表皮的研發應用為人造材料的性能優化提供重要的啟示和指導。
昆蟲表皮(外骨骼)對于其維持運動能力、對抗外部環境壓力、抵御機械損傷以及免疫病原微生物侵害等方面具有至關重要的作用(Vincent and Wegst,2004;Websteretal.,2017;Deshouxetal.,2018)。昆蟲表皮是由上皮細胞分泌沉積而來,它覆蓋蟲體表面的組織器官,維持蟲體的完整性(梁欣等,2014),主要由幾丁質以及多種類型的表皮蛋白組成。幾丁質是N-乙酰氨基葡糖聚合物,可以分為晶態幾丁質、非晶態幾丁質和脫乙酰幾丁質(殼聚糖)等多種形式(Fukamizo and Kramer,1985)。晶態幾丁質根據其糖鏈排列方式的差異又可分為α-幾丁質(反平行)和β-幾丁質(平行)等,非晶態幾丁質是破壞晶體結構的膠體幾丁質;晶態和非晶態幾丁質都不溶于水。昆蟲表皮蛋白種類繁多,目前主要被分為12個家族(Jasrapuriaetal.,2012;Liuetal.,2015;Vanninietal.,2015;Songetal.,2016;Cinegeetal.,2017;Liuetal.,2018),其中CPR(cuticular proteins that contain the R&R consensus)蛋白是所有表皮蛋白中含量最為豐富的家族(Liuetal.,2018)。CPR家族成員都含有較為保守的R&R基序,被認為與幾丁質結合相關。根據R&R基序的差異,CPR家族又被分為3個亞族,分別為RR-1(主要分布于柔軟表皮中)、RR-2(主要分布于堅硬表皮中)以及RR-3(含量較少)(Andersen,1998)。已有研究表明,CPR家族表皮蛋白對于維持表皮完整性以及剛性韌性等方面具有關鍵作用(Arakaneetal.,2012;Zhaoetal.,2019)。另外,種類豐富的CPR家族成員與不同類型的幾丁質具有相互作用(Rebers and Willis,2001;Togawaetal.,2004;Tangetal.,2010)。
雙叉犀金龜Trypoxylusdichotomu的頭部角突是由其表皮特化而來,它是一種天然的防御攻擊武器,不僅能夠產生強力的機械攻擊,也能夠將自身以及大腦承受的傷害降至最低,具有顯著的抗斷裂韌性和抗形變剛性。Lee等(2017)利用聚焦離子束原位操作和測試的方法對雙叉犀金龜頭部角突的機械性能進行研究,結果表明其頭部角突具有很高的彈性模量及抗斷裂拉伸強度。Zhang等(2019)利用掃描電鏡觀察雙叉犀金龜的頭部角突發現其角質層是由高度有序的幾丁質納米纖維束排布構成,纖維束能夠排列成環向層,層與層之間通過纖維涂層相互連接,相鄰層之間旋轉堆疊形成典型的膠合板結構,這種構造為頭突角突的剛性和韌性提供支撐;X射線能量色散光譜(energy dispersive X-ray spectrum,EDS)表明角中的蛋白由內向外逐漸富集并呈梯度變化,且幾丁質納米纖維的取向也逐漸由環向往徑向改變,蛋白階梯式變化與幾丁質納米纖維的重新定向進一步增強了角的剛韌程度;此外,拉曼光譜表明角的主要成分是幾丁質和蛋白質。
因此,本研究選擇兩個存在于雙叉犀金龜頭部角突中的表皮蛋白作為研究對象,首先克隆了編碼兩個表皮蛋白TdCPR12611和TdCPR7854的基因;然后通過原核表達及金屬離子親和層析純化的方法獲得了兩個目的蛋白,并對其序列特征進行生物信息學分析;對兩個目的蛋白與不同類型幾丁質結合能力的進行了檢測;觀察比較兩個目的蛋白形成液液相分離性質的差異;結合生物信息學分析結果對兩個目的蛋白性質差異的原因進行了探討,旨在通過研究加深對昆蟲表皮形成機制的了解,為開發優質的仿生表皮材料提供思路。
1 材料與方法
1.1 材料與試劑
大腸桿菌Escherichiacoli基因克隆菌株DH5α和蛋白表達菌株BL21(DE3)、PrimeSTAR? HS (Premix)高保真酶、Premix TaqTM(Ex TaqTMVersion 2.0)、Mighty TA-cloning Kit、RNAiso Plus RNA提取試劑盒、PrimeScriptTMRT Reagent Kit反轉錄試劑盒、限制性核酸內切酶NdeⅠ和XhoⅠ以及In-Fusion連接酶購自TaKaRa公司;pET28a質粒載體為實驗室保存;其他未標明試劑均為國產分析純。
1.2 表皮蛋白基因克隆和測序驗證
基于實驗室早期通過對雙叉犀金龜蛹末期的頭部角突組織蛋白組與轉錄組測序數據,將獲得的氨基酸及核酸序列信息通過Blast及CutProtFam-Pred進行序列比對并分類,篩選出兩個屬于CPR_RR-2家族的表皮蛋白TdCPR12611和TdCPR7854。利用RNAiso Plus試劑盒提取雙叉犀金龜預蛹期頭殼組織總RNA,利用PrimeScriptTMRT Reagent Kit反轉錄試劑盒合成cDNA,引物序列見表1,PCR反應體系(50 μL):cDNA模板1 μL,Premix TaqTM(2×) 25 μL,T-12611/7854-F和T-12611/7854-R(10 μmol/L)各1 μL,ddH2O 22 μL。反應條件:98℃ 10 s,55℃ 30 s,72℃ 1 min,30個循環;4℃保存。將PCR擴增產物連接到克隆載體T-vector上,通過測序驗證擴增片段的正確性。通過信號肽預測確定信號肽編碼序列的分割點位置,以T-vector為模板,根據信號肽之后的片段設計連接引物(表1),同時在序列兩端引入20 bp左右的與表達載體序列一致的同源區域,并在兩端引入限制性內切酶的酶切位點,在預測蛋白序列N末端加入6×His Tag,PCR反應體系(50 μL):T-vector模板1 μL,PrimeSTAR HS (2×) 25 μL,pET28a-12611/7854-F和pET28a-12611/7854-R (10 μmol/L) 1 μL。反應條件:98℃ 10 s,55℃ 5 s,72℃ 5 s,35個循環;4℃保存。利用限制性內切酶NdeⅠ和XhoⅠ對表達載體質粒pET28a進行雙酶切,通過In-Fusion同源重組的方法將攜帶目的基因的片段與切割好的載體連接成完整的表達質粒pET28a-TdCPR12611及pET28a-TdCPR7854,并進行測序驗證。

表1 引物信息Table 1 Primer information
1.3 TdCPR12611及TdCPR7854蛋白的結構特征及系統發育分析
利用表皮蛋白序列在線分析軟件CutProtFam-Pred(http:∥aias.biol.uoa.gr/CutProtFam-Pred/search.php)對雙叉犀金龜表皮蛋白進行分類表征;利用 SignalP-5.0 Server(http:∥www.cbs.dtu.dk/services/SignalP/)進行信號肽預測;利用 ExPASy 數據庫(https:∥web.expasy.org/protscale/)進行親疏水性預測分析;利用PLAAC (http:∥plaac.wi.mit.edu/)進行蛋白的內部無序性(intrinsic disorder)預測;利用CIDER (http:∥pappulab.wustl.edu/CIDER/)進行蛋白帶電荷數分析,并對蛋白的每個殘基的凈電荷數(net charge per residue,NCFR)和帶電殘基分數(fraction of charged residues,FCR)進行計算。利用BLAST(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)在線搜索工具將TdCPR12611和TdCPR7854氨基酸序列與GenBank數據庫中的蛋白的序列進行比對,篩選出與之序列一致性最高的蛋白;利用MEGA7軟件采用鄰接(neighbor-joining)法對47種昆蟲表皮蛋白進行系統進化樹分析(500次重復)。
1.4 TdCPR12611及TdCPR7854的原核表達及分離純化
將測序驗證無誤后的表達質粒pET28a-TdCPR12611及pET28a-TdCPR7854轉化入大腸桿菌表達菌株BL21(DE3),菌株活化后擴大培養到對數生長期OD600=0.5~0.6,加入終濃度為0.5 mmol/L的IPTG,37℃誘導5 h后離心收集細菌。加緩沖液(20 mmol/L Tris,500 mmol/L NaCl,pH 7.4)重懸后,利用高壓勻漿破碎儀破碎細菌,離心去除細胞碎片沉淀,上清過鎳離子親和層析柱;用AKTA蛋白純化儀對表達蛋白TdCPR12611進行洗滌(20 mmol/L Tris,500 mmol/L NaCl,100 mmol/L咪唑,pH 7.4)和洗脫(20 mmol/L Tris,500 mmol/L NaCl,200 mmol/L咪唑,pH 7.4),對表達蛋白TdCPR7854蛋白進行洗滌(20 mmol/L Tris,500 mmol/L NaCl,100 mmol/L咪唑,pH 7.4)和洗脫(20 mmol/L Tris,500 mmol/L NaCl,250 mmol/L咪唑,pH 7.4);最后用SDS-PAGE檢測蛋白純化的結果,并用Western blot進行驗證。
1.5 TdCPR12611及TdCPR7854蛋白與幾丁質結合實驗
采用將蛋白與不同類型的幾丁質混合結合并洗脫的方法(張薇薇等,2017),選擇α-幾丁質(α-chitin)、β-幾丁質(β-chitin)、殼聚糖(chitosan)和膠體幾丁質(colloidal chitin)4種類型的幾丁質與重組表達的表皮蛋白進行體外結合實驗。具體實驗操作如下:將純化后的重組表達蛋白透析到結合緩沖液(20 mmol/L Tris,500 mmol/L NaCl,100 mmol/L咪唑,pH 7.4)中。構建200 μL反應體系,使蛋白終濃度為0.5 mg/mL,幾丁質終濃度為2 mg/mL。反應在室溫(25℃)進行,兩種蛋白與不同類型幾丁質在2 mL離心管中持續顛倒混勻2 h。反應結束后,12 000 r/min離心10 min,將上清取出記為未結合幾丁質的蛋白。在沉淀中加入相當于反應體系5倍體積的漂洗緩沖液(20 mmol/L Tris,500 mmol/L NaCl,100 mmol/L咪唑,pH 7.4),將沉淀重懸并顛倒混勻5 min進行漂洗后12 000 r/min離心5 min棄上清,重復漂洗3次。最后將沉淀放入烘箱中徹底干燥,加入200 μL的結合緩沖液后對沉淀進行重懸,取同樣體積的上清和沉淀重懸液進行SDS-PAGE,檢測蛋白與不同類型幾丁質的結合情況。利用Image J灰度分析軟件將SDS-PAGE結果進行灰度掃描量化,將用于結合實驗的蛋白條帶灰度值作為背景,進行反應體系上清液及沉淀重懸液蛋白條帶相對灰度計算,用相對灰度值代表結合幾丁質的蛋白占總蛋白的百分比,以此表征蛋白與幾丁質的結合能力。利用SPSS 22.0對結合幾丁質蛋白條帶的灰度數據進行單因素方差分析及差異顯著性分析(LSD法)。
1.6 TdCPR12611及TdCPR7854蛋白液液的相分離性質觀察
在對兩蛋白分離純化的過程中,發現TdCPR12611蛋白在濃度約為15 mg/mL,緩沖液為20 mmol/L Tris,500 mmol/L NaCl,pH 7.4條件下,存在溫度響應的液液相分離現象,而在相同條件下TdCPR7854不存在類似現象。將TdCPR12611蛋白溶液置于比色皿中,用肉眼觀察在4℃和25℃下蛋白溶液產生液液相分離的宏觀情況。用光學顯微鏡觀察400倍(目鏡10×,物鏡40×)放大倍數條件下TdCPR12611蛋白溶液形成相分離的微觀情況。
2 結果
2.1 TdCPR12611及TdCPR7854蛋白的結構特征
克隆獲得雙叉犀金龜表皮蛋白基因TdCPR12611(GenBank登錄號:MT813021)和TdCPR7854(GenBank登錄號:MT813022)序列。通過對TdCPR12611和TdCPR7854蛋白一級結構分析發現這兩個蛋白具有許多相似點,它們均屬于表皮蛋白CPR家族中RR-2亞族成員,其N端存在一段信號肽,為外泌型蛋白,且都存在一段與幾丁質結合相關的結構域R&R基序(圖1)。但兩者也存在許多差異,TdCPR12611存在兩段富含谷氨酰胺的區域(Q-rich region),蛋白中Q的含量很高,為16.8%(52/309);而TdCPR7854則存在兩段富含甘氨酸的區域(G-rich region),蛋白中G的含量很高,為28.7%(52/181)。分析蛋白的疏水性發現,TdCPR12611除了信號肽部分比較疏水外,該蛋白整體為親水性蛋白(圖1:A);TdCPR7854的信號肽及第一段G-rich region較為疏水,其余部分也為親水性結構(圖1:B)。
分析蛋白的內部無序性發現,TdCPR12611蛋白的信號肽部分以及R&R motif部分比較有序,而兩段Q-rich region比較無序,相對無序的部分可能對形成液液相分離做出貢獻,暗示該蛋白具有形成功能性結構的潛力。分析其每個氨基酸殘基的帶電荷數和帶電殘基分數可得,兩段Q-rich region幾乎不帶電荷,R&R motif為正負電荷交替出現(圖2:A);而TdCPR7854蛋白整體都是較為有序的狀態,且該蛋白整體為正負電荷交替出現狀態(圖2:B)。推測靜電相互作用可能是導致不同片段結構無序性差異的原因之一。
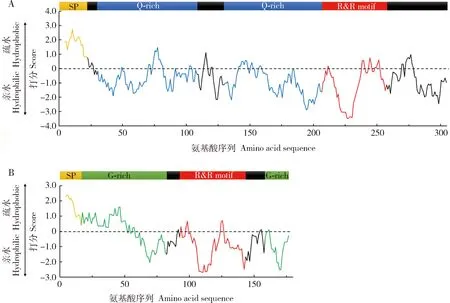
圖1 雙叉犀金龜表皮蛋白TdCPR12611 (A)及TdCPR7854 (B)的結構組成及疏水性分析Fig.1 Structural composition and hydrophobicity analysis of the cuticular proteins TdCPR12611 (A) and TdCPR7854 (B) of Trypoxylus dichotomusSP:信號肽Signal peptide;Q-rich:富含谷氨酰胺的區域Glutamine-rich region;R&R motif:與幾丁質結合相關的R&R基序R&R domain associated with chitin-binding;G-rich:富含甘氨酸的區域Glycine-rich region.圖2同The same for Fig.2.

圖2 雙叉犀金龜表皮蛋白TdCPR12611(A)及TdCPR7854 (B)內部無序性分析Fig.2 Intrinsic disorder analysis of the cuticular proteins TdCPR12611 (A) and TdCPR7854 (B) of Trypoxylus dichotomusPLD:內部無序性預測值在0.5以上符合朊蛋白樣結構,為無序的結構,紅線為預測線,黑線為背景線 Prediction of internal disorder,the predicted value above 0.5 conforms to prion protein-like structure,which is the disordered structure.The red line is the prediction line,and the black line is the background line.NCPR:每個氨基酸殘基的帶電荷數分析,其中藍色為正電荷,紅色為負電荷 Net charge per residue,in which blue is positive charge and red is negative charge.FCR:帶電殘基分數,帶電的氨基酸殘基對于蛋白帶電性的貢獻比例Charged residue fraction,the percentage of charged amino acid residues contributing to total protein charge.
2.2 TdCPR12611及TdCPR7854的系統發育分析
通過將TdCPR12611(GenBank登錄號:MT813021)和TdCPR7854(GenBank登錄號:MT813022)編碼的氨基酸進行BLAST序列比對,結果表明:TdCPR12611蛋白與食糞金龜Onthophagustauruscuticular protein 1(GenBank登錄號:XP_022920963.1)、光肩星天牛Anoplophoraglabripenniscuticular protein 1(GenBank登錄號:XP_018577010.1)、北美螢火蟲Photinuspyraliscuticular protein ts15(GenBank登錄號:XP_031347513.1)及邊褐端黑螢Absconditaterminaliscuticular protein hp65(>KAF5297863.1)的序列一致性較高,分別為83%,78%,75%和75%;TdCPR7854與食糞金龜adult-specific cuticular protein ACP-20-like(GenBank登錄號:XP_022914362.1)和中歐山松大小蠹Dendroctonusponderosaeadult-specific cuticular protein ACP-20-like(GenBank登錄號:XP_019761647.1)的序列一致性相對較高,分別為46%和40%。將47種昆蟲表皮蛋白進行系統進化樹分析發現:TdCPR12611與食糞金龜RR-2家族蛋白OtCP-1(GenBank登錄號:XP_022920963.1)的親緣關系最近,在同一分支上;TdCPR7854與食糞金龜3種不同類型的adult-specific cuticular protein ACP-20-like蛋白OtCP-acp20-1(GenBank登錄號:XP_022914362.1)、OtCP-acp20-2(GenBank登錄號:XP_022920192.1)和OtCP-acp20-3(GenBank登錄號:XP_022903303.1)的親緣關系最為接近,它們均屬于CPR_RR-2家族(圖3)。
2.3 雙叉犀金龜表皮蛋白TdCPR12611及TdCPR7854的表達及純化
在帶有TdCPR12611和TdCPR7854基因的克隆載體和表達載體測序鑒定無誤后,對兩個蛋白進行了原核細胞的誘導表達,經過鎳離子親和層析純化后獲得的目的蛋白,SDS-PAGE和Western blot檢測結果如圖4所示。TdCPR12611蛋白分子量約35 kD(理論分子量32.52 kD),TdCPR7854蛋白分子量約18 kD(理論分子量17.62 kD),從SDS-PAGE結果可以看出蛋白的純度較高,可以作為后續實驗的材料。Western blot結果均為單一信號條帶,說明蛋白確實是重組表達的蛋白,并且蛋白較為穩定沒有降解的現象。
2.4 TdCPR12611和TdCPR7854蛋白與幾丁質結合能力
利用SDS-PAGE檢測TdCPR12611及TdCPR7854與不同類型幾丁質的結合能力情況,灰度量化的結果表明2種蛋白與4種不同類型幾丁質的結合能力均存在顯著差異。TdCPR12611僅有蛋白能夠與α-幾丁質結合,蛋白主要存在于上清(未結合的蛋白)中;與β-幾丁質和膠體幾丁質的結合能力相近,約有28.0%的TdCPR12611蛋白結合,在沉淀(結合的蛋白)中存在部分蛋白;與殼聚糖的結合能力相對較強,41.4%的TdCPR12611蛋白結合(圖5:A,B)。TdCPR7854蛋白幾乎不與α-幾丁質結合,約有30.0%的蛋白能夠與殼聚糖和膠體幾丁質結合,與β-幾丁質存在較強結合能力,約有62.3%的蛋白結合(圖5:C,D)。
2.5 TdCPR12611及TdCPR7854蛋白的液液相分離性質
肉眼觀察兩個蛋白溶液發現TdCPR12611蛋白在4℃條件下是清澈透明的狀態,隨著溫度升高到室溫(25℃),蛋白溶液逐漸由澄清變渾濁;而TdCPR7854蛋白未出現類似現象。在室溫下用光學顯微鏡觀察兩者的蛋白溶液,發現TdCPR12611蛋白出現團聚體(coacervate)現象,團聚體具有流動形變性,并能夠相互融合形成更大的團聚體;而且團聚體形成與消失是可逆的,溫度升高至室溫團聚體形成,當溫度降低到4℃條件時團聚體會消失,蛋白溶液恢復澄清狀態(圖6);而TdCPR7854蛋白則不具有這種性質。
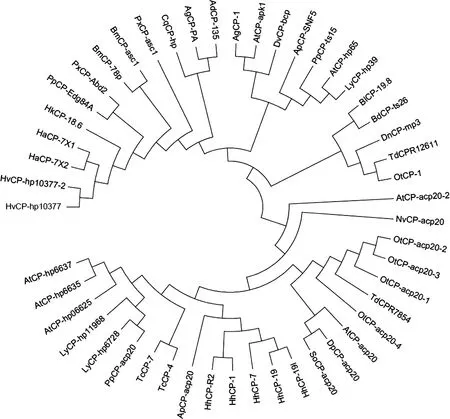
圖3 鄰接法構建的基于氨基酸序列的昆蟲表皮蛋白系統進化樹(500次重復)Fig.3 Phylogenetic tree of insect cuticular proteins by neighbor-joining method based on amino acid sequences (500 replicates)蛋白來源物種及其GenBank登錄號Origin species of proteins and their GenBank accession numbers:TdCPR12611:雙叉犀金龜Trypoxylus dichotomus,MT813021;TdCPR7854:雙叉犀金龜Trypoxylus dichotomus,MT813022;OtCP-1:食糞金龜Onthophagus taurus,XP_022920963.1;AgCP-1:光肩星天牛Anoplophora glabripennis,XP_018577010.1;PpCP-ts15:北美螢火蟲Photinus pyralis,XP_031347513.1;AtCP-hp65:邊褐端黑螢Abscondita terminalis,KAF5297863.1;OtCP-acp20-1:食糞金龜Onthophagus taurus,XP_022914362.1;OtCP-acp20-2:食糞金龜Onthophagus taurus,XP_022920192.1;OtCP-acp20-3:食糞金龜Onthophagus taurus,XP_022903303.1;LyCP-hp39:扁螢Lamprigera yunnana,KAF5299004.1;HkCP-18.6:海波斯莫科馬屬蛾Hyposmocoma kahamanoa,XP_026328431.1;AgCP-PA:岡比亞按蚊Anopheles gambiae,XP_556966.3;AdCP-135:達氏按蚊 Anopheles darling,ETN63120.1;PxCP-asc1:小菜蛾 Plutella xylostella,XP_011550962.1;ApCP-SNF5:白蠟窄吉丁Agrilus planipennis,XP_018318748.1;AtCP-apk1:小蜂窩甲蟲 Aethina tumida,XP_019877778.1;CqCP-hp:致倦庫蚊Culex quinquefasciatus,XP_001865100.1;DnCP-mp3:麥雙尾蚜Diuraphis noxia,XP_015375949.1;DvCP-bcp:玉米根蟲Diabrotica virgifera,XP_028141552.1;BlCP-19.8:馬來西亞實蠅Bactrocera latifrons,XP_018801521.1;HvCP-hp10377:煙芽夜蛾Heliothis virescens,PCG64628.1;HaCP-7X2:棉鈴蟲Helicoverpa armigera,XP_021196834.1;HvCP-hp10377-2:煙芽夜蛾Heliothis virescens,PCG64627.1;HaCP-7X1:棉鈴蟲Helicoverpa armigera,XP_021196833.1;BdCP-ts26:橘小實蠅 Bactrocera dorsalis,XP_011200150.1;BmCP-78p:家蠶Bombyx mori,NP_001166682.1;BmCP-asc1:野桑蠶Bombyx mandarina,XP_028026464.1;PpCP-Edg84A:玉帶鳳蝶Papilio polytes,XP_013134319.1;PxCP-Abd2:柑橘鳳蝶Papilio xuthus,NP_001298788.1;DpCP-acp20:中歐山松大小蠹Dendroctonus ponderosae,XP_019761647.1;LyCP-hp11968:扁螢Lamprigera yunnana,KAF5297637.1;TcCP-4:赤擬谷盜 Tribolium castaneum,EFA04643.2;TcCP-7:赤擬谷盜Tribolium castaneum,XP_008193006.2;AtCP-hp06625:邊褐端黑螢 Abscondita terminalis,KAF5307754.1;HhCP-1:茶翅蝽 Halyomorpha halys,KAE8573268.1;PpCP-acp20:北美螢火蟲Photinus pyralis,XP_031344218.1;LyCP-hp6728:扁螢 Lamprigera yunnana,KAF5275617.1;SoCP-acp20:米象Sitophilus oryzae,XP_030749553.1;AtCP-acp20:小蜂窩甲蟲Aethina tumida,XP_019875905.1;NvCP-acp20:大紅葬甲Nicrophorus vespilloides,XP_017784612.1;AtCP-acp20-2:小蜂窩甲蟲Aethina tumida,XP_019875906.1;HhCP-19l:茶翅蝽Halyomorpha halys,XP_014279712.1;OtCP-acp20-4:食糞金龜Onthophagus taurus,XP_022903303.1;HhCP-19:茶翅蝽 Halyomorpha halys,XP_014279718.1;ApCP-acp20:白蠟窄吉丁Agrilus planipennis,XP_025830566.1;AtCP-hp6635:邊褐端黑螢Abscondita terminalis,KAF5307764.1;HhCP-7:茶翅蝽Halyomorpha halys,XP_024217407.1;HhCP-R2:茶翅蝽 Halyomorpha halys,KAE8573269.1;AtCP-hp6637:邊褐端黑螢Abscondita terminalis,KAF5307766.1.

圖4 純化的雙叉犀金龜重組表皮蛋白TdCPR12611 (A)和TdCPR7854 (B)的SDS-PAGE及Western blot檢測Fig.4 SDS-PAGE and Western blot detection of the purified recombinant cuticular proteins TdCPR12611 (A) and TdCPR7854 (B) of Trypoxylus dichotomusM:蛋白低分子量標準Low molecular weight protein marker;WB:Western blot.

圖5 雙叉犀金龜表皮蛋白TdCPR12611(A,B)和TdCPR7854 (C,D)與不同類型幾丁質的結合能力Fig.5 Binding abilities of the cuticular proteins TdCPR12611 (A,B) and TdCPR7854 (C,D) of Trypoxylus dichotomus with different types of chitinA,C:SDS-PAGE;B,D:灰度掃描量化結果 Gray scan quantization result.T:用于結合實驗的表皮蛋白樣品 Cuticular protein sample for binding experiment;F:反應體系上清液,即未結合幾丁質的蛋白Supernatant of the reaction system,unbound protein with chitin;E:反應體系沉淀重懸液,即結合幾丁質的蛋白Sediment resuspension of the reaction system,bound protein with chitin;M:蛋白低分子量標準Protein low molecular weight marker.圖中灰色柱表示結合幾丁質的蛋白占總蛋白的百分比,每個處理3個技術重復。柱上不同小寫字母表示與不同類型幾丁質結合的蛋白的百分比(平均值±標準誤)差異顯著(P<0.05,LSD法)。The gray column in the figure indicates the percentage of protein binding with chitin,and each treatment has three technical replicates.Different lowercase letters above bars represent significant differences in the percentage (mean±SE) of protein binding with different types of chitin (P<0.05,LSD method).

圖6 雙叉犀金龜表皮蛋白TdCPR12611液液相分離現象觀察Fig.6 Observation of liquid-liquid phase separation of cuticular protein TdCPR12611 of Trypoxylus dichotomusA:TdCPR12611蛋白溶液在不同溫度下的肉眼觀察結果,蛋白出現液液相分離現象隨著溫度改變是可逆的The macroscopic observation of TdCPR12611 protein solution at different temperatures showed that the protein separation in liquid phase was reversible with the change of temperature;B:TdCPR12611蛋白在室溫條件下光學顯微鏡觀察結果,蛋白溶液中出現的圓球即為團聚體TdCPR12611 protein was observed under light microscope at room temperature,and the globules in the protein solution were coacervates.
3 討論
本研究選擇了雙叉犀金龜頭部角突組織中表達含量較高的兩種表皮蛋白TdCPR12611及TdCPR7854作為研究對象。生物信息學分析發現它們均屬于昆蟲表皮蛋白CPR_RR-2家族成員,攜帶有保守的R&R結構域,這說明兩者可能與幾丁質具有相互作用。系統進化樹分析表明兩者與來源于食糞金龜中不同的CPR_RR-2家族表皮蛋白親緣關系較近。與幾丁質體外結合實驗表明,兩種蛋白與不同類型的幾丁質結合具有顯著的差異,其中TdCPR12611與殼聚糖具有較強的結合能力,TdCPR7854與β-幾丁質的結合能力較強,這說明兩蛋白在雙叉犀金龜頭部角突的形成過程中可能發揮重要作用,能夠幫助雙叉犀金龜頭部角突形成堅硬的組織結構。這進一步說明RR-2家族表皮蛋白在昆蟲表皮形成裝配過程中發揮重要作用。同時,由于RR-2家族蛋白多存在于昆蟲堅硬組織中(劉曉健等,2019),因此推測兩蛋白具有作為優良蛋白質仿生材料的潛力。已有研究證明蛋白質的正確折疊對幾丁質材料的剛度有很大影響,幾丁質結合域(chitin-binding domain,CBD)的存在極大地影響了材料的最大應力和楊氏模量。例如天然材料魷魚的軟骨中去除蛋白而保留幾丁質骨架會造成軟骨部分的最大應力損失>80%,楊氏模量損失>90%(Montronietal.,2021)。含有兩個纖維素結合模塊(cellulose-binding modules,CBM)的工程蛋白與納米纖維素復合制膜,也能夠顯著提升納米纖維素膜的極限拉伸強度、剛度及韌性(Malhoetal.,2015)。TdCPR12611蛋白具有能夠與幾丁質結合的結構模塊,實驗表明該蛋白與殼聚糖具有較強的相互作用。因此,推測TdCPR12611蛋白可能能夠與幾丁質復合,形成具備優良性能的仿生材料。
實驗過程中發現TdCPR12611蛋白能夠在室溫條件下自發團聚形成LLPS,與Mohammadi等(2018)利用蛛絲蛋白ADF3形成液體狀的團聚體(liquid-like coacervate,LLC)的性質類似,而TdCPR7854則不具備類似的性質。在研究彈性蛋白(elastin)和節肢彈性蛋白(resilin)溫度響應相變過程中發現,它們普遍存在一種P-Xn-G基序(P:脯氨酸;G:甘氨酸;X:任意一種氨基酸;n為0~4整數),作者認為這種基序是組成蛋白自身無序結構的框架(Quiroz and Chilkoti,2015)。而在TdCPR12611蛋白的序列中不存在類似的基序,推測是不帶電的極性氨基酸Q含量高,分子內缺乏靜電相互作用穩固蛋白結構,使占主導地位的兩段Q-rich region為低復雜度序列,從而使整個蛋白呈現內部無序狀態。而蛋白內部的無序性,可以對形成液液相分離的現象做貢獻(Albertietal.,2019),這可能是造成TdCPR12611蛋白能夠形成LLPS的原因。團聚是指將均質大分子溶液分離成兩種不同的液相。在水溶液中團聚體被認為有利于組裝生物大分子網絡結構,原因是團聚體具有很高的局部蛋白質濃度,但它仍呈液體狀且不溶于水,這有利于在細胞外環境中高濃度地運輸蛋白質。團聚體在低濃度下具有較低的粘度以及極低的界面自由能,并且具有剪切稀釋特征,使其能夠浸漬到納米多孔骨架(如幾丁質-幾丁質結合蛋白骨架結構)之中。已有研究表明,許多蛋白在形成具有功能性的結構之前都需要經歷團聚體的過渡形式(Mohammadietal.,2018),如在研究貽貝類等海洋生物的粘附劑領域,足絲蛋白首先經歷液液相分離然后迅速固化達到粘附于固體表面的效果(Stewartetal.,2011;Waite,2017);魷魚喙在形成過程中,一種富含組氨酸的recDgHBP-1蛋白也需要經歷形成團聚體這一中間環節(Tanetal.,2015);在彈性蛋白組裝成具有功能性結構的過程中也涉及蛋白團聚步驟(Muiznieksetal.,2014)。TdCPR12611蛋白在純化后也存在形成團聚體的現象,由此進一步推測該蛋白具有組裝形成優良性能結構材料的潛力。
綜上所述,本研究比較了兩種來源于雙叉犀金龜頭部角突中的表皮蛋白,兩者均屬于CPR家族中的RR-2亞族成員,它們均具有良好的親水性,但它們在內部無序性、形成液液相分離的性質及幾丁質結合能力上均具有明顯的差異,其中TdCPR12611蛋白具備優良的性能及應用于仿生材料制備的潛力。本研究進一步表明了表皮蛋白CPR家族在昆蟲表皮結構中承擔著重要角色,對研究昆蟲表皮的形成過程有所啟發,并且為制備新型蛋白質仿生材料的原料選擇方面提供了新依據。

