免疫檢查點抑制劑在軟組織肉瘤治療中的研究進展
吳涵瀟,陳 銳,馮 翔
軟組織肉瘤(soft tissue sarcomas,STS)是一種少見的具有異質性的間葉源性惡性腫瘤,大概占全部成年惡性腫瘤的1%[1]。在兒童中,STS占惡性腫瘤比例高達10%~15%。STS有超過50種組織學亞型[2],并且各亞型之間的生物學行為大不相同。目前局限性STS的最主要的治療方法是外科切除,對于部分體積較大或是已經發生轉移的STS常常采用新輔助或者輔助化療來控制病情,但這種治療方法療效十分有限[3-5]。據統計,約50%體積較大的高級別STS會發生轉移,最常見的轉移部位是肺[6]。在目前的治療手段下,發生轉移后患者的中位生存期不到2年[7-8],急需尋找新的治療方法來減少STS的轉移以提高生存時間。
免疫檢查點是正常免疫系統中存在的,通過調節免疫反應強度來維持自身抗原耐受的抑制性信號通路[9]。這些檢查點在免疫激活后作為減少炎性反應的自然抑制反饋環路發揮作用,減少免疫反應對周圍正常組織造成的損傷。腫瘤免疫逃逸的主要機制便是利用這些免疫檢查點來防止T細胞識別和殺傷腫瘤細胞[10-11]。免疫檢查點信號通路大部分是由配體與受體結合開始的[9],而這種結合可以被抗體干擾,使得利用抗體來抑制免疫檢查點從而激活免疫系統抗腫瘤效應成為可能。
當前美國食品藥品監督管理局允許上市的免疫治療抗體主要有2大類:(1)程序性死亡受體1(programmed death-1,PD-1)及其配體(programmed death-ligand 1,PD-L1);(2)細胞毒T淋巴細胞相關抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)。盡管目前在臨床實踐中,抗PD-1和抗CTLA-4抗體已經成功應用于多種癌癥的治療,但在治療STS中的研究相對較少。因此,本文將就近年來免疫檢查點抑制治療應用于STS的臨床試驗作一綜述,并探討免疫治療整合新輔助或輔助治療對STS進行綜合治療的可行性。
1 單獨應用免疫檢查點抑制劑的治療效果
1.1 伊匹單抗(Ipilimumab)和阿特珠單抗(Atezolizumab)
當前,已有多項將免疫檢查點抑制療法應用于STS治療的臨床試驗,表1(數據收集截止至2020年9月)展示了其中涉及單獨應用伊匹單抗和阿特珠單抗的臨床試驗。一項由MAKI等[12]開展的小規模Ⅱ期臨床試驗探究了抗CTLA-4抗體伊匹單抗在滑膜肉瘤中的治療效果,但該試驗中伊匹單抗的療效并不理想,所有患者在第3輪用藥后均出現了疾病的進展。滑膜肉瘤是一種由于染色體易位導致的有相對較低突變負擔的肉瘤[13],往往伴有內源性癌-睪丸抗原NYESO-1的高表達[14-15];由于癌-睪丸抗原僅在正常人的睪丸中表達,這一表達特性使NYESO-1有望成為STS免疫治療的靶抗原。針對這一靶抗原的另一項正在進行的抗PD-L1抗體阿特珠單抗聯合CMB305(一種靶向樹突狀細胞的、表達NY-ESO-1的病毒載體LV305與NY-ESO-1重組蛋白G305的聯合制劑)正應用于STS的臨床試驗(NCT02609984)。這一臨床研究旨在通過CMB305與樹突狀細胞的靶向特異性相互作用,在體內引發抗NY-ESO-1的免疫應答,由于療效未達到預期,該臨床試驗已于2020年7月終止。
1.2 納武單抗(Nivolumab)
一項2018年9月結束的Ⅱ期臨床試驗(NCT02428192)主要目的是觀察抗PD-1抗體納武單抗單藥(12例患者入組)及納武單抗聯合伊匹單抗(8例患者入組)在治療晚期子宮平滑肌肉瘤中的效果。第一階段試驗結果顯示,單藥組中位無進展生存期(progression-free survival,PFS)是1.8個月,聯合用藥組中位PFS期為2.0個月。試驗結果顯示,2組均無患者對納武單抗的治療有反應[16],該研究也隨之結束。另一項Ⅱ期臨床試驗(NCT02500797)針對患已發生轉移、無法手術切除的骨肉瘤或STS的患者進行免疫檢查點抑制治療;該試驗用藥方案和上述提到的研究相同,在這項研究中將去分化脂肪肉瘤、未分化的多形性肉瘤和惡性纖維組織細胞瘤,患者被隨機分到單藥組和聯合治療組,前者服用單藥納武單抗,后者采用納武單抗聯合伊匹單抗的治療方案。研究結果顯示,去分化脂肪肉瘤單藥組客觀緩解率為6.7%,聯合治療組的客觀緩解率為14.3%;未分化的多形性肉瘤和惡性纖維組織細胞瘤單藥組客觀緩解率為7.7%,聯合治療組的客觀緩解率為14.3%[17];這一結果說明,納武單抗單藥療效差于納武單抗聯合伊匹單抗。
1.3 帕博利珠單抗(Pembrolizumab)
GEORGE等[18]報道了1例未經治療、已經發生轉移的子宮平滑肌肉瘤患者應用抗PD-1抗體帕博利珠單抗治療的結果。在應用帕博利珠單抗治療9個月后,該患者除一孤立腫塊外(該腫塊隨后被手術切除)的其他轉移區域都表現出了顯著地消退,該患者獲得了為期2年的完全緩解時間;該研究中對手術獲得的耐藥孤立腫塊進行了進一步的研究,發現其腫瘤細胞中第10號染色體同源丟失性磷酸酶基因和張力蛋白(phosphate and tension homology deleted on chromsome ten,
PTEN)基因發生丟失,以及2種在體外條件下對患者T細胞表現出強免疫反應性的2種新抗原的低表達,這一發現提示可能存在一種新的腫瘤拮抗PD-1抑制劑的機制。
另一項始于2015年3月的一項Ⅱ期臨床試驗(NCT02301039)使用帕博利珠單抗單藥治療86例不可手術切除、已發生轉移或復發的STS或骨肉瘤患者。40例接受治療的STS患者中共7例取得了部分緩解,分別為10例入組未分化多形性肉瘤(undifferentiated pleomorphoic sarcoma,UPS)患者中的4例[緩解率為40%(4/10)],10例入組去分化脂肪肉瘤患者中的2例[緩解率為20%(2/10)]及10例入組滑膜肉瘤患者中的1例[緩解率為10%(1/10)],10例平滑肌肉瘤患者中未觀察到任何患者取得部分緩解。40例STS患者的中位PFS期是18周,而這一數據在UPS和去分化脂肪肉瘤患者中則分別是30和25周。這些STS患者的中位總生存(overall survival,OS)期為49周[19]。這一結論提示,STS中遺傳學表現越復雜的亞型如UPS,其對免疫檢查點抑制劑的反應可能越大[20]。
2 正在開展的免疫治療聯合新輔助放療研究
隨著免疫治療越來越多的被應用到非小細胞肺癌[21-22]和黑素瘤[23]中,文獻中開始報道遠隔效應[24-27]。所謂遠隔效應,是指單純的局部放療,可以激活身體內的免疫系統,誘導免疫細胞對放療區域以外的腫瘤細胞進行攻擊[25]。在一些臨床前研究中,免疫檢查點抑制和放療聯合治療后的遠隔效應已經在移植瘤小鼠模型上得到了驗證[28]。目前許多正在進行的臨床前研究和臨床研究正努力地尋找能夠最大程度的激發遠隔效應的放療的策略。
據統計,高級別STS患者中約有50%會發生轉移[6]。在STS的治療中,遠隔效應具有重要作用。許多STS患者在首次手術時就已經存在有不可檢測的微轉移,通過聯合免疫治療和新輔助放療(即術前放療)來激發免疫系統針對這些微轉移病灶的免疫反應可以提高這些患者的長期生存率。大多數針對放療和免疫治療的臨床研究都是在轉移已經發生這一條件下進行的[29]。然而,治療前的腫瘤體積越小,其對免疫檢查點抑制治療的反應可能越好[30],由此提示放療聯合免疫治療的療法在確定性治療中可能更有效[22]。免疫檢查點抑制治療可能改變人們目前對高轉移風險肉瘤的治療理念,即采用免疫治療來阻止轉移的發生而不是用其去治療轉移病灶。
新輔助放療雖然在多項針對STS的研究中被報道對免疫檢查點抑制治療有協同增強效應[28,31-33],但直至目前仍然沒有放療聯合免疫治療應用于STS的臨床研究報道,有關正在進行的相關臨床試驗以及相關臨床試驗研究見表2(數據收集截止至2020年9月)。
德克薩斯大學安德森癌癥中心于2017年10月開始了一項預計40例患者參與的隨機Ⅱ期臨床試驗(NCT03307616),旨在比較單獨應用納武單抗和同時應用納武單抗與伊匹單抗在與新輔助放療聯用時對治療STS有無差別。腹膜后脂肪肉瘤和軀干或四肢的UPS患者分別被隨機分為2組;腹膜后脂肪肉瘤患者分別進行納武單抗單藥治療或納武單抗聯合伊匹單抗進行治療,UPS患者則分為納武單抗聯合放療治療或納武單抗聯合伊匹單抗再聯合放療治療[34]。該研究主要目標是獲取患者對治療的組織病理學改變數據。次要目標是獲取免疫學改變、免疫浸潤的變化、客觀緩解率、無復發生存情況、總體生存和安全性等數據。該研究預計將于2021年10月結束。
基于前面提到的臨床研究(NCT02301039)在某些特定亞型的STS患者中取得了很好的療效,一項由美國、澳大利亞和加拿大等多個機構參與的隨機多中心臨床試驗(NCT03092323)把研究對象縮小到了NCT02301039研究中對治療反應最好的UPS和去分化和(或)多形性脂肪肉瘤。該研究樣本量為110例,這些患者被隨機分成對照組和研究組,前者采取新輔助放療后手術切除的治療方案;后者在放療前、中、后各加入1個周期的帕博利珠單抗治療后再行手術治療,術后繼續行帕博利珠單抗輔助治療。該研究的主要目標是2年時的無病生存情況,次要目標是獲取藥物毒性、局部控制、無轉移生存情況和總體生存情況數據,該研究預計將于2025年7月結束。
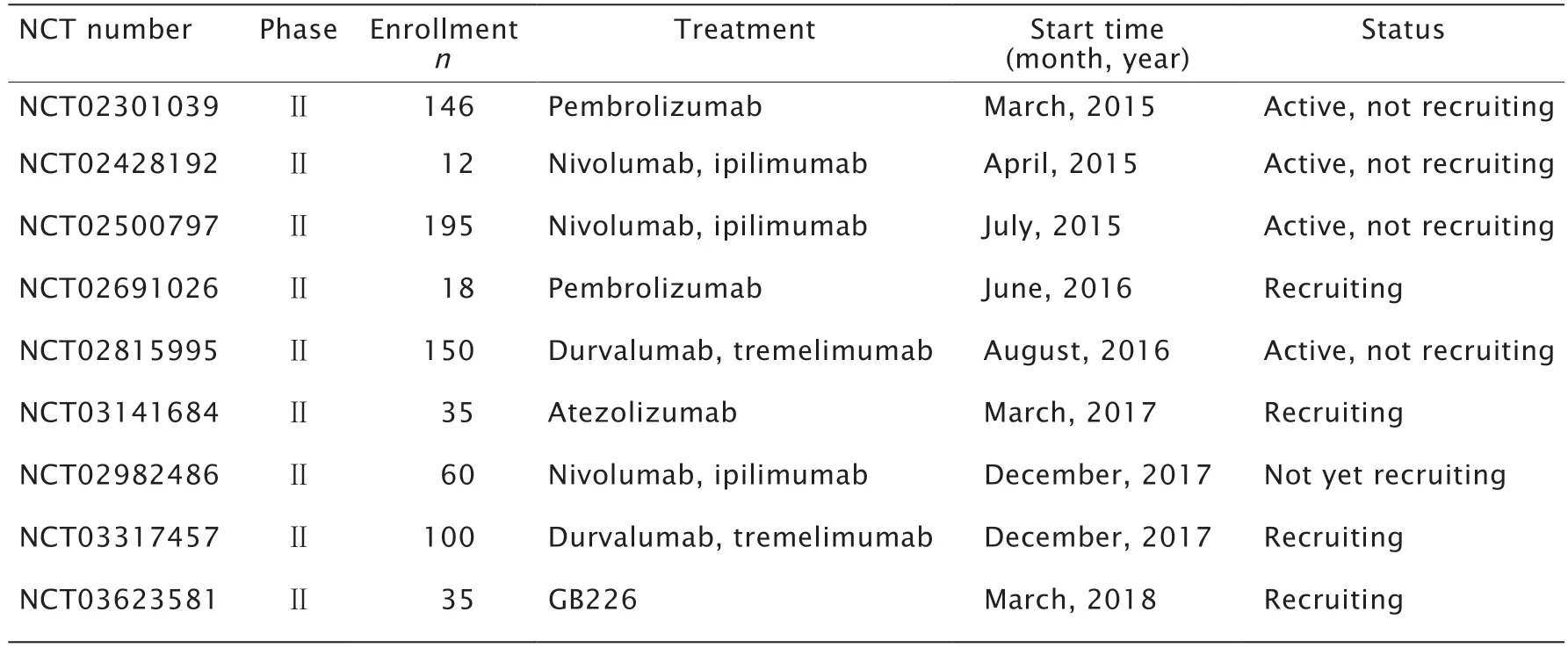
表1 單獨應用免疫治療的臨床試驗Table 1 Clinical trials of immunotherapy*
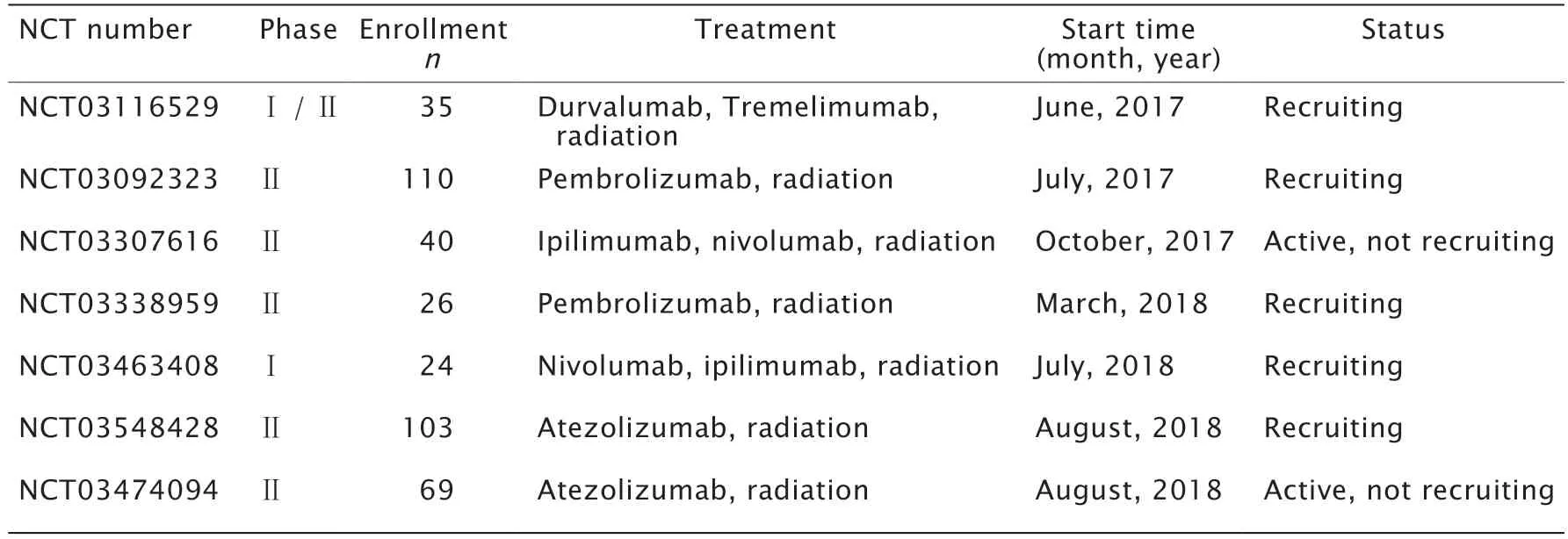
表2 免疫治療聯合新輔助放療的臨床試驗Table 2 Clinical trials of immunotherapy combined with neoadjuvant radiotherapy*
上述的研究將有助于了解免疫檢查點抑制治療聯合放射治療的綜合治療策略在STS中的表現,幫助接下來的臨床試驗進行試驗入組對象的選擇,還可能確定STS免疫治療的新靶點。
3 免疫治療聯合靶向治療或化療
聯合免疫治療與靶向治療或化療應用于STS的治療方案最先應用于已發生轉移的STS中[35]。在一項樣本量為28例患者的回顧性研究中,探討了納武單抗用于復發、已發生轉移或已無法手術治療的STS患者的安全性和治療效果[36]。該研究中,大部分患者在使用納武單抗進行治療時的同時應用了帕唑帕尼(Pazopanib)(一種多重激酶抑制劑)進行治療。該研究在應用4個周期納武單抗治療后,采用實體瘤療效評價標準1.1(Response Evaluation Criteria In Solid Tumors 1.1,RECIST1.1)來評估腫瘤的進展情況,結果顯示有3例患者表現出了部分緩解。
一項已完成的樣本量同樣為28例的ⅠB期臨床試驗(NCT01643278)中,應用伊匹單抗聯合達沙替尼(Dasatinib)(一種酪氨酸激酶抑制劑)治療STS,并對2藥聯合治療的安全性和有效性進行了評價;RECIST1.1評判結果結果顯示,沒有患者表現出了疾病的完全緩解或部分緩解[37]。這一結果提示,伊匹單抗和達沙替尼的聯合療法雖然耐受性好但療效有限。
最近另一項法國多中心Ⅱ期臨床研究(NCT02406781)評估了帕博利珠單抗聯合使用環磷酰胺的節拍化療在50例已發生轉移的STS患者中的療效[38],6個月時只有3例患者沒有表現出疾病進展,總體PFS期僅為1.4個月。浸潤在腫瘤樣本中的免疫細胞有高表達的吲哚胺2,3-雙加氧酶1(indoleamine 2,3-dioxygenase 1,IDO1)。在應用帕博利珠單抗后,患者血清中犬尿酸/色氨酸的比值顯著上升。研究人員猜測,IDO1的產物可能可以調節T細胞的增殖從而引起對帕博利珠單抗的拮抗。這一結果提示,今后是否可在應用抗PD-1抗體治療STS時可聯用IDO1拮抗劑。
當前有多項臨床試驗在探究同時應用抗CTLA-4制劑和抗PD-1制劑的免疫治療與化療聯用治療STS的效果。肉瘤腫瘤研究中心(Sarcoma Oncology Research Center)正在主導的一項非盲Ⅰ/Ⅱ期臨床試驗(NCT03138161)在測試曲貝替定聯合伊匹單抗和納武單抗治療STS的效果。該研究分為2個階段:第一階段的目的是獲取曲貝替定的最大耐受劑量;第二階段中所有患者將接受最大耐受劑量的曲貝替定聯合伊匹單抗和納武單抗的綜合治療。在必要的情況下,研究者將會通過外科手段進行肉瘤切除,這些獲得的肉瘤標本將會進行免疫組化染色以確定該療法對腫瘤微環境的影響。該研究預計將于2020年8月結束,目前仍在招募患者中。
蒽環類藥物是很多種已發生轉移的肉瘤亞型的一線化療藥,一項樣本量為100例患者的德國Ⅱ期臨床研究(NCT03317457)將已發生轉移或局部進展的包括STS在內的多種肉瘤患者隨機分成2組,一組采用蒽環類藥物聯合多柔比星(Doxorubicin)進行治療,另一組采用抗PD-L1抗體度伐單抗(Durvalumab)聯合抗CTLA4抗體曲美奧單抗(Tremelimumab)進行治療。該研究旨在比較,抗體聯合治療方案與當前一線治療藥物之間的療效差別。此外,有2項探究帕博利珠單抗聯合多柔比星應用于STS中的臨床研究正在開展中(NCT03056001和NCT02888665)。
此外,還有許多正在進行的臨床試驗將目光投向了聯合免疫治療與當前在其他惡性腫瘤領域有很好療效的溶瘤病毒(NCT03069378)、NKTR-214(NCT03282344)以及阿扎胞苷(NCT03628209)等,以期實現對STS的更好的療效。本研究中,將截止于2020年9月的免疫治療聯合靶向治療或化療應用于STS的臨床研究列在了表3中。這些臨床試驗的完成也許有助于建立一套新的治療STS的方案。
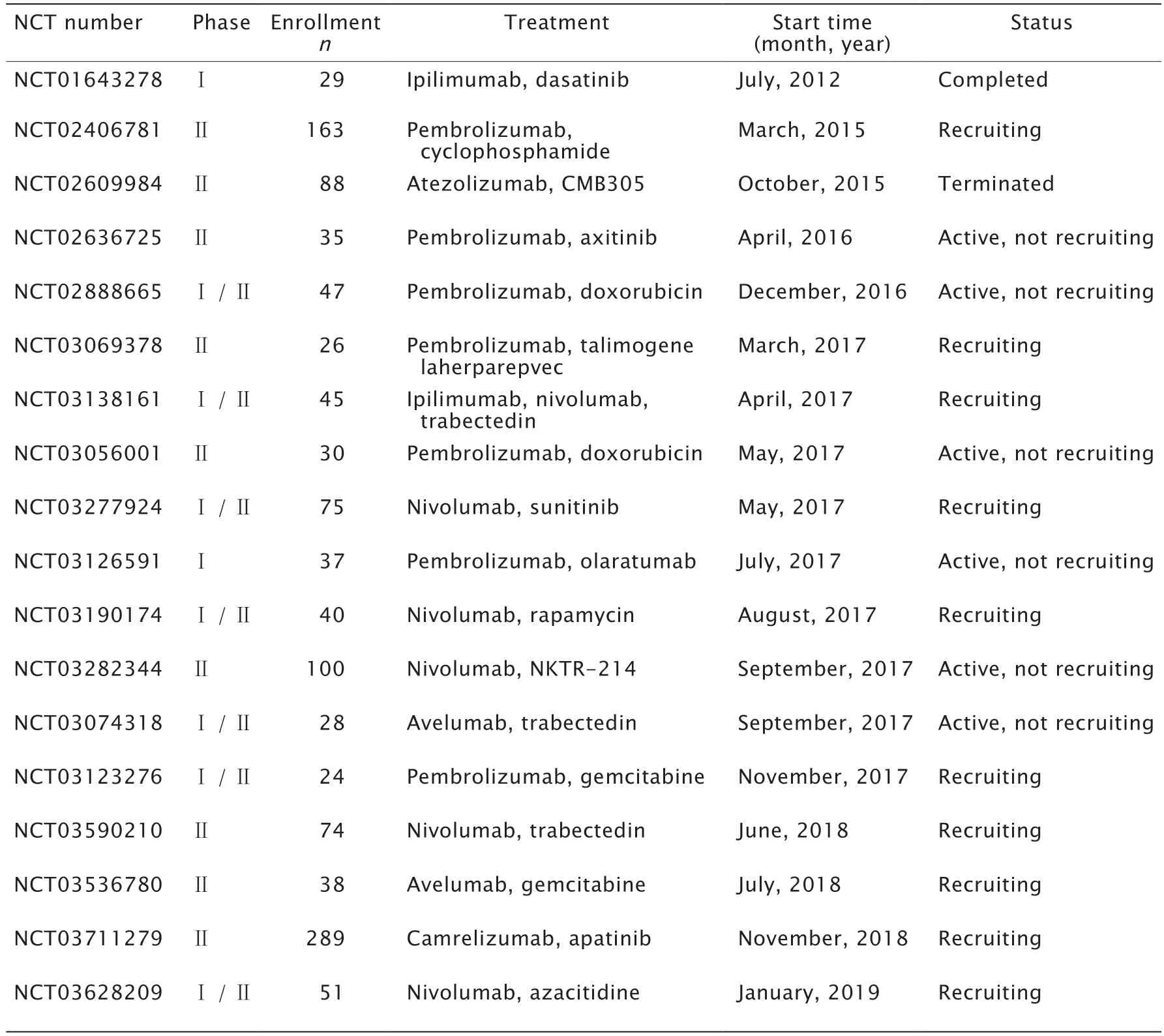
表3 免疫治療聯合靶向治療或化療的臨床試驗Table 3 Clinical trials of immunotherapy combined with chemotherapy or targeted therapy*
4 總結與展望
臨床前的證據提示,免疫系統在STS的治療中有重要作用,但目前仍缺乏臨床證據。目前有許多正在進行的針對高風險、局限的STS患者的免疫檢查點抑制治療的研究,但這些臨床研究的樣本量大多小于150例,尚需更大樣本量數據的支持。不同STS亞型之間免疫檢查點阻斷治療效果差異巨大,如遺傳學表現復雜的亞型如UPS和平滑肌肉瘤,這些肉瘤對免疫檢查點抑制劑的反應大。同種亞型的不同患者之間在治療時存在個體差異。目前對STS患者而言,仍缺乏預測性生物標記物,需加大相關基礎研究和臨床試驗的支持,以針對每個STS患者設計個體化治療方案,引導機體產生高效的抗腫瘤免疫反應。在已完成或正在進行驗證的治療方案中,有的方案已經被證明無效,且會增加不良反應,如應用伊匹單抗治療滑膜肉瘤;有的方案則在2個不同的研究中觀察到了相反的結果,如將納武單抗用于治療子宮平滑肌肉瘤。
許多研究采取了免疫檢查點抑制劑治療聯合放化療的治療方案。對于聯合放療的免疫治療而言,放療依托“遠隔效應”可使局部及遠隔病灶都得到控制,有極好的應用前景。然而,直至目前不但沒有聯合放療的臨床研究完成,而且沒有一種放療方案能有效地觸發“遠隔效應”,需要在未來的試驗中繼續對放療劑量、放療形式及其與免疫治療之間的相互影響等進行更加細致的研究。對于化療而言,聯合治療方案中藥物種類,用藥劑量、次序等均會對治療效果產生影響。研究者在這些方向上做出了諸多嘗試,有研究者聯用納武單抗和帕唑帕尼在治療復雜性STS時獲得了不錯的療效,但更多聯用方案的結果是讓人失望的,如伊匹單抗和達沙替尼的聯用(NCT01643278)、帕博利珠單抗和環磷酰胺的聯用(NCT02406781)等。許多研究者將目光投向了聯用免疫檢查點抑制劑與在治療其他惡性腫瘤中表現不錯的藥物,如帕博利珠單抗與溶瘤病毒的聯用(NCT03069378)、納武單抗與NKTR-214的聯用(NCT03282344)、納武單抗和阿扎胞苷的聯用等(NCT03628209)以期取得理想的治療效果。以上臨床研究雖未完成,但其結果是令人期盼的。
總而言之,目前免疫檢查點阻斷療法還存在諸多挑戰,仍需在提高免疫系統對STS的應答、制定患者個體化治療方案和發現預測性生物標記物等方向上進行更多的基礎和臨床嘗試,以期在確保安全性的情況下提高STS患者的免疫治療效果。相信不久的將來,免疫檢查點阻斷療法將會在STS中得到越來越廣泛的應用。

