Fe2+-鄰苯二胺顯色光度法測定過氧乙酸消毒液中過氧乙酸
董 娜,張愛菊,白 瑩,張小林
(甘肅醫學院 藥學系,平涼 744000)
鄰苯二胺(OPD)是一種靈敏性較高的顯色劑[9-11],廣泛用于氧化性物質含量的顯色法測定中,但關于OPD 顯色光度法測定PAA 含量的研究尚未見報道。
因此,本工作通過優化條件,采用該方法測定了PAA 消毒液中的PAA 含量,以期為PAA 消毒液中PAA 含量的準確測定提供參考。
1 試驗部分
1.1 儀器與試劑
UV 1102型紫外-可見分光光度計。
PAA 標準溶液:1 mmol·L-1,移取PAA 質量分數為16%的PAA 消毒液2 mL,加水120 mL,滴加0.01 mol·L-1高錳酸鉀溶液至淺粉色,碘量法標定[8],根據標定結果用水將其稀釋成1 mmol·L-1的PAA 標準溶液,低溫保存。
OPD 溶液:10 g·L-1。
Fe2+溶液:0.01 mol·L-1。
乙酸-乙酸鈉緩沖液:0.1 mol·L-1,pH 為1.5。
然而,作為平民階層中沒有土地財產的底層群體,無產者雖貧窮但并不是奴隸。在古羅馬早期,“平民”(plebs)來源于戰爭中的被征服者和投誠者,沒有宗教、家庭、產業、土地的占有權與繼承權,不受法律保護,也不被列入羅馬“人民”(populus)的范圍。[注]庫朗熱:《古代城邦:古希臘羅馬的祭祀、權利與政制研究》,譚立鑄譯,上海:華東師范大學出版社,2006年,第223-227頁。
高錳酸鉀、鹽酸、乙酸、乙酸鈉、OPD、硫酸亞鐵分別為分析純;PAA 消毒液為市售消毒液;試驗用水為蒸餾水。
1.2 試驗方法
吸取消毒液樣品0.25 mL,加水10 mL,邊攪拌邊滴加0.01 mol·L-1高錳酸鉀溶液至溶液呈穩定的淺粉色,用水定容至500.0 mL,該溶液即為待測液。取待測液5.00 mL 和OPD 溶液5.00 mL混合,加入乙酸-乙酸鈉緩沖液5.00 mL,Fe2+溶液1.50 mL,用水定容至50.00 mL,室溫反應3 min后轉至1 cm 的比色皿中,試劑空白作參比,于檢測波長448 nm 處測量吸光度A。
2 結果與討論
2.1 檢測波長的選擇
按照試驗方法測定了 OPD、OPD-PAA(0.12 mmol·L-1)、OPD-Fe2+-PAA(0.12 mmol·L-1)、OPD-Fe2+-PAA (0.24 mmol·L-1)等4 種體系的吸光度,其吸收光譜見圖1。
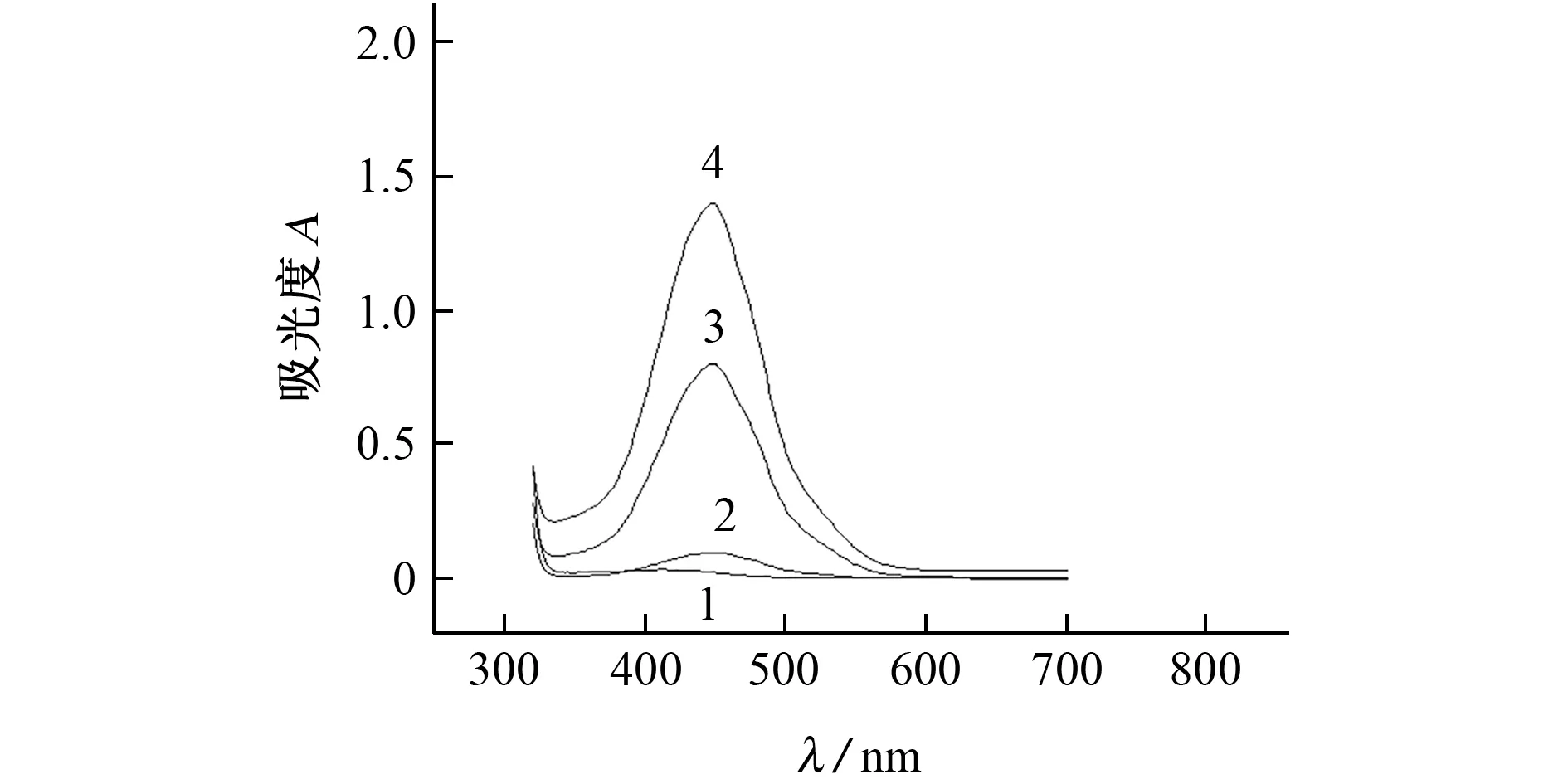
圖1 4種體系的吸收曲線Fig.1 Absorption curves of the 4 systems
由圖1可知:OPD 體系在波長350~600 nm 內無吸收峰(曲線1);當向OPD 體系中加入PAA 后,顯色反應速率極其緩慢,溶液逐步變為淡黃色,在448 nm 處有一弱小的吸收峰(曲線2);當PAA 和Fe2+同步加入到OPD 體系時,顯色反應瞬間發生,生成的橙紅色產物在448 nm 處有最大吸收(曲線3),此體系的摩爾吸光系數(ε)為5.8×103L·mol-1·cm-1,且吸光度隨PAA 濃度增大而增大(曲線4)。因此,試驗選擇檢測波長為448 nm。
2.2 顯色反應條件優化
2.2.1 催化劑的選擇
Fe2+和Fe3+對PAA-OPD 顯色反應均有催化作用,但催化機理存在差異,因此,試驗考察了分別以Fe2+和Fe3+作催化劑時對反應體系吸光度的影響,所得吸收光譜見圖2。
由圖2可知:Fe2+催化體系的吸光度整體偏低,當PAA 標準溶液的添加量為0時,反應體系的吸光度也為0;Fe3+催化體系的吸光度整體偏高,當PAA 的添加量為0 時,吸光度為1.36,這是由于Fe3+既是催化劑,又是氧化劑,在促進PAA 氧化反應的同時,自身也參與了OPD 的氧化反應。相對而言,Fe2+不參與反應,副反應少,顯色穩定性更高,因此,試驗選擇Fe2+作催化劑。
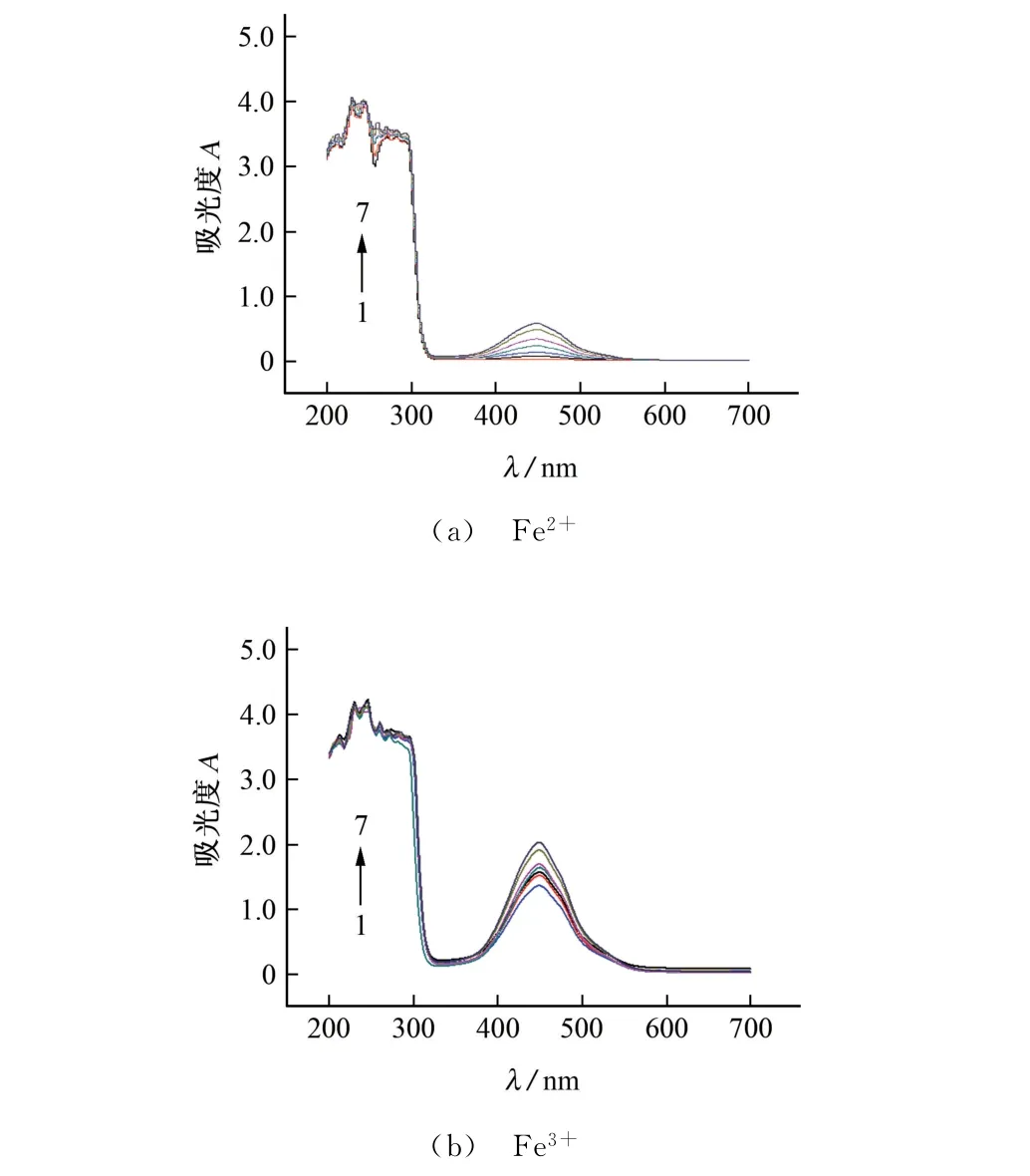
圖2 Fe2+和Fe3+催化作用的比較Fig.2 Comparison of catalysis of Fe2+and Fe3+
為了進一步證明Fe2+對PAA 和OPD 的顯色反應的催化作用,設計了相關試驗,用于計算Fe2+加入前后表觀活化能Ea的變化。具體方法為:按照試驗方法測定反應體系在顯色反應溫度分別為5,10,15,20,25 ℃,顯色反應時間均為1,2 min時的吸光度,建立lg線性回歸方程,并據此計算Fe2+加入前后的表觀化學能Ea1和Ea2。結果顯示:Ea1和Ea2分別為80.21,53.98 kJ·mol-1,Ea2小于Ea1,Fe2+可有效降低OPD 與PAA 顯色反應的表觀活化能,說明Fe2+對反應體系有較強的催化作用。
2.2.2 反應介質酸度的選擇
當PAA 標準溶液的添加量為5 mL時,試驗考察了不同酸度的乙酸-乙酸鈉緩沖液對反應體系吸光度的影響。結果表明:當反應介質的pH 大于4.8時,Fe2+水解,溶液中出現褐色沉淀;當pH 為2.8~4.7時,溶液呈黃色,反應速率較低;當pH 小于2.8時,溶液瞬間變為橙紅色。綜合考慮,試驗選擇乙酸-乙酸鈉緩沖液的pH 為1.5。
2.2.3 Fe2+溶液用量的選擇
試驗考察了Fe2+溶液用量對反應體系吸光度的影響。結果表明:當Fe2+溶液用量小于1.50 mL,體系吸光度隨Fe2+溶液用量的增加而增大;當Fe2+溶液用量大于5.00 mL 時,反應溶液的顏色變淺,吸光度隨Fe2+溶液用量的增大而急劇下降,這是由于過量Fe2+溶液會促使PAA 分解;在Fe2+溶液用量為1.50~5.00 mL 時,吸光度達到最大并保持恒定。綜合考慮,試驗選擇Fe2+溶液用量為1.50 mL。
2.2.4 OPD 溶液用量的選擇
試驗考察了OPD 溶液用量在0~7.00 mL 內時對反應體系吸光度的影響。結果表明:反應體系的吸光度隨OPD 溶液用量的增大而逐漸增大;當OPD 溶液的用量大于等于3.50 mL時,吸光度達到最大并保持恒定。為了確保PAA 和OPD 顯色反應完全和PAA 的測定范圍的拓寬,試驗選擇OPD溶液的用量為5.00 mL。
2.2.5 顯色反應時間的選擇
試驗考察了顯色反應時間分別為0~10 min時對添加有1 mmol·L-1PAA 標準溶液5.00 mL的反應體系吸光度的影響。結果表明:顯色反應速率極快,吸光度在2 min內即可達到最大;4 min后有遞減趨勢,推測可能與OPD 氧化產物降解有關。因此,試驗選擇顯色反應時間為3 min。
2.2.6 顯色反應溫度對顯色反應的影響
試驗考察了顯色反應溫度在25~70 ℃范圍內時對反應體系吸光度的影響。結果表明:在顯色反應溫度低于45℃時,反應體系吸光度隨著顯色反應溫度的升高而緩慢增加,兩者之間基本呈線性關系;當反應溫度超過50 ℃時,兩者之間的線性變差,吸光度變小,這是由于較高的溫度加速了氧的溶解反應和Fe2+的水解反應。與此同時,部分PAA 受熱分解,最終導致OPD 顯色反應不完全。為了降低副反應影響程度,提高顯色體系的穩定性,試驗選擇顯色反應溫度為室溫25 ℃。
2.3 標準曲線和檢出限
移取1 mmol·L-1的PAA 標準溶液0,0.50,1.00,1.50,2.00,3.00,4.00,5.00,7.50,10.00,12.00 mL,按照試驗方法完成顯色反應并測定其吸光度。以PAA 濃度為橫坐標,其對應的吸光度為縱坐標繪制標準曲線。結果表明:PAA 濃度在0.24 mmol·L-1以內與其對應的吸光度呈線性關系,線性回歸方程為y=5.872x+0.011 60,相關系數為0.999 0。
移取1 mmol·L-1PAA 標準溶液0.50 mL,按照試驗方法完成顯色反應并測定其吸光度,平行測定11次,以3倍測定值的標準偏差(s)和標準曲線斜率(k)的比值計算檢出限(3s/k),所得結果為5.0×10-3mmol·L-1。
2.4 樣品分析
以3種PAA 消毒液作為試驗對象[PAA 標示值為15%~20%(質量分數)],按照試驗方法測定其中PAA 含量,并以此為基質進行加標回收試驗,每個樣品平行測定6次,計算測定值的相對標準偏差(RSD)和回收率,結果見表1。
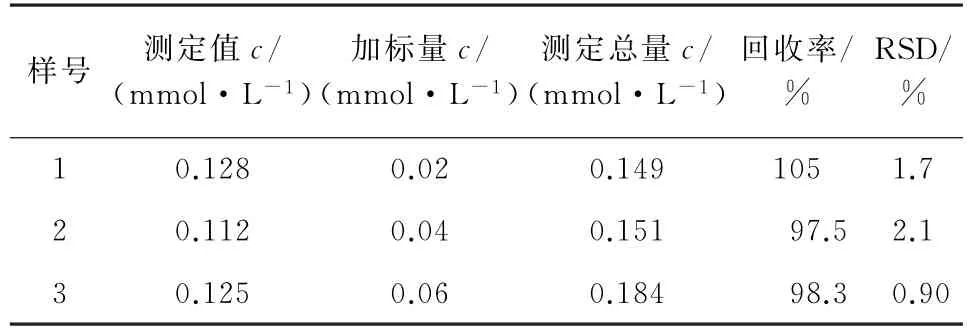
表1 樣品分析結果(n=6)Tab.1 Analytical results of samples(n=6)
由表1可 知:PAA 的RSD 小于2.2%,回收率為97.5%~105%,該方法的精密度和準確度均符合分析的要求。將測定值換算為質量分數,得到3種消毒液中PAA 的質量分數分別為19.40%,16.98%,18.94%,均在標示值范圍內。
本工作采用Fe2+-OPD 顯色光度法測定PAA消毒液中PAA 的含量,該方法簡單快捷、精密度和準確度高,可為相關部門對PAA 消毒液中PAA 含量的監測提供技術支撐。

