單細胞RNA測序在腎臟領域的研究進展
王鑫瑤 鄧振領 王悅
北京大學第三醫院腎內科 100191
傳統的轉錄組學檢測主要對組織或者大量細胞集合體水平進行批量分析,得到的數據是多細胞基因轉錄的總體水平,常常掩蓋了不同細胞之間的差異,很難發現在疾病發展中起重要作用的特定細胞類型。scRNA-seq在單細胞水平分析基因轉錄,實現對細胞類型及其亞型進行全面分類,鑒定出新的細胞類型及特異性基因,還可以通過擬時序(pseudotime)分析推斷出發育過程中細胞的分化軌跡和細胞亞型的演化過程,這些均有助于揭示疾病的發病機制,為臨床診斷和治療提供新思路。本文在闡述scRNA-seq技術在腎臟領域最新研究進展的基礎上,重點對常見的多種腎臟病腎組織中免疫細胞scRNA-seq的研究進展進行綜述。
一、scRNA-seq技術
scRNA-seq技術主要包括單細胞懸液制備、單細胞分離、文庫構建和數據分析4個環節。
1.單細胞懸液制備 制備高質量的單細胞懸液是scRNA-seq成功的關鍵。對于血液等天然單細胞懸液可使用梯度離心法進行單細胞懸液制備[1],而對于腎臟等固體組織需要進行網搓和研磨等機械處理方法和消化酶處理,不同組織解離單細胞所需要的消化酶、消化時間、溫度和濃度不同[2]。在細胞解離過程中加入脫氧核糖核酸酶Ⅰ可減少因細胞裂解而導致的細胞聚集[2],將單細胞懸液經過濾網或過濾器可以去除細胞團、細胞碎片和纖維等雜質。此外,單細胞懸液制備要求及時、快速,以免造成RNA降解和應激相關基因活化[3]。
2.單細胞分離 常見的方法有手工挑取法、流式細胞分選法和微流控技術[4]。手工挑取法在顯微鏡下直視提取單細胞,對實驗人員技術要求高,且提取的細胞可能為非目標細胞;流式細胞分選法可以分選目標細胞,且捕獲量較大,但耗時長,費用大,可能損傷細胞;微流控技術以其高細胞通量、低樣本消耗、低分析成本及精確控制等特點已成為單細胞分離及其cDNA合成的主流手段,2012年以來先后有Fluidigm C1[5]、Drop-seq[6]和InDrop[7]等上市,尤其10×Genomics公司推出的商業化Chromium系統[8]是目前scRNA-seq領域最流行的平臺,廣泛用于單細胞轉錄組的測序[9]。
3.文庫構建 即構建單細胞cDNA文庫,在cDNA擴增前引入UMIs(unique molecular identifiers)或條形碼(barcode)可通過消除聚合酶鏈式反應產生的擴增偏倚,提高數據的準確性及再現性[4]。生成單細胞文庫的方法根據cDNA覆蓋范圍分為產生全長(或接近全長)和產生3′或5′端標簽轉錄序列兩種[10]。目前流行的微流控技術例如Drop-seq[6]和Chromium[8]生成的是3′端標簽數據,且均引入UMIs,具有高通量和低成本的優勢,適用于復雜組織或腫瘤樣本的大量細胞亞群鑒定。
4.數據分析 數據分析是通過軟件、數據庫與算法等進行生物信息學分析[10],是scRNA-seq產出最終研究結果的關鍵,包括預處理和主要分析兩大步驟,其中數據主要分析是scRNA-seq應用的重點內容。常常用于鑒定新的細胞類型和亞群,通過聚類分析產生的細胞亞群用顏色編碼來表示,基因差異程度用距離來表示[11]。將聚類后的細胞亞群進行差異表達分析能確定差異表達基因或標志基因,可反映細胞亞群的特異性[12]。通過擬時序分析單細胞關鍵基因的表達模式可以模擬細胞分化發育的動態過程,在發育研究中應用較廣[13-14]。cDNA全長覆蓋數據還可進行等位基因表達、RNA編輯和可變剪接等分析。(圖1)
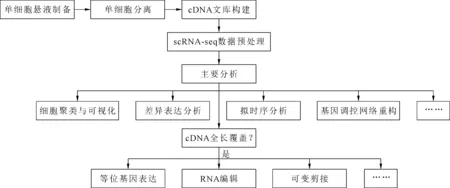
圖1 scRNA-seq流程示意圖
二、scRNA-seq在腎臟領域最新研究進展
(一)發現更多新的細胞亞型及特異性基因
2019年謝靜遠教授[15]綜述scRNA-seq技術在腎臟領域的應用并報道了之前已經發現的細胞類型及亞型,最近又有新的研究報道。其中包括腎小球、腎小管及集合管的細胞亞型及特異性基因,現分述如下。(表1)

表1 小鼠腎臟細胞特異性基因報道匯總
1.腎小球 Karaisko等[16]對健康小鼠腎小球細胞進行scRNA-seq檢測,鑒定出包括足細胞、系膜細胞、內皮細胞在內的腎小球固有細胞、少量免疫細胞及小管細胞,發現了內皮細胞與“細胞黏附”、“細胞成熟”、“應激反應”和“細胞增殖”相關的四個基因亞群,說明內皮細胞存在穩態至激活的不同狀態。同時,研究者還發現了新的細胞特異性基因如足細胞的Wsb2、系膜細胞的Pde3a及內皮細胞的Meis2。Fu等[17]對鏈脲佐菌素誘導的內皮型一氧化氮合酶敲除的糖尿病組小鼠及健康對照組小鼠腎小球細胞進行scRNA-seq,發現了腎小球細胞新的特異性基因如足細胞中的Magi2和Robo2、內皮細胞中Ramp3和Fabp4。Park等[18]通過scRNA-seq建立健康小鼠全腎臟的單細胞轉錄組的圖譜,發現了Cdkn1c和Bcam也可作為足細胞特異性基因。
2.腎小管及集合管 Chen等[19]針對健康小鼠集合管細胞進行scRNA-seq,鑒定出包括主細胞(principle cell,PC)、A型潤細胞(A-intercalated cell,A-IC)和B型潤細胞(B-intercalated cell,B-IC)在內的三種集合管細胞類型,還發現了同時表達PC和IC特異性基因的一種“混合型”細胞類型。有趣的是,Park等[18]也報道一種同時表達PC和IC特異性基因的亞群,通過擬時序分析證實了這種細胞是IC向 PC轉化的中間過渡狀態,定義為“集合管過渡細胞”。此外,Park等[18]還發現了腎小管細胞新的特異性基因如近端小管細胞中的Hnf4a和Slc22a12、遠曲小管細胞中Wnk1和Emx1。
新的細胞亞型及特異性基因的發現使我們進一步了解腎臟結構,并為設計特異性探針提供依據。
3.揭示更多特定細胞類型的功能 Park等[18]試圖分別通過人類單基因遺傳和復雜性狀基因疾病相關基因的表達定位來推斷小鼠腎臟單細胞的功能。他們發現,與人類單基因遺傳有關基因相對應的,大多數蛋白尿同源基因僅在小鼠腎小球足細胞中表達,腎小管酸中毒同源基因僅在IC中表達,而血壓調節同源基因集中表達在遠端小管及集合管細胞中;作為復雜性狀基因疾病,慢性腎臟病相關基因主要在小鼠近端小管細胞中表達,與血漿代謝物水平相關的復雜性狀基因也表達于近端小管細胞,與血壓相關的復雜性狀基因則集中表達于足細胞與集合管細胞中。Wu等[20]將全基因組關聯分析中復雜性狀基因疾病的數據用于分析人類健康腎臟單細胞,發現慢性腎臟病相關基因不僅于近端小管細胞中表達,還富集于足細胞和集合管細胞,血壓相關基因不僅富集于足細胞和集合管細胞,還在系膜細胞中表達。scRNA-seq結合基因組相關分析在腎臟單細胞中的研究有助于推斷特定細胞類型在生理與病理機制方面的作用。
4.腎臟病中腎組織免疫細胞的研究 幾乎所有腎臟疾病都在一定程度上涉及免疫系統的激活,著眼于scRNA-seq在常見的腎臟病腎組織中免疫細胞的研究進展,能更好地了解免疫機制在腎臟疾病發生和發展中的作用,有助于制定新的診療策略。
(1)狼瘡腎炎(lupus nephritis,LN):Der等[21]對LN患者的腎臟和皮膚活檢組織進行scRNA-seq檢測,鑒定出皮膚的角質形成細胞、腎臟的腎小管細胞、皮膚和腎臟均存在的成纖維細胞、內皮細胞及少量T細胞和髓系細胞,發現與健康對照組相比LN患者皮膚角質形成細胞中干擾素(interferon,IFN)誘導的基因如IFI6、IFI27顯著增加,LN患者腎小管細胞中IFN信號的水平與蛋白尿的嚴重程度及治療反應相關,可以為LN針對IFN及其信號通路的治療方法提供分子基礎。Der等[22]還對治療反應不同的LN患者腎小管及角質形成細胞進行scRNA-seq,發現對治療無應答的患者腎小管細胞和角質形成細胞中編碼細胞外基質蛋白的基因如COL1A1等表達上調,這與腎小管間質纖維化是LN預后不良的標志相一致[23]。Arazi等[24]建立了LN腎臟免疫細胞圖譜,包括髓系細胞、B細胞、NK細胞和T細胞等21個免疫細胞亞群,發現這些免疫細胞常常表達趨化因子受體CXCR4和CX3CR1;LN患者尿液中免疫細胞的基因表達與腎組織中免疫細胞如巨噬細胞和T細胞等高度一致。
(2)糖尿病腎病:Fu等[17]對糖尿病組小鼠和健康對照組小鼠進行scRNA-seq,發現糖尿病組小鼠腎小球系膜細胞和足細胞比例減少,而內皮細胞和免疫細胞比例增加,且增加的免疫細胞主要是巨噬細胞,尤其是M1型,提示M1型巨噬細胞可能在糖尿病腎病炎癥反應中起重要作用。
(3)移植腎排斥反應:Wu等[25]對抗體介導的急性排斥反應患者的腎活檢組織和健康對照腎組織共8746個單細胞進行scRNA-seq,鑒定出包括大多數腎臟固有細胞和主要免疫細胞在內共16種細胞,其中CD16+非經典和經典單核細胞兩個亞群在移植腎組織中顯著增加,CD16+非經典單核細胞與樹突細胞成熟相關。由于B-漿細胞簇是目前抗體介導的急性排斥反應治療的主要靶點,研究者還重點分析了B-漿細胞簇,鑒定出免疫球蛋白(immunoglobulin,Ig)低表達的B細胞簇、Ig高表達的多克隆漿細胞簇(成熟B細胞)和產生抗體的Ig高表達的單克隆漿細胞簇,這些發現有助于闡明移植腎急性排斥反應的發生機制。
(4)腎臟腫瘤:腎臟腫瘤中存在免疫細胞浸潤,免疫細胞浸潤的程度是腫瘤預后不良的獨立預測因子[26]。Young等[27]通過scRNA-seq比較了人類腎臟腫瘤、正常胚胎、兒童和成人腎臟單細胞轉錄組,發現Wilms腫瘤細胞起源于異常胚胎細胞,成人腎細胞癌起源于近曲小管細胞SLC17A3+VCAM1+SLC7A13-亞型。Young等[27]還在腎細胞癌組織中發現一類表達血管內皮生長因子A的巨噬細胞,已知血管內皮生長因子信號通路是腎細胞癌的治療靶點之一[28],提示巨噬細胞可能參與腎臟腫瘤的發生發展。
(5)急性腎損傷和腎臟纖維化:do Valle Duraes等[29]通過scRNA-seq建立了小鼠腎臟急性損傷期、修復期和纖維化期三個階段的腎臟免疫細胞圖譜,發現T細胞群是唯一一個在腎損傷早期減少并在損傷晚期顯著增加的細胞群,其中調節性T細胞在損傷早期和纖維化期的作用不同,在損傷早期白細胞介素-2和白細胞介素-33介導的調節性T細胞的增加可保護腎臟免于損傷并延緩纖維化的發展,而在纖維化期調節性T細胞則與促進炎癥反應和細胞凋亡有關。
三、挑戰與展望
scRNA-seq技術的出現和進步無疑帶來生物學領域顛覆性發展,但scRNA-seq仍面臨很多挑戰,高質量單細胞懸液制備和測序深度不足常常導致不能檢測到腎臟全部細胞類型及每個單細胞全部轉錄基因。為了解決該問題,有研究將單核RNA測序與scRNA-seq進行比較,發現單核RNA測序與scRNA-seq相比有相同的基因檢測敏感性,且具有解離偏倚低、可采用冰凍樣本及較低的人為應激反應等優勢[30-31]。但細胞核中的RNA僅占整個細胞RNA的10%~20%[32],不能反映細胞全部轉錄本表達,若將二者聯合有助于更加全面、深入地闡明單細胞基因轉錄情況。隨著單細胞基因測序在腎臟領域的日益擴展和加深,我們能更加理解腎臟細胞構成、功能及其動態演變,以及各種腎臟疾病的發生發展,更好闡明腎臟衰老和腎臟疾病發病機制,并有助于開發新的診斷及治療方法。
利益沖突所有作者均聲明不存在利益沖突

