兩性霉素B抗真菌作用機(jī)制與病原性土曲霉對(duì)其耐藥機(jī)制的研究進(jìn)展
梁天宇,李若瑜,劉偉
北京大學(xué)第一醫(yī)院皮膚性病科,國(guó)家皮膚與免疫疾病臨床醫(yī)學(xué)研究中心,北京大學(xué)真菌和真菌病研究中心,北京市皮膚病分子診斷重點(diǎn)實(shí)驗(yàn)室,北京 100034
侵襲性真菌病(invasive fungal disease, IFD)是一類(lèi)由真菌感染引起的死亡率較高的感染性疾病,多見(jiàn)于骨髓移植受者、實(shí)體器官移植受者、艾滋病患者等免疫功能受損的患者,其臨床預(yù)后有賴于早期診斷和有效的抗真菌藥物治療[1-2]。目前臨床上用于治療IFD的抗真菌藥物有唑類(lèi)、棘白菌素類(lèi)、多烯類(lèi)和氟胞嘧啶。其中,多烯類(lèi)抗真菌藥兩性霉素B(amphotericin B, AMB)自20世紀(jì)50年代問(wèn)世以來(lái),盡管存在嚴(yán)重的腎毒性,但因其抗菌譜廣、耐藥性低,被廣泛用于治療曲霉、隱球菌、假絲酵母(念珠菌)、毛霉、球孢子菌等引起的侵襲性真菌感染(invasive fungal infections, IFIs)[3-4]。為克服其毒副作用,對(duì)AMB進(jìn)行結(jié)構(gòu)改造并發(fā)展出了脂質(zhì)劑型的AMB[5-7],目前已應(yīng)用于臨床實(shí)踐。
病原性土曲霉對(duì)AMB天然耐藥[8],新近還有耐AMB的構(gòu)巢曲霉和黃曲霉引起感染的報(bào)道[9-11]。既往認(rèn)為,AMB通過(guò)直接作用于真菌細(xì)胞膜上的麥角固醇而引起膜通透性增加,最終發(fā)揮抗真菌作用,但詳細(xì)的作用機(jī)制仍然不清楚。最近有學(xué)者在土曲霉對(duì)AMB耐藥性方面進(jìn)行了系列研究[12-17],提出了土曲霉對(duì)AMB耐藥的新機(jī)制,還對(duì)AMB在土曲霉中的作用機(jī)制提出新觀點(diǎn)[13]。這些研究雖然是針對(duì)土曲霉的,但對(duì)于認(rèn)識(shí)AMB在臨床上其他病原性曲霉中的作用機(jī)制和耐藥機(jī)制也具有重要的借鑒意義。本文針對(duì)這方面的研究進(jìn)展進(jìn)行綜述。
1 AMB的殺菌作用機(jī)制
以往認(rèn)為,AMB通過(guò)特異性結(jié)合真菌細(xì)胞膜上重要的脂質(zhì)組分麥角固醇而嵌入細(xì)胞膜中,形成跨膜離子通道(離子通道模型),進(jìn)而導(dǎo)致細(xì)胞膜通透性增加、鉀離子外流發(fā)揮其殺菌活性[18-21];進(jìn)一步研究認(rèn)為,AMB主要通過(guò)在細(xì)胞膜表面直接結(jié)合麥角固醇(表面吸附模型),或通過(guò)聚合形成巨大的膜外聚合物(固醇海綿模型)、從膜磷脂雙分子層中吸附并綁定麥角固醇而發(fā)揮殺真菌作用,而跨膜離子通道的作用較小[22-23];與此同時(shí),AMB形成的膜外聚合物也結(jié)合人體細(xì)胞膜上的膽固醇,這是導(dǎo)致其毒性作用的主要原因[24]。最近研究揭示,AMB通過(guò)影響土曲霉線粒體呼吸鏈功能,導(dǎo)致細(xì)胞內(nèi)源性活性氧(reactive oxygen species, ROS)增加,引起細(xì)胞內(nèi)氧化損傷,從而發(fā)揮其抗真菌作用[25]。
1.1 真菌線粒體呼吸鏈結(jié)構(gòu)
真菌細(xì)胞中線粒體內(nèi)膜包含5個(gè)呼吸鏈膜蛋白復(fù)合體[26-27](見(jiàn)圖1)。
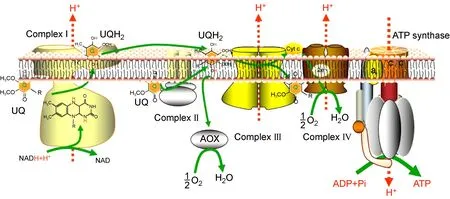
圖1 真菌線粒體電子傳遞鏈模式圖(UQ:泛醌;UQH2:還原性泛醌)
復(fù)合體Ⅰ:還原型煙酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotide,NADH)-泛醌還原酶,由至少35個(gè)亞基構(gòu)成,其中7個(gè)主要亞基為線粒體基因編碼,其余附屬亞基為核基因編碼。這些亞基在線粒體內(nèi)膜上共同參與組裝構(gòu)成復(fù)合體Ⅰ并維持其穩(wěn)定,調(diào)控其活性。復(fù)合體Ⅰ催化NADH的電子傳遞給泛醌,并將質(zhì)子由線粒體基質(zhì)轉(zhuǎn)移至線粒體膜間隙中。
復(fù)合體Ⅱ:又稱琥珀酸-泛醌還原酶,由4個(gè)亞基構(gòu)成,均由核基因編碼,可氧化琥珀酸生成延胡索酸,并將電子傳遞給泛醌,但并不伴隨質(zhì)子轉(zhuǎn)移。
復(fù)合體Ⅲ:泛醌-細(xì)胞色素C還原酶,由10個(gè)亞基組成,其中1個(gè)為線粒體編碼,其余由核基因編碼,其作用是將泛醌攜帶的電子傳遞給細(xì)胞色素C。
復(fù)合體Ⅳ:細(xì)胞色素C氧化酶,由12個(gè)亞基組成,其中4個(gè)亞基為線粒體基因編碼,其余為核基因編碼,其作用是催化氧分子生成水。
復(fù)合體V:即三磷酸腺苷(adenosine-triphosphate,ATP)合成酶,由F0、F1子復(fù)合體構(gòu)成,其作用是利用復(fù)合體Ⅰ、Ⅲ、Ⅳ產(chǎn)生的跨膜質(zhì)子梯度來(lái)合成ATP。
1.2 真菌呼吸鏈上的電子傳遞
來(lái)自NADH的電子經(jīng)由復(fù)合體Ⅰ傳遞給泛醌,來(lái)自琥珀酸的電子經(jīng)由復(fù)合體Ⅱ傳遞給泛醌,泛醌接受復(fù)合體Ⅰ、Ⅱ的電子生成還原性泛醌,并繼續(xù)將電子傳遞給復(fù)合體Ⅲ,復(fù)合體Ⅲ上的電子經(jīng)由細(xì)胞色素C傳遞給復(fù)合體Ⅳ,進(jìn)一步將電子傳遞給氧分子,催化氧分子生成水。復(fù)合體Ⅰ、Ⅲ、Ⅳ在傳遞電子的同時(shí),可將質(zhì)子從線粒體基質(zhì)泵入膜間隙中,在線粒體內(nèi)膜兩側(cè)產(chǎn)生質(zhì)子電化學(xué)梯度,復(fù)合體V利用這一質(zhì)子電化學(xué)梯度催化二磷酸腺苷(adenosine diphosphate,ADP)和無(wú)機(jī)磷酸生成ATP[28]。同時(shí),復(fù)合體Ⅰ、Ⅱ、Ⅲ也是產(chǎn)生ROS的主要部位[29-30]。
除上述經(jīng)典呼吸鏈上的復(fù)合體Ⅰ~Ⅳ外,土曲霉線粒體氧化磷酸化系統(tǒng)中還存在一類(lèi)替代氧化酶(alternative oxidase, AOX),包括AOX1和 AOX2,由核基因編碼。AOX位于線粒體內(nèi)膜,可繞過(guò)復(fù)合物Ⅲ和Ⅳ而接受復(fù)合體Ⅰ、Ⅱ傳遞給泛醌的電子,從而將氧還原為水,但較少生成ROS;這一替代氧化過(guò)程并不伴隨質(zhì)子的跨膜轉(zhuǎn)移,因此較少產(chǎn)生ATP[27]。
真菌在高能量需求或指數(shù)生長(zhǎng)期時(shí),由經(jīng)典復(fù)合體Ⅰ~Ⅳ途徑進(jìn)行電子傳遞,可產(chǎn)生大量ATP滿足生長(zhǎng)需要;而在低能量需求或穩(wěn)定生長(zhǎng)階段,則由AOX替代途徑進(jìn)行電子傳遞,生成水和極少量ATP,ROS生成也少[35-36]。
1.3 AMB對(duì)真菌線粒體呼吸鏈的作用
經(jīng)AMB作用的敏感土曲霉(susceptibleAspergillusterreus, ATS)產(chǎn)生大量?jī)?nèi)源性ROS,菌落生長(zhǎng)受到明顯抑制[12],這種情況在對(duì)AMB敏感的煙曲霉[37]和念珠菌[38]中亦可見(jiàn)到;抗氧化劑N-乙酰半胱氨酸(N-acetylcysteine, NAC)為非特異性巰基供體,可清除ROS,發(fā)揮抗氧化作用[39];聯(lián)合使用NAC和AMB可降低內(nèi)源性ROS累積水平,并使AMB對(duì)ATS的最小抑菌濃度(minimum inhibitory concentration, MIC)升高,提示AMB通過(guò)引起ATS產(chǎn)生內(nèi)源性ROS而發(fā)揮抗真菌作用。進(jìn)一步研究發(fā)現(xiàn),AMB作用的ATS中,分別以ndufs1(復(fù)合體Ⅰ亞基)、sdhc(復(fù)合體Ⅱ亞基)、cytc1(復(fù)合體Ⅲ亞基)、cox15(復(fù)合體Ⅳ亞基)基因的轉(zhuǎn)錄水平代表的復(fù)合體Ⅰ、Ⅱ、Ⅲ、Ⅳ表達(dá)水平均明顯增加,表明AMB可以促進(jìn)復(fù)合體Ⅰ~Ⅳ的表達(dá),增強(qiáng)線粒體呼吸鏈的功能。利用抑制劑萎銹靈(復(fù)合體Ⅱ抑制劑)、抗霉素A(復(fù)合體Ⅲ抑制劑)、氰化鉀(復(fù)合體Ⅳ抑制劑)分別抑制復(fù)合體Ⅱ、Ⅲ、Ⅳ時(shí),并未影響ATS對(duì)AMB的敏感性,但利用魚(yú)藤酮(復(fù)合體Ⅰ抑制劑)抑制復(fù)合體Ⅰ后可使AMB的MIC升高[12],AMB引起的內(nèi)源性ROS的產(chǎn)生明顯降低。
綜上所述,AMB可增強(qiáng)線粒體復(fù)合體Ⅰ、Ⅱ、Ⅲ、Ⅳ的功能,并通過(guò)增強(qiáng)復(fù)合體Ⅰ的功能促進(jìn)內(nèi)源性ROS產(chǎn)生,從而發(fā)揮抗真菌作用。
2 病原真菌對(duì)AMB的耐藥機(jī)制
2.1 麥角固醇合成途徑中基因的作用
已報(bào)道白念珠菌、光滑念珠菌、新型隱球菌、土曲霉、黃曲霉、煙曲霉等對(duì)AMB可產(chǎn)生耐藥性[3]。在酵母菌中,麥角固醇合成途徑中的一系列基因的缺失或突變(包括erg1、erg2、erg3、erg4、erg6和erg11等)[40]可影響細(xì)胞膜上固醇類(lèi)的生物合成,進(jìn)而導(dǎo)致細(xì)胞膜上麥角固醇含量減少,由于缺乏可替代的中間產(chǎn)物供AMB靶向結(jié)合,從而導(dǎo)致對(duì)AMB耐藥[3]。譬如,Vincent等[41]通過(guò)全基因組測(cè)序發(fā)現(xiàn),臨床分離的耐AMB的白念珠菌存在erg2或erg6突變,熱帶念珠菌存在erg3和erg11雙突變,通過(guò)分別構(gòu)建上述基因定向敲除菌株,證明上述erg基因突變可導(dǎo)致對(duì)AMB耐藥。
但是,Blum等[13-14]發(fā)現(xiàn)臨床分離的ATS、AMB天然耐藥株(resistantAspergillusterreus, ATR)及對(duì)AMB敏感的煙曲霉(susceptibleAspergillusfumigatus, AFS)菌株細(xì)胞膜麥角固醇的含量并無(wú)差異,提示土曲霉對(duì)AMB耐藥的機(jī)制與麥角固醇含量無(wú)關(guān),與上述酵母菌中的情況不同。
2.2 熱休克蛋白的作用
熱休克蛋白90(heat shock protein 90, Hsp90)是廣泛存在于真核細(xì)胞中的進(jìn)化上高度保守的分子伴侶蛋白,由N端結(jié)構(gòu)域(amino-terminal domain, NTD)、中間結(jié)構(gòu)域(middle domain, MD)、C端結(jié)構(gòu)域(carboxy-terminal domain, CTD)及MEEVD(Met-Glu-Glu-Val-Asp)基序組成,其中:NTD負(fù)責(zé)結(jié)合ATP;MD負(fù)責(zé)結(jié)合客戶蛋白(client proteins)并幫助后者正確折疊,形成成熟、穩(wěn)定的構(gòu)象;CTD負(fù)責(zé)形成Hsp90二聚體;而MEEVD基序則主要結(jié)合共伴侶分子(co-chaperones),后者可以輔助客戶蛋白的正確折疊。在釀酒酵母中,Hsp90可以與約10%的蛋白相互作用[42-43],通過(guò)調(diào)節(jié)其客戶蛋白如轉(zhuǎn)錄因子、激酶及其他信號(hào)轉(zhuǎn)導(dǎo)因子的折疊、轉(zhuǎn)運(yùn)、成熟和降解,從而廣泛參與細(xì)胞內(nèi)信號(hào)通路的調(diào)節(jié)以及適應(yīng)性表型的產(chǎn)生和維持[43]。
Hsp90可通過(guò)MD結(jié)構(gòu)域直接與其客戶蛋白鈣調(diào)磷酸酶(calcineurin)的催化亞單位相互作用,幫助后者維持構(gòu)象穩(wěn)定。鈣調(diào)磷酸酶是一種Ca2+-鈣調(diào)蛋白(calmodulin, CaM)調(diào)節(jié)的絲氨酸/蘇氨酸蛋白磷酸酶,在菌絲生長(zhǎng)、刺激適應(yīng)、菌核和附著孢發(fā)育及胞壁完整性的調(diào)節(jié)中發(fā)揮重要作用[44-45]。在大多數(shù)絲狀真菌中[46-48],鈣調(diào)磷酸酶是由一個(gè)催化亞基CnA和一個(gè)調(diào)節(jié)亞基CnB構(gòu)成的異二聚體,CnA亞基包含催化結(jié)構(gòu)域(catalytic domain)、 CnB結(jié)合域(CnB binding domain)、 CaM結(jié)合域(CaM binding domain)和自身抑制域(auto-inhibitory domain, AID)共4個(gè)結(jié)構(gòu)域;CnB亞基是一種Ca2+結(jié)合蛋白,結(jié)合Ca2+后可形成緊密構(gòu)象,引起CnA亞基中AID及催化結(jié)構(gòu)域的構(gòu)象變化和活性位點(diǎn)暴露,幫助其發(fā)揮催化功能。
Cowen等[49]證明Hsp90通過(guò)快速選擇機(jī)制,在多種真菌耐藥突變及表型的產(chǎn)生和維持過(guò)程中發(fā)揮重要作用,但不同種的真菌影響的藥物種類(lèi)不同:抑制Hsp90或calcineurin可明顯降低由臨床分離的白念珠菌對(duì)氟康唑和伏立康唑的耐藥性,但其對(duì)卡泊芬凈的敏感性無(wú)明顯影響;相反,抑制Hsp90或calcineurin可明顯降低土壤中分離的土曲霉菌株對(duì)卡泊芬凈的耐藥性,但并未影響其對(duì)氟康唑的耐藥性。在體外,Hsp90抑制劑格爾德霉素(geldanamycin)或其衍生物17-dimethylaminoethylamino-17-demethoxygeldanamycin (17-DMAG)與AMB具有協(xié)同作用,可顯著降低 AMB 對(duì) ATR 的MIC;AMB與鈣調(diào)磷酸酶抑制劑環(huán)孢素A聯(lián)用也具有相似的作用;與AFS相比,ATR和ATS具有更高的Hsp90基礎(chǔ)表達(dá)水平,這一點(diǎn)可能使土曲霉對(duì)AMB引起的細(xì)胞膜應(yīng)激和環(huán)境變化具有更強(qiáng)的適應(yīng)性[15],說(shuō)明Hsp90或鈣調(diào)磷酸酶活性增強(qiáng)促進(jìn)了土曲霉對(duì)AMB所致應(yīng)激的適應(yīng)性。
熱休克蛋白70(heat shock protein 70, Hsp70)家族是另一類(lèi)與Hsp90共同組成細(xì)胞內(nèi)監(jiān)視網(wǎng)絡(luò)的分子伴侶,除古生菌外在所有物種中高度保守,其家族成員N端均含有高度保守的核苷酸結(jié)合結(jié)構(gòu)域(NBD)及位于C端的序列多變的底物結(jié)合結(jié)構(gòu)域[16]。相比于Hsp90,Hsp70的靶蛋白更加龐雜,且可以與未折疊、錯(cuò)誤折疊及相互聚集的底物蛋白相互作用,幫助其正確折疊并維持蛋白質(zhì)的穩(wěn)定性[50]。當(dāng)體外暴露于AMB的ATR中,Hsp70家族成員ssa和ssb的量在轉(zhuǎn)錄水平和蛋白質(zhì)水平均顯著升高;利用抑制劑pifithrin-μ抑制Hsp70后,AMB對(duì)ATR的MIC明顯降低(從≥32 μg/mL降至 ≤1 μg/mL);聯(lián)合使用AMB和pifithrin-μ治療感染ATR的大蠟螟,可改善療效,提高生存率[16],也證實(shí)了這種協(xié)同作用。 Hsp70活性增強(qiáng),可促進(jìn)AMB的耐藥性;而抑制Hsp70活性可作為治療ATR引起侵襲性曲霉病的潛在研究方向。
2.3 線粒體氧化磷酸化系統(tǒng)的作用
比較ATS和ATR時(shí)發(fā)現(xiàn):未暴露于AMB時(shí),ATS的基礎(chǔ)耗氧速率是ATR的3.3倍,其線粒體拷貝數(shù)更高(高約23%),生長(zhǎng)速度更快[12],毒力更強(qiáng)[51-52],這與敏感菌株生長(zhǎng)快、毒力強(qiáng)的描述是一致的[41];暴露于AMB時(shí),ATS的線粒體拷貝數(shù)進(jìn)一步增加,內(nèi)源性ROS大量產(chǎn)生,而ATR的線粒體拷貝數(shù)進(jìn)一步減少,內(nèi)源性ROS產(chǎn)生水平更低[12]。由于線粒體拷貝數(shù)的多寡與線粒體呼吸鏈活性高低一致,因此當(dāng)ATR中線粒體拷貝數(shù)減少時(shí),其耗氧速率降低,相應(yīng)地內(nèi)源性ROS生成減少,從而導(dǎo)致耐藥性增強(qiáng)。
進(jìn)一步研究發(fā)現(xiàn)[12],暴露于AMB的ATS線粒體復(fù)合體Ⅰ表達(dá)水平顯著升高,aox表達(dá)水平輕度升高,ROS的生成增多;暴露于AMB的ATR的線粒體復(fù)合體Ⅰ表達(dá)水平僅輕度升高,而AOX表達(dá)水平顯著升高,ROS的生成相對(duì)減少。如前所述,復(fù)合體Ⅰ活性的降低可減少ATS中ROS的生成,AOX高表達(dá)也可能參與抑制ROS生成[35-36];進(jìn)一步利用水楊羥肟酸(salicylhydroxamic acid, SHAM)抑制ATR中AOX的活性,則內(nèi)源性ROS水平明顯增加、AMB的MIC明顯下降[12],再次提示AOX的高表達(dá)可導(dǎo)致ATR中ROS生成減少,產(chǎn)生耐藥性,因此AOX可作為抗真菌藥物的潛在靶點(diǎn)。
總之,AMB通過(guò)增強(qiáng)呼吸鏈經(jīng)典途徑中線粒體復(fù)合體Ⅰ的功能而促進(jìn)真菌細(xì)胞產(chǎn)生內(nèi)源性ROS,最終發(fā)揮抗真菌作用。暴露于AMB的ATR中,呼吸鏈經(jīng)典途徑中線粒體復(fù)合體Ⅰ表達(dá)水平僅輕度升高,不及ATS中顯著;而替代途徑AOX功能顯著增強(qiáng),內(nèi)源性ROS生成相對(duì)減少,最終產(chǎn)生耐藥性。
2.4 ROS清除系統(tǒng)的作用
ROS是真核細(xì)胞呼吸鏈過(guò)程中產(chǎn)生的有害物質(zhì),及時(shí)清除ROS對(duì)于維持其正常的生命活動(dòng)具有重要作用。真核細(xì)胞中存在多種ROS 清除系統(tǒng),包括超氧化物歧化酶(superoxide dismutase, SOD)、過(guò)氧化氫酶(catalase, CAT)、谷胱甘肽過(guò)氧化物酶(glutathione peroxidase, GPX)等。當(dāng)細(xì)胞內(nèi)源性ROS生成增多引起氧化應(yīng)激時(shí),可誘導(dǎo)上述ROS清除酶的表達(dá),減少細(xì)胞內(nèi)的氧化損傷[26]。
研究表明,未暴露于AMB時(shí)[52],ATR中SOD的活性約為ATS中的2倍,而CAT 表達(dá)水平無(wú)明顯差異,說(shuō)明ATR較ATS清除ROS的能力更強(qiáng);暴露于AMB后,ATS中SOD和CAT的表達(dá)水平無(wú)明顯變化,但在ATR中均明顯增加,說(shuō)明AMB可促使ATR增強(qiáng)對(duì)ROS的清除能力。利用抑制劑N,N-二甲基二硫代氨基甲酸(N-N-diethyldithiocarbamate, DDC)和3-氨基-1,2,4-三氮唑(3-amino-1,2,4-triazole, 3-AT)分別抑制SOD和CAT的活性,均可使ATR中內(nèi)源性ROS水平明顯增加,AMB的MIC降至敏感水平;且在ATS中,抑制SOD或CAT可使AMB的MIC進(jìn)一步降低。總之,ATR中SOD和CAT活性增強(qiáng),可快速清除內(nèi)源性ROS,是ATR對(duì)AMB耐藥的可能機(jī)制之一;且抑制真菌SOD和CAT活性,可作為潛在的抗真菌治療靶點(diǎn)。
3 結(jié)語(yǔ)
如圖2總結(jié)所示,AMB的抗真菌作用機(jī)制包括:①AMB直接結(jié)合真菌細(xì)胞膜麥角固醇和(或)形成細(xì)胞膜離子通道,破壞真菌細(xì)胞膜結(jié)構(gòu)的完整性,影響細(xì)胞內(nèi)外離子水平和滲透壓改變;②AMB增加土曲霉線粒體拷貝數(shù),增強(qiáng)線粒體呼吸鏈經(jīng)典途徑中復(fù)合體Ⅰ的活性,產(chǎn)生大量?jī)?nèi)源性ROS,從而引起真菌細(xì)胞的氧化損傷。
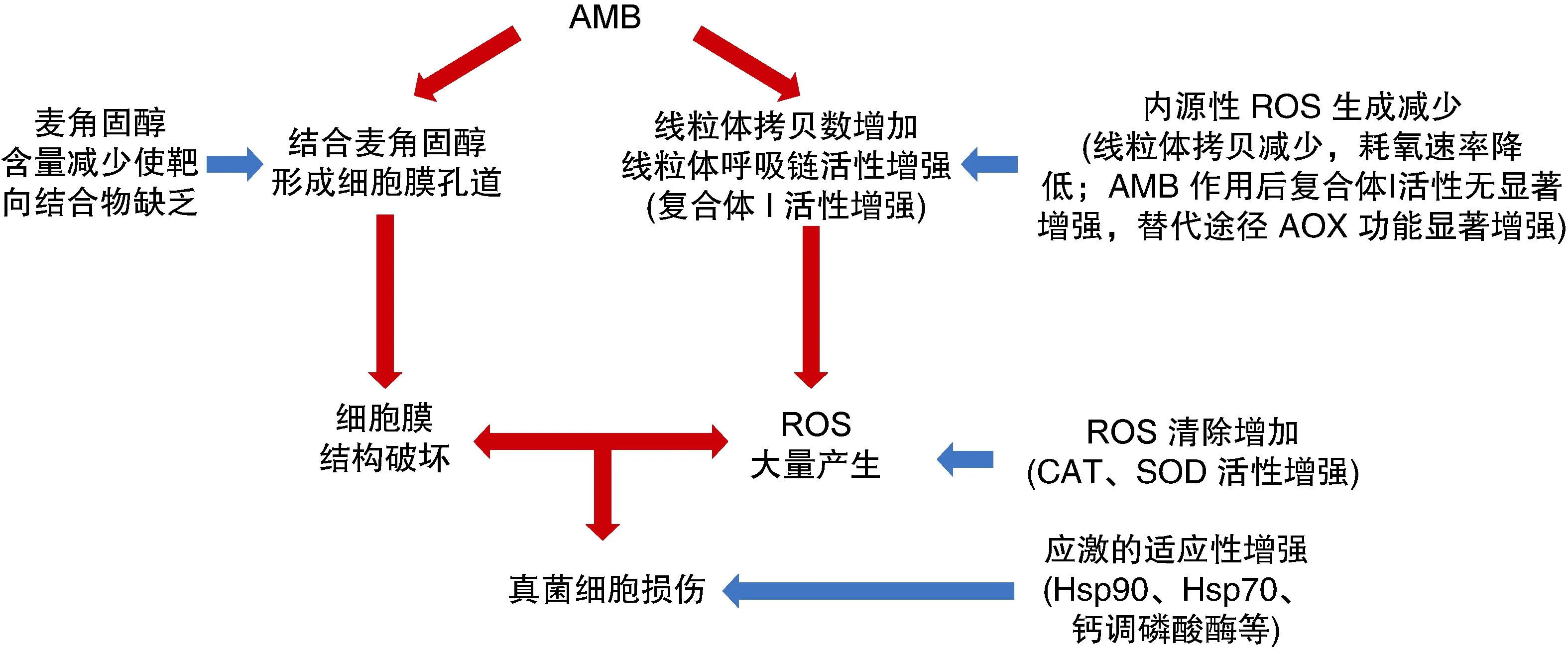
圖2 AMB抗真菌作用機(jī)制和耐藥機(jī)制(紅色箭頭代表作用機(jī)制,藍(lán)色箭頭代表耐藥機(jī)制)
病原真菌對(duì)AMB的耐藥機(jī)制包括:①酵母中麥角固醇合成途徑基因突變或缺失,導(dǎo)致細(xì)胞膜麥角固醇含量減少而使靶向結(jié)合物缺乏;②土曲霉中分子伴侶Hsp90、鈣調(diào)磷酸酶及Hsp70的活性升高,增強(qiáng)了其對(duì)AMB所致應(yīng)激的適應(yīng)性;③土曲霉線粒體拷貝數(shù)減少,耗氧速率降低,內(nèi)源性ROS生成減少;④土曲霉經(jīng)AMB作用后,呼吸鏈經(jīng)典途徑中線粒體復(fù)合體Ⅰ活性無(wú)顯著升高,同時(shí)替代途徑AOX功能顯著增強(qiáng),內(nèi)源性ROS生成減少;⑤土曲霉ROS清除酶CAT、SOD活性增強(qiáng)所致的內(nèi)源性ROS清除增強(qiáng)。

