優化的供者來源細胞游離DNA 檢測方法的初步運用
朱代文,范鈺,巫麗娟,王雨姍,林濤 (.四川大學華西醫院泌尿外科/泌尿外科研究所,國家老年疾病臨床醫學研究中心,器官移植中心,四川 成都 6004;.四川大學華西醫院實驗醫學科,四川 成都 6004)
器官移植是治療器官功能衰竭患者的有效外科手段,賢移植由于其開展最早、發展最快、技術和管理最成熟,目前已經成為終末期賢臟疾病(end stage renal disease, ESRD)的最優治療方法[1-3]。當受者出現移植賢功能不全時,為明確病因,常需要進行移植賢穿刺活檢(診斷的金標準)[4-5]。然而移植賢穿刺活檢有一定的創傷性和出血風險,且病理結果報告延時性較長(常為1 周),為臨床早診斷早治療帶來較大的困難。
移植物在發生損傷時,其供者來源細胞游離DNA(donor-derived cell-free DNA,dd-cfDNA)會游離釋放到血液或尿液中。由于dd-cfDNA 序列與移植受者自身的DNA 序列存在差異,通過檢測體液中dd-cfDNA 的含量,可以反映出移植物受損傷的情況[6]。目前在國際上已有多項研究采用dd-cfDNA 來檢測移植賢的健康狀態,發現dd-cfDNA 在排斥反應的診斷中表現出優秀的診斷效能,特別是在診斷抗體介導的排斥反應方面,其敏感度、特異度和受試者工作特征曲線下面積分別達到了0.84,0.80 和0.89[7]。對dd-cfDNA的檢測主要有兩種方法:隨機測序法或靶向供受者cfDNA 差異法[8],目前多采用靶向供受者cfDNA 差異法,涉及到采用第二代測序技術(nextgeneration sequencing,NGS)或微滴式數字聚合酶鏈式反應(droplet digital polymerase chain reaction,ddPCR)。NGS 準確度非常高,但檢測費用也非常昂貴,而ddPCR 不僅準確度有保證,而且可以提供dd-cfDNA 的絕對定量。現在已經有商品化的依賴于NGS 平臺或ddPCR 平臺的dd-cfDNA 檢測試劑盒[9],但因其費用昂貴(約4000 ~8000 元/樣),而且所檢測的單核苷酸多態性(single nucleotide polymorphism,SNP)位點是依據國外人群來制定的,從而限制了國內臨床的廣泛運用。
我們前期通過整合目前國內外dd-cfDNA 的檢測方法,根據中國人群SNP 位點特色,優化選擇了8 個SNP 位點形成了一種高性價比的dd-cfDNA的檢測方法(約1200 元/樣)。本研究擬通過初步臨床試驗,明確該方法的臨床實用性。
1 資料與方法
1.1 dd-cfDNA 檢測材料:經四川大學華西醫院倫理委員會批準,研究從四川大學華西醫院標本庫無差別獲取同種異體賢移植術受者的血樣,包括有圍術期賢移植受者的血樣和明確診斷為活動性抗體介導排斥反應(active antibody mediated rejection,ABMR)受者的血樣。血樣質控合格樣本納入研究進行dd-cfDNA 含量測定。本研究獲四川大學華西醫院倫理委員會審批通過,倫理批號為2020-063。測定用的主要耗材有:優化選擇的8 個SNP 位點形成的dd-cfDNA 檢測試劑盒(Panel HX-8),細胞游離DNA 保存管 (KJ1002DNA,江蘇康健公司),cfDNA 提取試劑(RC1101,廈門愷碩公司)。
1.2 dd-cfDNA 檢測方法:受者血樣經1600×g 離心10 min 后取血漿,再在低溫高速離心機(Heraeus 75004250,美國賽默飛公司)中以16 000×g 離心10 min 后取血漿進行cfDNA 提取。后在ddPCR 檢驗平臺(D040101,D050101,D010103,杭州領航公司)上用Panel HX-8 對dd-cfDNA 進行檢測,計算出dd-cfDNA 含量百分比(%)。
1.3 臨床資料收集和分析:回顧性收集納入研究血樣所對應受者的臨床資料。其中圍術期受者,根據其術后血清肌酐 (serum creatinine,Scr)下降情況,分為4 組(具體分組標準見表1):移植物功能迅速恢復組(immediate graft function,IGF)、移植物功能緩慢恢復組(slow graft function,SGF)、移植物功能延遲恢復組(delayed graft function,DGF 組)和Scr 反彈組(creatinine elevation,CE 組)。
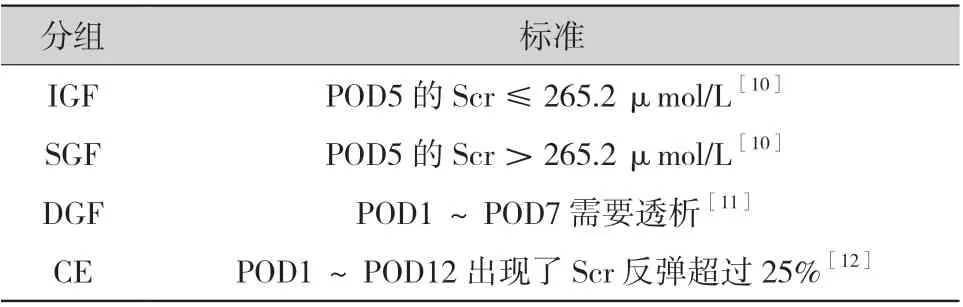
表1 圍術期受者分組方法
1.4 統計學分析:采用SPSS 25.0 統計學軟件進行數據處理。計量資料采用均數±標準差(±s)表示,組間比較使用t 檢驗,同組間前后比較使用配對t 檢驗。P <0.05 認為差異有統計學意義。
2 結 果
本研究共獲取合格血樣共330 份,來自于2020 年3 月至2021 年5 月于四川大學華西醫院就醫的84 例同種異體賢移植圍術期的受者和3 例經移植賢穿刺活檢確診為ABMR 的受者。84 例圍術期受者中,有61 例受者供賢是來源于腦死亡后捐獻(donation after brain death,DBD)供者,23 例供賢來源于活體捐獻(living donation,LD)供者。
圍術期受者中,IGF 組73 例,SGF 組4 例,DGF 組2 例,CE 組5 例。 受者平均年齡為(31.7±11.3)歲,女性占比28.6%(24/60),一般情況見表2,Scr 和dd-cfDNA 的變化見表3。其中,IGF 組受者術后1 d(postoperative day 1,POD1)、POD3、POD5、POD7 和POD12 的平均Scr 分別為:(448.0±200.2) μmol/L、(161.5±70.8 )μmol/L、(126.4±44.3) μmol/L、(116.2±33.7) μmol/L 和(115.4±38.2) μmol/L, 成指數型下降,Scr 在POD7 達到谷平臺值(圖1A);相一致的,IGF 組POD1、POD3、POD5 和POD7 的dd-cfDNA 也呈指數型下降:4.0%±3.3%、1.4%±2.3%、0.8%±1.5%和0.9%±1.5%,dd-cfDNA 在POD5 達到谷平臺值(圖1B)。SGF 組POD1 的dd-cfDNA 顯著高于IGF 組(28.5%±38.8%比4.0%±3.3%,P =0.003)(圖1B),DGF 組POD1 的dd-cfDNA 在數值上也較IGF 組高 (9.9%±1.8%比4.0%±3.3%,P =0.083)(圖1B)。雖然POD3、POD5 和POD7 的dd-cfDNA各組間差異無統計學意義(P >0.05),但DGF組POD3 的平均dd-cfDNA 在數值上大于IGF 組(3.7%±1.1%比1.4%±2.3%,P =0.064)(圖1B)。在CE 組中,POD12 的Scr 在數值上大于POD7(150.8±25.9 μmol/L 比118.6±22.0 μmol/L,P =0.171)(圖1A),POD7 的dd-cfDNA 在數值上大于POD5 (5.4%±9.6% 比1.4%±0.9%,P =0.064)(圖1B)。
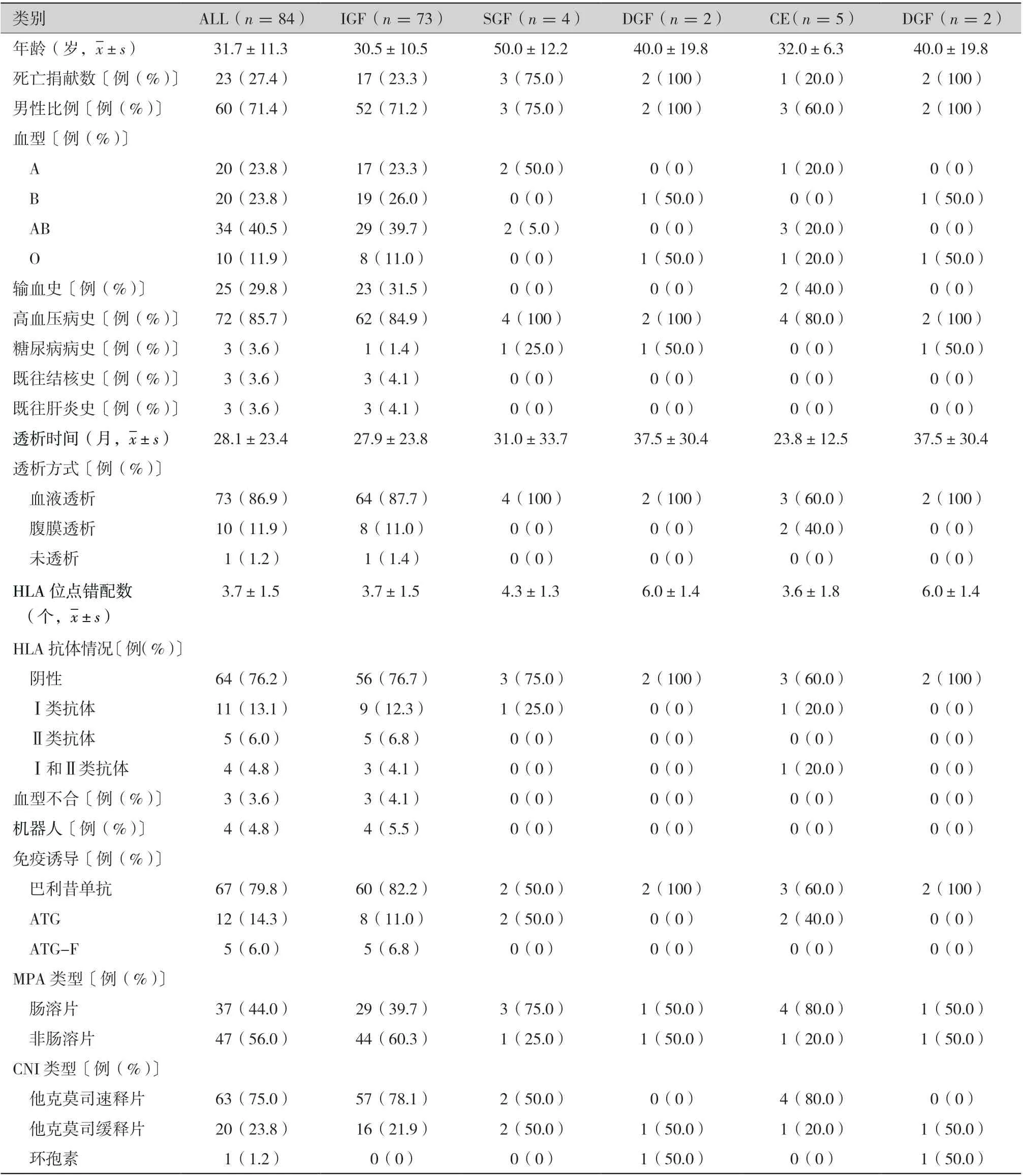
表2 圍術期受者的基線特征
表3 受者Scr 與dd-cfDNA(±s)

表3 受者Scr 與dd-cfDNA(±s)
注:Scr IGF 為IGF 組的Scr;dd-cfDNA IGF:IGF 組的dd-cfDNA。
類別POD1POD3POD5POD7POD12治療前治療后Scr IGF(μmol/L)448.0 ± 200.2161.5 ± 71.8126.4 ± 44.3116.2 ± 37.7115.4 ± 38.2 Scr SGF(μmol/L)894.6 ± 246.3 699.0 ± 108.9 629.0 ± 108.0486.3 ± 46.3334.0 ± 255.0 Scr DGF(μmol/L)974.0 ± 347.9705.0 ± 50.9680.0 ± 75.0527.5 ± 153.4330.5 ± 89.8 Scr CE(μmol/L)413.6 ± 224.5145.0 ± 43.5121.6 ± 27.5118.6 ± 22.0150.8 ± 25.9 Scr ABMR(μmol/L)127.3 ± 3.1110.0 ± 7.5 dd-cfDNA IGF(%)4.0 ± 3.31.4 ± 2.30.8 ± 1.50.7 ± 0.6 dd-cfDNA SGF(%)28.5 ± 38.82.7 ± 4.70.5 ± 0.40.5 ± 0.3 dd-cfDNA DGF(%)9.9 ± 1.83.7 ± 1.11.3 ± 0.80.4 ± 0.1 dd-cfDNA CE(%)6.2 ± 8.24.4 ± 6.91.4 ± 0.95.4 ± 9.6 dd-cfDNA ABMR(%)4.2 ± 2.00.6 ± 0.1
3 例ABMR 受者均采用激素沖擊、血漿置換和靜注人丙種球蛋白治療。在接受治療前的Scr 分別為130 μmol/L、128 μmol/L 和124 μmol/L(圖1C),dd-cfDNA 分別為2.1%、4.4%和6%;治療后的Scr 分別為111 μmol/L、117 μmol/L 和102 μmol/L,dd-cfDNA 分別為0.7%、0.7% 和0.5%(圖1C)。
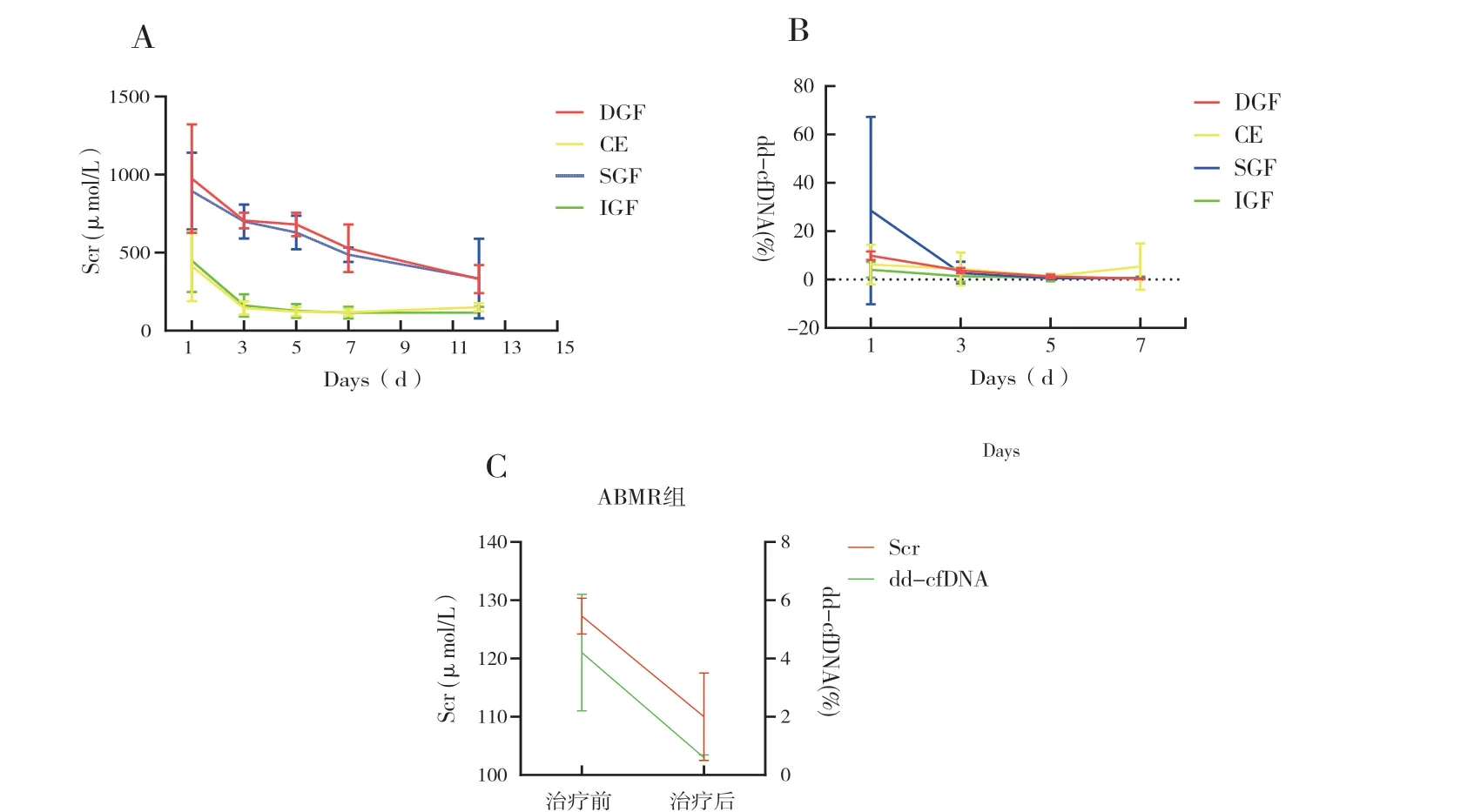
圖1 IGF、SGF、DGF、CE、ABMR 組的Scr 和dd-cfDNA
3 討 論
移植器官在圍術期間容易受到免疫損傷、缺血/再灌注損傷(ischemia reperfusion injury,IRI)、藥物毒性和手術并發癥相關的許多急性損傷[13-16],在術后至長期隨訪過程中也面臨著排斥反應、原發病復發、感染等損傷可能[17-18]。因此如何及時、準確地判斷移植物的狀態,根據損傷病因選擇有效的治療是保證移植物長期存活的關鍵因素。雖然臨床上采用Scr 來反映賢臟功能,但Scr 的變化并不能特異性地反映出移植物損傷的情況。當Scr 出現上漲有可能只是一個短暫的過程,例如鈣調神經磷酸酶抑制劑濃度過高導致的移植賢血流動力學改變,或者賢前性血容量不足[19]。而且損傷導致Scr 升高時,移植賢往往已經發生了較嚴重的損傷[20]。組織病理學檢查是判斷移植物損傷的金標準,有許多移植中心采用程序性活檢的方式來定期監測移植物狀態[21-22]。但穿刺活檢需受者住院行有創的穿刺操作,整體費用較高,且據文獻報道移植賢穿刺活檢的并發癥發生率為2.9%~5.8%[23],限制了其臨床廣泛應用。由于這些不足,研究者一直在尋找更為特異的無創生物標記物來監測移植物的健康狀況,dd-cfDNA 的檢測就是其中一個迅速興起的領域。
雖然dd-cfDNA 最初是被當作一種排斥反應的無創標記物來進行研究,但很快就發現dd-cfDNA實質上是一種反映移植物損傷的標記物,而導致損傷最常見原因是排斥反應[24]。據目前文獻所報道的數據表明,dd-cfDNA 在檢測排斥反應方面具有優秀的整體診斷性能,用dd-cfDNA 百分比來診斷排斥反應的靈敏度為80%,特異度為76%,ROC 曲線下面積為0.81[25-26]。值得一提的是,dd-cfDNA 百分比的陰性預測值達到了90%,這提示在臨床應用中,如果dd-cfDNA 在低于界定值時(通常為1%)可以考慮排除移植物發生損傷,例如ABMR[27]。在本研究中,ABMR 受者在治療前平均dd-cfDNA 為4.2%,經過治療后平均dd-cfDNA下降到了0.6%。dd-cfDNA 的下降,反映了針對ABMR 進行治療明顯緩解了移植賢的損傷。另外,本研究中也發現IGF 組受者的dd-cfDNA 從POD1的4.0%快速下降到POD5 的0.8%,比Scr 更快達到谷平臺值,dd-cfDNA 的下降情況可能比Scr 的下降情況更敏感地反映出移植賢的快速康復。相對應的,CE 組的平均Scr 從POD7 的118.6 μmol/L 上漲到了POD12 的150.8 μmol/L,而平均dd-cfDNA則是更早的從POD5 的1.4%上漲到了POD7 的5.4%,也提示dd-cfDNA 比Scr 更加靈敏。在圍術期,1 例CE 組的受者行移植賢穿刺活檢,診斷為急性臨界性T 細胞介導排斥反應;其余4 例受者均未行移植賢穿刺活檢。
DBD 供賢較LD 供賢會經歷更長時間的冷/熱缺血時間,所受到的IRI 程度更重[28],因此受損的組織細胞量更多,術后早期dd-cfDNA 的釋放量更大。本研究中SGF 組的DBD 供賢占75%,DGF組的供賢全部是來源于DBD 供者。這可能是導致SGF 組和DGF 兩組POD1 的dd-cfDNA 都要高于IGF 組的一個重要因素。而只要移植賢沒有繼續受到損傷,隨著時間推移,受損組織細胞吸收并修復,dd-cfDNA 會迅速下降。Gielis 等[29]發現術后恢復良好的賢移植受者,其dd-cfDNA 會快速下降,可以從POD1 的2.6%~41.9%迅速降至術后第10 天的0.46%。本研究中SGF 組和DGF 組ddcfDNA 均快速下降:IGF 組和SGF 組的dd-cfDNA在POD5 下降到了1%以內,DGF 組的dd-cfDNA在POD7 下降到了1%以內。
近年來,針對dd-cfDNA 的臨床研究數量增長極快,但由于市面上dd-cfDNA 的檢測成本較高,限制了dd-cfDNA 在臨床上的廣泛應用。Puttarajappa 等人[30]提出,對于一個低免疫學風險的賢移植受者,假設其發生亞臨床T 細胞介導的排斥反應的風險為12%,ABMR 風險為3%,那么在移植后12 個月進行一次程序性活檢可能比用無創性生物標記物進行篩查更具有成本效益。限制dd-cfDNA 成為一種具備實用性的連續監測生物標記物的原因更多在于其檢測成本。雖然本研究有著樣本量較少、為非前瞻性隨機對照研究、圍術期受者均未行病理檢查、沒有與商業化dd-cfDNA 檢測進行性價對比等不足之處。但本研究通過優化SNP 位點的選擇,減少了dd-cfDNA 的檢測成本,并初步驗證了該dd-cfDNA 檢測方法的臨床實用價值,為隨后將該方法臨床轉化,探索其在臨床連續dd-cfDNA 監測和廣泛應用中的價值打下了基礎。

