基于美國FDA不良事件數據庫的注射用紫杉醇(白蛋白結合型) 不良反應信號挖掘
王郁薇 蒙龍 劉簫


摘 要 目的:利用美國FDA不良事件報告系統(FAERS)數據庫挖掘注射用紫杉醇(白蛋白結合型)的藥品不良反應信號,為其臨床安全合理用藥提供參考。方法:采用報告比值比(ROR)法對美國FDA公共數據開放項目(Open-FDA)數據庫中于2004年1月1日-2019年12月31日上報的的注射用紫杉醇(白蛋白結合型)的不良事件進行數據挖掘,分析不良事件涉及的人口學特征、不良反應構成和信號。結果:注射用紫杉醇(白蛋白結合型)的不良事件報告數分別為1 659 例,其中女性(1 169例,占70.5%)多于男性(345例,占20.8%);年齡主要在45~64歲(519例,占31.3%)。該藥的不良反應信號主要集中在神經系統、血液及淋巴系統、胃腸系統、肝膽系統、呼吸系統、胸及縱隔系統和全身性不良反應。分析發現了藥品說明書未記載的陽性不良反應信號20 個,包括白細胞減少、淋巴細胞減少、黃斑水腫、腹痛、吞咽困難、寒戰、黃疸、肝衰竭、肝硬化、尿路感染、膿性分泌物、射血分數降低、低鈣血癥、低鉀血癥、低鈉血癥、骨痛、面癱、精神狀態變化、鼻出血、肺不張等,其中淋巴細胞減少、黃斑水腫、精神狀態改變并未記錄在該藥的藥品說明書中,其他則為藥品說明書中已記錄的不良反應的具體表現。結論:臨床應用注射用紫杉醇(白蛋白結合型)時,除藥品說明書中已提到的不良反應外,還應密切關注其神經毒性、淋巴細胞變化并定期進行眼部與精神狀態監測,以避免因不良反應導致的停藥或造成患者器官損害。
關鍵詞 注射用紫杉醇(白蛋白結合型);美國 FDA 不良事件報告系統;不良事件;藥品不良反應;信號挖掘
中圖分類號 R979.1 文獻標志碼 A 文章編號 1001-0408(2021)03-0328-06
DOI 10.6039/j.issn.1001-0408.2021.03.13
ABSTRACT? ?OBJECTIVE: To utilize ADR signal of Paclitaxel for injection (albumin-bound type) by using FDA adverse event reporting system (FAERS), and to provide reference for rational use of drugs in the clinic. METHODS: The reporting odds ratio (ROR) method was used for data mining of adverse events (AEs) related to Paclitaxel for injection (albumin-bound type) reported by FDA public data program (Open-FDA) during Jan. 1st, 2004-Dec. 31th, 2019. The demographic characteristics, constituents and signals of ADR were analyzed. RESULTS: A total of 1 659 AEs were identified for Paclitaxel for injection (albumin-bound type). The female (1 169 cases, 70.5%) was more than the male (345 cases, 20.8%). The age was mainly 45-64 years old(519 cases, 31.3%). ADR signal mainly involved nerve system, blood and lymphatic system, gastrointestinal system, hepatobiliary system, respiratory system, thoracic and mediastinal system and general ADR. Twenty positive ADR signals which were not recorded in the drug instructions were found in the study, mainly including leucopenia, lymphopenia, macular edema, abdominal pain, dysphagia, shivering, jaundice, liver failure, cirrhosis, urinary tract infection, purulent secretion, decreased ejection fraction, hypocalcemia, hypokalemia, hyponatremia, bone pain, facial paralysis, mental state change, epistaxis, atelectasis. Among them, lymphopenia, macular edema and mental state changes were not recorded in the drug instructions, while others were the specific manifestations of ADR recorded in the drug instructions. CONCLUSIONS: In the clinical application of Paclitaxel for injection (albumin-bound type), in addition to ADR mentioned in the drug instructions, great importance should be closely paid to neurotoxicity, lymphocyte changes, regular eye monitoring and mental state monitoring, so as to avoid drug withdrawal or organ injury induced by ADR.
KEYWORDS? ?Paclitaxel for injection (albumin-bound type); FDA adverse event reporting system; Adverse events; ADR; Signal mining
紫杉醇是一種抗微管劑,是一種可通過促進微管的組裝和穩定來抑制細胞分裂的細胞毒性藥物[1],其對包括非小細胞肺癌和乳腺癌在內的多種惡性腫瘤的治療具有重要臨床價值[2]。但因紫杉醇極難溶解于水,故常規使用聚氧乙烯蓖麻油作為溶劑,然而該溶劑本身就可導致約20%的嚴重過敏事件[3-5],且會導致紫杉醇的非線性藥動學(PK)行為的增強[6]。此外,未結合的紫杉醇也與其臨床毒性有關,包括骨髓抑制、周圍神經病變、肌痛/關節痛、心血管事件、脫發和胃腸道毒性等[1,7-9]。當這些臨床毒性反應出現時,一方面限制了臨床醫師通過加大劑量達到更好治療效果的可能性,另一方面,為了減少臨床毒性,醫師可能需要減少劑量,有可能導致藥物不能起到應有的治療效果。
基于以上弊端而改進并開發的注射用紫杉醇(白蛋白結合型),作為紫杉醇的替代品被引入臨床。該藥品優點為可使紫杉醇更好地溶于水,并增強其在內皮細胞間的轉運;直接消除了聚氧乙烯蓖麻油的毒性作用,提高了治療的安全性[1]。注射用紫杉醇(白蛋白結合型)能有效提高藥物的治療劑量、穩定性和安全性[10],但隨著其廣泛應用,其不良反應也日漸受到關注。
自發呈報是目前世界上最主要的藥物不良反應監測方法,而采用適當的信號挖掘技術對不良反應自發呈報系統數據庫進行風險信號挖掘,可以有效地評價藥物上市后臨床應用的安全性[11-12] 。鑒于注射用紫杉醇(白蛋白結合型)上市使用已超過10 年,因此本研究基于美國FDA不良事件數據庫對該藥品不良反應信號進行挖掘和研究,擬梳理、評價其在“真實世界”的安全性,尋找該藥的潛在不良反應信號,以期為其臨床安全合理用藥提供參考。
1 資料與方法
1.1 數據來源
本研究數據來源于美國FDA公眾健康項目(Open-FDA)數據庫,其不良事件(Adverse events,AE)的原始數據由 FDA 不良事件報告系統(FDA adverse event reporting system ,FAERS)導入。本研究利用open-FDA 分析工具,通過對接其應用程序接口(Application programming interface)直接提取Open-FDA數據庫中結構化的AE報告信息,并可以對數據庫中的數據進行清洗和標準化,提取數據高效準確[13]。目前,該方法已在其他許多類似領域成功應用[14-15]。
1.2 數據提取
本研究限定的AE上報時間為2004年1月1日-2019年12月31日。限定目標藥物通用名(Generic name)為“Paclitaxel protein-bound particles” 或 “Albumin-bound paclitaxel”,或限定商品名(Brand name)為“Abraxane”。不良事件報告限定為上述藥品為首要(Primary suspect)/次要懷疑(Secondary suspect)藥品或合并藥品(Concomitant)的不良事件報告[16]。因為FAERS中AE數據采用《國際醫學用語詞典》(Medical Dictionary for Drug Regulatory Activities,MedDRA)的首選語(Preferred terms)編碼[17],故采用首選語對AE報告進行限定。
1.3 數據分析
本研究采用報告比值比 (ROR) 法對藥品AE信號進行挖掘。ROR法具有靈敏度較高、可消除大量偏倚等優點[18]。該法所需要的四格表見表1,以此計算ROR及其95%置信區間(CI)[ROR的計算公式為 ROR=(a/c)/(b/d);ROR的95%CI=[eln(ROR)±1.96√(1/a+1/b+1/c+1/d)] ]。
1.4 風險信號檢測標準
風險信號檢測標準設置為:(1)報告數≥3;(2)ROR的95%CI下限>1[18]。
1.5 結局指標
對符合風險信號檢測標準的AE進行提取,分析AE報告的人口學特征及嚴重不良反應構成情況,并對提取出的AE信號進行分析,對比注射用紫杉醇(白蛋白結合型)藥品說明書,挖掘藥品說明書未提及的不良反應。
2 結果
2.1 納入分析的AE報告的人口學特征與嚴重不良反應構成情況
通過檢索和篩選,2004年1月1日-2019年12月31日期間注射用紫杉醇(白蛋白結合型)在Open-FDA數據庫中的AE報告數總計1 659 個,AE報告的患者人口學特征及嚴重不良反應構成情況見表2。由表2可知,AE報告中女性(1 169例,占70.5%)多于男性(345例,占20.8%);主要發生年齡在45~64歲(519例,占31.3%)。注射用紫杉醇(白蛋白結合型)相關的AE導致入院602例(占36.3%)、導致死亡571例(占34.4%)、導致威脅生命94例(占5.7%)。
2.2 納入分析的AE報告中信號分析結果
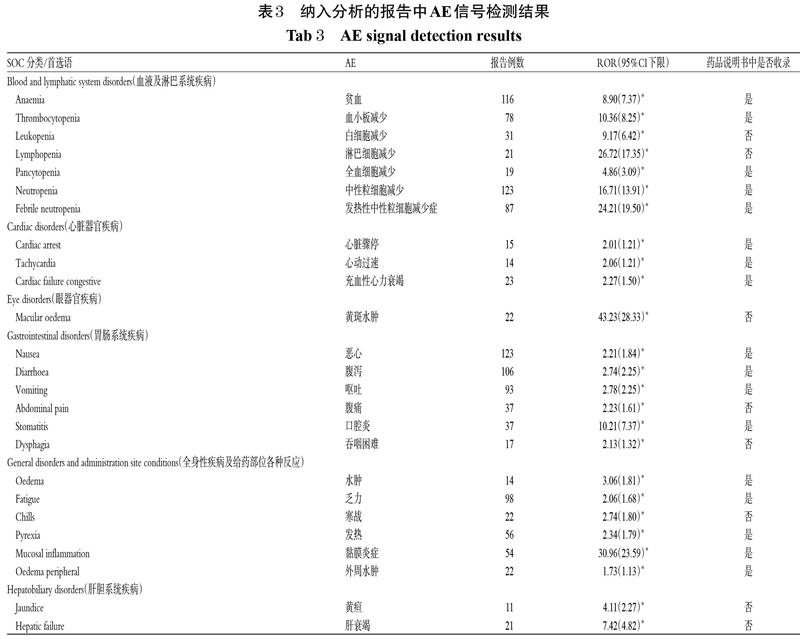
對以注射用紫杉醇(白蛋白結合型)為首要懷疑/次要懷疑藥品或合并藥品的AE報告的事件進行信號分析,并映射得到對應的系統器官分類(SOC),結果見表3。由表3可知,本次調研發現注射用紫杉醇(白蛋白結合型)AE陽性信號67 個,映射在17 個SOC當中;其中,藥品說明書未記錄的陽性信號20 個,包括白細胞減少、淋巴細胞減少、黃斑水腫、腹痛、吞咽困難、寒戰、黃疸、肝衰竭、肝硬化、尿路感染、膿性分泌物、射血分數降低、低鈣血癥、低鉀血癥、低鈉血癥、骨痛、面癱、精神狀態變化、鼻出血、肺不張。
3 討論
3.1 篩選出的AE信號分析
綜合AE的報告例數及不良反應信號強度,本研究發現注射用紫杉醇(白蛋白結合型)的不良反應主要集中在呼吸系統、神經系統、胃腸系統、血液及淋巴系統等。通過與藥品說明書對比發現,以上結果與藥品說明書基本吻合。另外,那些未被記錄在藥品說明書中的陽性信號,絕大多數(如白細胞減少、腹痛、吞咽困難、寒戰、肝衰竭、肝硬化、黃疸、尿路感染、膿性分泌物、射血分數降低、低鈣血癥、低鉀血癥、低鈉血癥、骨痛、面癱、鼻出血、肺不張)為藥品說明書中已記錄的不良反應的具體表現。而淋巴細胞減少、黃斑水腫、精神狀態改變等并未記錄在藥品說明書中的陽性信號,考慮為新的具有臨床指導價值的潛在不良反應。其中,因為精神狀態改變受多種因素影響,故為臨床應加以鑒別的不良反應。
3.2 神經毒性是注射用紫杉醇(白蛋白結合型)最常見的不良反應
本次分析發現,神經毒性在注射用紫杉醇(白蛋白結合型)的不良反應中,發生率及強度較高,其中周圍感覺神經病的ROR更是高達92.28(95%CI下限為65.81)。臨床實踐過程中也充分證明了這一點:一項納入13 個高質量研究、涉及4 613例患者的Meta分析指出,注射用紫杉醇(白蛋白結合型)在治療非小細胞肺癌患者時,顯著增加了3 級感覺神經疾病的風險[19];而在治療胰腺癌方面,注射用紫杉醇(白蛋白結合型)與吉西他濱協同作用產生的神經病變(占17%)顯著多于單用吉西他濱所產生的相應病變(占1%)[20]。周圍神經病變是紫杉醇治療的一種劑量限制性副作用,可通過減少劑量或延遲治療來控制其發生[21-22],其發生的機制尚不清楚,且既往無明確的有效藥物可以對其進行防治。最新研究指出,以注射用紫杉醇(白蛋白結合性)進行的化療過程中患者體內白細胞介素20水平升高,同時周圍神經毒性反應發生的風險增加;而通過抑制白細胞介素20水平升高可防治該藥誘導的感覺神經毒性,且更重要的是,這種治療方式并不會改變藥物的治療效果[23]。但這一結論仍需大量的臨床研究予以佐證。
3.3 注射用紫杉醇(白蛋白結合型)可造成淋巴細胞減少
注射用紫杉醇(白蛋白結合型)藥品說明書中明確指出中性粒細胞減少、血小板減少、貧血等為其不良反應。雖然全血細胞減少在該藥臨床試驗及上市后安全性監測中罕見,但仍應引起臨床高度重視。而在本研究中發現,淋巴細胞減少為注射用紫杉醇(白蛋白結合型) 藥品說明書中未收錄的不良反應。根據該藥品的作用機制,筆者推測造成這種情況的原因可能為紫杉醇可阻止癌細胞的分裂過程,同時對于快速分裂的淋巴細胞可起到抑制作用,而淋巴細胞的減少則增加了機會性感染可能性,尤其是病毒性感染的風險[24]。有綜述指出,在 2 736 例罹患各種惡性腫瘤患者的化療過程中,雖化療方案不同,但聯用淋巴細胞增殖輔助刺激因子后,使化療中患者感染的發生率明顯下降[25],明顯改善了患者用藥安全性。因此,筆者建議在使用注射用紫杉醇(白蛋白結合型)過程中,對血常規中的淋巴細胞進行監測,如出現淋巴細胞減少,可嘗試使用淋巴細胞增殖輔助刺激因子,這對預防嚴重感染具有一定的意義。
3.4 注射用紫杉醇(白蛋白結合型)可造成黃斑水腫
眼器官疾病不良反應未在注射用紫杉醇(白蛋白結合型)藥品說明書中明確告知,但藥品說明書也指出在紫杉醇注射液安全性持續監測中曾報告的罕見AE(如結膜炎與流淚)也有可能出現。而本研究結果提示,黃斑水腫為未被注射用紫杉醇(白蛋白結合型)藥品說明書收錄的不良反應信號。黃斑水腫是一種常見的眼科疾病,可造成視力嚴重下降。偶見有關紫杉醇導致的黃斑水腫的病案報道[26-28],但均未對具體發病機制進行闡述。通過對注射用紫杉醇(白蛋白結合型)藥品說明書的查閱,筆者認為其出現的可能原因包括眼內炎癥、黃斑區水腫,亦有可能是上述多種共同原因造成的。而在治療手段中,1 例患者使用乙酰唑胺使視力恢復,并在持續服藥且堅持使用紫杉醇化療狀態下,視力維持大于2 年[26];1 例患者使用貝伐珠單抗和曲安奈德處理1 年后視力得到改善[27];1 例患者停藥后視力自行恢復[28]。雖然經過治療,患者視力可得到部分甚至完全恢復,但筆者仍建議在臨床使用注射用紫杉醇(白蛋白結合型)化療的過程中,定期行眼部光學相關斷層掃描,以做到視力問題早發現、早干預。
3.5 注射用紫杉醇(白蛋白結合型)可引起精神狀態改變
雖然在藥品說明書中未被提及,但精神狀態改變在本次不良反應信號挖掘中亦是一個陽性信號。患者在就診過程中,精神狀態的改變可能是多方面因素共同作用的結果。患者因自身疾病、治療方式、藥物選擇所造成的生理打擊,因對疾病及未來的擔憂所帶來的負性心理刺激,因治療所產生的高額醫療費用而造成的社會壓力均可引起精神狀態改變,故不可單純地將精神狀態改變歸咎于藥物不良反應。在上報不良反應時,無法對患者除藥品外的其他相關因素予以規避,所以筆者本研究中排除了精神狀態改變這一陽性信號。但在實際的臨床工作中,醫務工作者應積極關注患者的精神狀態,了解其生物、心理及社會相關因素,保證患者心理健康、精神狀態平穩,保障治療期間的患者用藥安全。
4 結語
綜上所述,本研究基于信號挖掘方法對注射用紫杉醇(白蛋白結合型)的AE信號進行全面分析,發現了可能造成嚴重損害且未被記錄在藥品說明書當中的不良反應——黃斑水腫、淋巴細胞減少及精神狀態改變等。同時,對造成上述不良反應的機制進行了初步探究,可為臨床安全使用注射用紫杉醇(白蛋白結合型)提供一定參考。
需要注意的是,本研究采用的ROR法產生的風險信號不代表藥物與不良反應存在必然的因果聯系,只能表明藥物與AE信號有統計學關聯,需要進一步對風險信號進行臨床研究和評估加以確定。另外,由于數據庫AE中的漏報、低報、缺乏患者的臨床信息、偏倚等也會對數據挖掘結果造成影響[29]。
參考文獻
[ 1 ] SLINGERLAND M,GUCHELAAR HJ,ROSING H. Bioequivalence of Liposome-Entrapped Paclitaxel Easy-To- Use (LEP-ETU)? formulation and paclitaxel in polyetho- xylated castor oil:a randomized,two-period crossover study in patients with advanced cancer[J]. Clin Ther,2013,35(12):1946-1954.
[ 2 ] BLAIR HA,DEEKS ED. Albumin-bound paclitaxel:a review in non-small cell lung cancer[J]. Drugs,2015,75(17):2017-2024.
[ 3 ] DONEHOWER RC,ROWINSKY EK,GROCHOW LB. Phase Ⅰ trial of taxol in patients with advanced cancer[J]. Cancer Treat Rep,1987,71(12):1171-1177.
[ 4 ] SINGLA AK,GARG A,AGGARWAL D. Paclitaxel and its formulations[J]. Int J Pharm,2002,235(1/2):179-192.
[ 5 ] JOERGER M. Prevention and handling of acute allergic and infusion reactions in oncology[J]. Ann Oncol,2012,23(10):313-319.
[ 6 ] SPARREBOOM A,VAN ZUYLEN L,BROUWER E. Cremophor EL-mediated alteration of paclitaxel distribution in human blood:clinical pharmacokinetic implications[J]. Cancer Res,1999,59(7):1454-1457.
[ 7 ] CONLIN AK,SEIDMAN AD,BACH A. Phase Ⅱ trial of weekly nanoparticle albumin-bound paclitaxel with carboplatinand trastuzumab as first-line therapy for women with HER2-over expressing metastatic breast cancer[J]. Clin Breast Cancer,2010,10(4):281-287.
[ 8 ] LLUCH A,ALVAREZ I,MUNOZ M. Treatment innovations for metastatic breast cancer:nanoparticle albumin-bound(NAB) technology targeted to tumors[J]. Crit Rev Oncol Hematol,2014,89(1):62-72.
[ 9 ] LI Y,CHEN N,PALMISANO M. Pharmacologic sensiti- vity of paclitaxel to its delivery vehicles drives distinct clinical outcomes of paclitaxel formulations[J]. Mol Pharm,2015,12(4):1308-1317.
[10] DU X,KHAN AR,FU M. Current development in the formulations of non-injection administration of paclitaxel[J]. Int J Pharm,2018,542(1/2):242-252.
[11] REVOL B,JULLIAN-DESAYES I,TAMISIER R. Ticagrelor and central sleep apnea[J]. J Am Coll Cardiol,2018,71 (20):2378-2379.
[12] LONG M,JING H. Assessing fluoroquinolone-associated aortic aneurysm and dissection:data mining of the public version of the FDA adverse event reporting system[J]. Int J Clin Pract,2019,73(5):e13331.
[13] B?HM R,VON HEHN L,HERDEGEN T. Openvigil FDA-inspection of us american adverse drug events pharmacovigilance data and novel clinical applications[J]. PLoS One,2016,11(6):e0157753.
[14] JI HH,TANG XW,DONG Z. Adverse event profiles of anti-CTLA-4 and anti-PD-1 monoclonal antibodies alone or in combination:analysis of spontaneous reports submitted to faers[J]. Clin Drug Investig,2019,39 (3):319-330.
[15] 蒙龍,唐學文,季歡歡.他汀類藥物相關不良反應的信號挖掘與評價:基于美國openFDA公共數據開放項目的數據挖掘研究[J].中國新藥雜志,2019,28(2):244-248.
[16] ANTONAZZO IC,POLUZZI E,FORCESI E. Myopathy with DPP-4 inhibitors and statins in the real world:investigating the likelihood of drug-drug interactions through the FDA adverse event reporting system[J]. Acta Diabetol,2020,57 (1):71-80.
[17] 卜擎燕,熊寧寧,鄒建東. Ich國際醫學用語詞典(Meddra):藥事管理的標準醫學術語集[J].中國臨床藥理學與治療學,2007,12(5):586-590.
[18] BATE A,EVANS SJW. Quantitative signal detection? ? using spontaneous ADR reporting[J]. Pharmacoepidemiol Drug Saf,2009,18 (6):427-436.
[19] HONG T,JING H,SHAN L. Efficacy and safety of nanoparticle albumin-bound paclitaxel in non-small cell lung cancer:a systematic review and meta-analysis[J]. Artif Cells Nanomed Biotechnol,2019,47(1):268-277.
[20] GRADISHAR WJ,KRASNOJON D,CHEPOROV S. Phase Ⅱ trial of NAB- paclitaxel compared with docetaxel as first-line chemotherapy in patients with metastatic breast cancer:final analysis of overall survival[J]. Clin Breast Cancer,2012,12(5):313-321.
[21] HU LY,MI WL,WU GC. Prevention and treatment for chemotherapy-induced peripheral neuropathy:therapies based on CIPN mechanisms[J]. Curr Neuropharmacol,2019,17(2):184-196.
[22] STAFF NP,GRISOLD A,GRISOLD W. Chemotherapy- induced peripheral neuropathy:a current review[J]. Ann Neurol,2017,81(6):772-781.
[23] CHEN LH,YEH YM,CHEN YF. Targeting interleukin-20 alleviates paclitaxel-induced peripheral neuropathy[J]. Pain,2020,161(6):1237-1254.
[24] 焦洋,許瑩,李太生.氟達拉濱化療后外周血淋巴細胞減少及相關機會性感染[J].中華內科雜志,2006,45(8):684-685.
[25] WOLF E,MILAZZO S,BOEHM K. Thymic peptides for treatment of cancer patients[J]. Cochrane Database Syst Rev,2011. DOI:10.1002/14651858.CD003993.pub3.
[26] MEYER KM,KLINK T,UGUREL S. Regression of paclitaxel-induced maculopathy with oral acetazolamide[J]. Graefes Arch Clin Exp Ophthalmol,2012,250(3):463- 464.
[27] HAM DS,LEE JE,KIM HW. A case of cystoid macular edema associated with paclitaxel chemotherapy[J]. Korean J Ophthalmol,2012,26(5):388-390.
[28] PADR?N P?REZ N,RUBIO CASO MJ,ARIAS BAR- QUET L. Bilateral cystoid macular edema in a patient with taxane-based chemotherapy[J]. Can J Ophthalmol,2013,48(1):e3-e4.
[29] 彭媛,王程程,唐利.西格列汀上市后致皮膚不良反應的信號挖掘與評價[J].中國藥房,2014,25(2):156-158.
(收稿日期:2020-10-27 修回日期:2020-12-15)
(編輯:劉明偉)

