小分子GLP-1R激動劑對骨質疏松模型小鼠的改善作用
周穎 王寧 陳周 劉煥 李汾 魏明 李萍
摘 要 目的:探討小分子胰高血糖素樣肽1受體(GLP-1R)激動劑6,7-二氯-2-磺酰烷基-3-仲烷氨基喹喔啉(DMB)對骨質疏松模型小鼠的改善作用。方法:將C57BL/6J小鼠隨機分為假手術組、模型組、陽性對照組(17β-雌二醇,10 μg/kg)和DMB組(1 mg/kg),每組10只。假手術組小鼠行雙側剖腹術但不摘除卵巢,其余各組小鼠行雙側卵巢切除術以復制骨質疏松模型。術后第4周,假手術組、模型組小鼠灌胃等體積橄欖油,各給藥組小鼠灌胃相應藥物,每日1次,連續8周。末次給藥后,采用計算機斷層掃描(Micro-CT)儀檢測各組小鼠股骨骨微結構、骨礦密度(BMD)、骨礦含量(BMC)及骨形態參數[骨組織體積分數(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁數(Tb.N)和骨小梁間距(Tb.Sp)];采用酶聯免疫吸附試驗法檢測各組小鼠血清中骨形成指標[骨特異性堿性磷酸酶(BALP)、骨保護素(OPG)]和骨吸收指標[抗酒石酸酸性磷酸酶(TRAP)和Ⅰ型膠原蛋白C末端交聯肽(CTX-Ⅰ)]的表達水平;采用三點彎曲試驗法檢測各組小鼠股骨的生物力學參數(最大載荷、剛度、應力和楊氏模量)。結果:假手術組小鼠股骨的骨小梁數量多、壁厚、形態結構完整、排列緊密有序、呈網狀,骨微結構和骨量正常。與假手術組比較,模型組小鼠股骨的骨小梁數量減少、厚度變薄、扭曲或斷裂,且骨小梁間隙增大,骨微結構惡化,骨量減少;BMD、BMC、BV/TV、Tb.Th、Tb.N和股骨的生物力學參數均顯著降低,Tb.Sp和血清中BLAP、OPG、TRAP、CTX-Ⅰ水平均顯著升高(P<0.05或P<0.01)。與模型組比較,陽性對照組和DMB組小鼠骨量增加,骨小梁數量、厚度、形態等部分恢復;BMD、BMC、BV/TV、Tb.Th、Tb.N和股骨的生物力學參數均顯著升高(P<0.05或P<0.01),Tb.Sp和血清中BLAP、OPG水平均顯著升高(P<0.01),TRAP、CTX-Ⅰ水平均顯著降低(P<0.05或P<0.01)。結論:DMB可通過增加骨量、改善骨微結構、升高骨形成相關指標的表達和骨生物力學參數以及降低骨吸收相關指標的表達,來發揮改善小鼠骨質疏松的作用。
關鍵詞 6,7-二氯-2-磺酰烷基-3-仲烷氨基喹喔啉;胰高血糖素樣肽1受體;受體激動劑;骨質疏松癥;小鼠
中圖分類號 R965 文獻標志碼 A 文章編號 1001-0408(2021)03-0284-05
DOI 10.6039/j.issn.1001-0408.2021.03.06
ABSTRACT? ?OBJECTIVE: To explore the improvement effects of small-molecule glucagon-like peptide-1 receptor (GLP-1R) agonists (6,7-dichloro-2-methylsulfonyl-3-N-tert-butylaminoquinoxaline, DMB) on osteoporosis model mice. METHODS: C57BL/6J mice were randomly divided into sham operation group, model group, positive control group (17β-estradiol, 10 μg/kg) and DMB group (1 mg/kg), with 10 mice in each group. The sham operation group received bilateral laparotomy without ovariectomy, and the other groups received bilateral ovariectomy to reproduce the osteoporosis model. At 4th week after operation, sham operation group and model group were given constant volume of olive oil intragastrically; administration groups were given relevant medicine intragastrically, once a day, for consecutive 8 weeks. After last medication, Micro-CT was used to detect the femur microstructure, bone mineral density (BMD), bone mineral content (BMC) and bone morphometric parameters [bone tissue volume ratio (BV/TV), trabecular thickness (Tb.Th), trabecular number (Tb.N) and trabecular spacing (Tb.Sp)]. ELISA assay was used to detect the expression of bone formation indexes [bone specific alkaline phosphatase (BALP), osteoprotegerin (OPG)] and bone resorption indexes [tartrate resistant acid phosphatase (TRAP) and C-terminal cross-linked telopeptides of type Ⅰ collagen (CTX-Ⅰ)]. Three-point bending test was used to detect biomechanical parameters (maximum load, stiffness, stress and Youngs modulus) of femur of mice in each group. RESULTS: In sham operation group, trabeculae were numerous, thick, complete in morphological structure, well-organized and reticular; bone microstructure and bone mass were normal. Compared with sham operation group, the number of trabecular bone decreased, the thickness became thinner, twisted or broken, and the trabecular space increased; the bone microstructure deteriorated and the bone mass decreased; BMD, BMC, BV/TV, Tb.Th, Tb.N and biomechanical parameters of femur were decreased significantly, while Tb.Sp and serum levels of BLAP, OPG, TRAP and CTX-Ⅰ were increased significantly in model group (P<0.05 or P<0.01). Compared with model group, the bone mass of positive control group and DMB group were increased, while the number, thickness and shape of trabecular bone partially recovered; BMD, BMC, BV/TV, Tb.Th, Tb.N and biomechanical parameters of femur were increased significantly (P<0.05 or P<0.01); Tb.Sp, serum levels of BLAP and OPG were increased significantly (P<0.01), while the levels of TRAP and CTX-Ⅰ were decreased significantly (P<0.05 or P<0.01). CONCLUSIONS: DMB can improve osteoporosis by increasing bone mass, improving bone microstructure, increasing the expression of bone formation related indexes and biomechanical parameters and decreasing bone resorption related indexes.
KEYWORDS? ?6,7-dichloro-2-methylsulfonyl-3-N-tert-butylaminoquinoxaline; Glucagon-like peptide-1 receptor; Receptor agonist; Osteoporosis; Mice
相關研究發現,腸促激素胰高血糖素樣肽1(GLP-1)及其受體(GLP-1R)可參與成骨細胞和破骨細胞的分化與功能調節,影響機體骨代謝平衡[1-2],故GLP-1R激動劑已成為治療骨質疏松的候選藥物。然而,骨質疏松是一種慢性的、老年性疾病,患者需要長時間使用藥物進行治療[3]。現有的天然GLP-1及肽類GLP-1R激動劑的穩定性差、制備困難且價格昂貴,加之需要注射給藥,使得其臨床應用受到一定限制[4-5]。6,7-二氯-2-磺酰烷基-3-仲烷氨基喹喔啉(6,7-dichloro-2- methylsulfonyl-3-N-tert-butylaminoquinoxaline,DMB)是一種小分子GLP-1R激動劑,其合成工藝簡單、穩定性好、可口服,體內外研究均提示其具有降糖活性[6-7];另有研究發現,其還能促進內源性GLP-1與其受體結合,增強GLP-1的體內活性[7]。本課題組前期預實驗結果顯示,DMB可顯著降低去卵巢誘導的骨質疏松模型小鼠的骨吸收標志物水平,并上調骨形成標志物水平。然而,DMB是否與肽類激動劑類似,可參與骨代謝的調節,目前尚未見相關研究報道。基于此,本研究探討了DMB對骨質疏松模型小鼠骨微結構、骨礦密度(BMD)、骨礦含量(BMC)、骨形態參數、骨形成和骨吸收相關指標及骨生物力學參數的影響,以期為小分子GLP-1R激動劑治療骨質疏松癥提供參考依據。
1 材料
1.1 主要儀器
本研究所用的主要儀器有:AL104型萬分之一電子天平(瑞士 Mettler Toledo 公司)、SmarT-R17型高速冷凍離心機(韓國Hanil公司)、ELx800型全自動酶標儀(美國BioTek公司)、Inveon型微計算機斷層掃描(Micro- CT)儀(德國Siemens公司)、MTS BioNix 858 Ⅱ型萬能材料測試儀(美國MTS公司)。
1.2 主要藥品與試劑
本研究所用的主要藥品與試劑有:DMB對照品(北京億思研科技開發中心,純度≥98%),戊巴比妥鈉原料藥、17β-雌二醇(E2)原料藥(美國Sigma公司,批號分別為127K1005、E-8875,純度均不低于98%),RNA微量提取試劑盒(美國Promega公司,批號Z3100),逆轉錄試劑盒、SYBR Premix Ex Taq酶(日本TaKaRa公司,批號分別為BK1501、AKA906),橄欖油(國藥集團化學試劑有限公司,批號20170422),血清骨特異性堿性磷酸酶(BALP)酶聯免疫吸附試驗(ELISA)試劑盒(上海遠慕科技有限公司,批號20180124),抗酒石酸酸性磷酸酶(TRAP)ELISA試劑盒(上海酶聯生物科技有限公司,批號180223),骨保護素(OPG)ELISA試劑盒(深圳子科生物科技有限公司,批號181031),Ⅰ型膠原蛋白C末端交聯肽(CTX-Ⅰ)ELISA試劑盒(南京信帆生物技術有限公司,批號180411),去離子水;其余試劑均為分析純或實驗室常用規格。
1.3 動物
本研究所用的動物為SPF級雌性C57BL/6J小鼠,6周齡,體質量為13~15 g,由空軍軍醫大學實驗動物中心提供,動物生產許可證號為SCXK(陜)2014-002。所有小鼠均飼養于溫度(21±2) ℃、相對濕度50%、12 h光暗交替的環境下,并自由進食、飲水。
2 方法
2.1 分組、造模與給藥
將小鼠適應性喂養1周后,取40只腹腔注射戊巴比妥鈉(40 mg/kg)進行麻醉,然后分為假手術組、模型組、陽性對照組(E2,10 μg/kg)和DMB組(1 mg/kg),每組10只。其中,假手術組小鼠行雙側剖腹術但不摘除卵巢,其余各組小鼠行雙側卵巢切除術以復制骨質疏松模型。術后第4周,陽性對照組和DMB組小鼠灌胃相應藥物溶液10 mL/kg(以橄欖油為溶劑配制,劑量參考文獻[7]及本課題組前期預實驗結果),假手術組和模型組小鼠灌胃給予等體積橄欖油,每日1次,連續給藥8周。
2.2 小鼠股骨骨微結構、BMD、BMC和骨形態參數檢測
各組小鼠末次給藥后,腹腔注射戊巴比妥鈉(40? mg/kg)進行麻醉,并通過Micro-CT儀掃描其股骨的微結構,并導出圖片;然后采用Inveon Research Workplace 2.2軟件分析掃描數據并進行三維(3D)重建小鼠股骨干骺端,獲取小鼠股骨的BMD、BMC和骨形態參數[包括骨組織體積分數(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁數(Tb.N)和骨小梁間距(Tb.Sp)]。
2.3 小鼠血清中骨形成和骨吸收指標檢測
采用ELISA法進行檢測。“2.2”項實驗結束后,各組小鼠摘眼球取血適量,于4 ℃下以3 000 r/min離心20 min,分離血清。采用酶標儀檢測各組小鼠血清中骨形成指標(BALP、OPG)和骨吸收指標(TRAP、CTX-Ⅰ)的水平,嚴格按照相應試劑盒說明書方法操作。
2.4 DMB對骨質疏松模型小鼠股骨骨生物力學參數的影響考察
采用三點彎曲試驗法進行檢測。各組小鼠取血后脫頸椎法處死,剝離股骨,并用浸有生理鹽水的紗布包裹,于-80 ℃凍存。臨檢測時,將股骨樣品解凍1 h后,置于萬能材料測試儀的支架上(跨距設置為10 mm),向股骨施加載荷(速度設置為1.2 mm/min)直到骨折;然后采用Test Star Ⅱ軟件繪制小鼠股骨載荷-變形曲線,并分析其最大載荷、剛度、應力和楊氏模量等骨生物力學參數。
2.5 統計學方法
使用GraphPad Prism 5軟件對數據進行統計分析。計量資料以x±s表示,組間比較采用方差分析。P<0.05表示差異有統計學意義。
3 結果
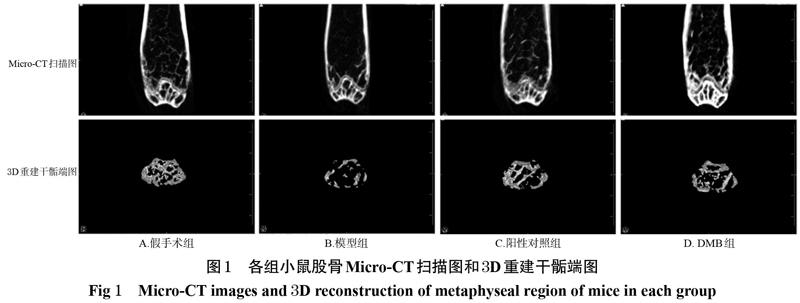
3.1 DMB對骨質疏松模型小鼠股骨骨微結構的影響
假手術組小鼠股骨的骨小梁數量多、壁厚、形態結構完整、排列緊密有序、呈網狀,骨微結構和骨量正常;與假手術組比較,模型組小鼠股骨的骨小梁數量減少、厚度變薄、出現扭曲或斷裂,且骨小梁間隙增大,骨微結構惡化,骨量減少;與模型組比較,陽性對照組和DMB組小鼠骨量增加,骨小梁數量、厚度、形態等部分恢復,詳見圖1。
3.2 DMB對骨質疏松模型小鼠股骨BMD、BMC和骨形態參數的影響
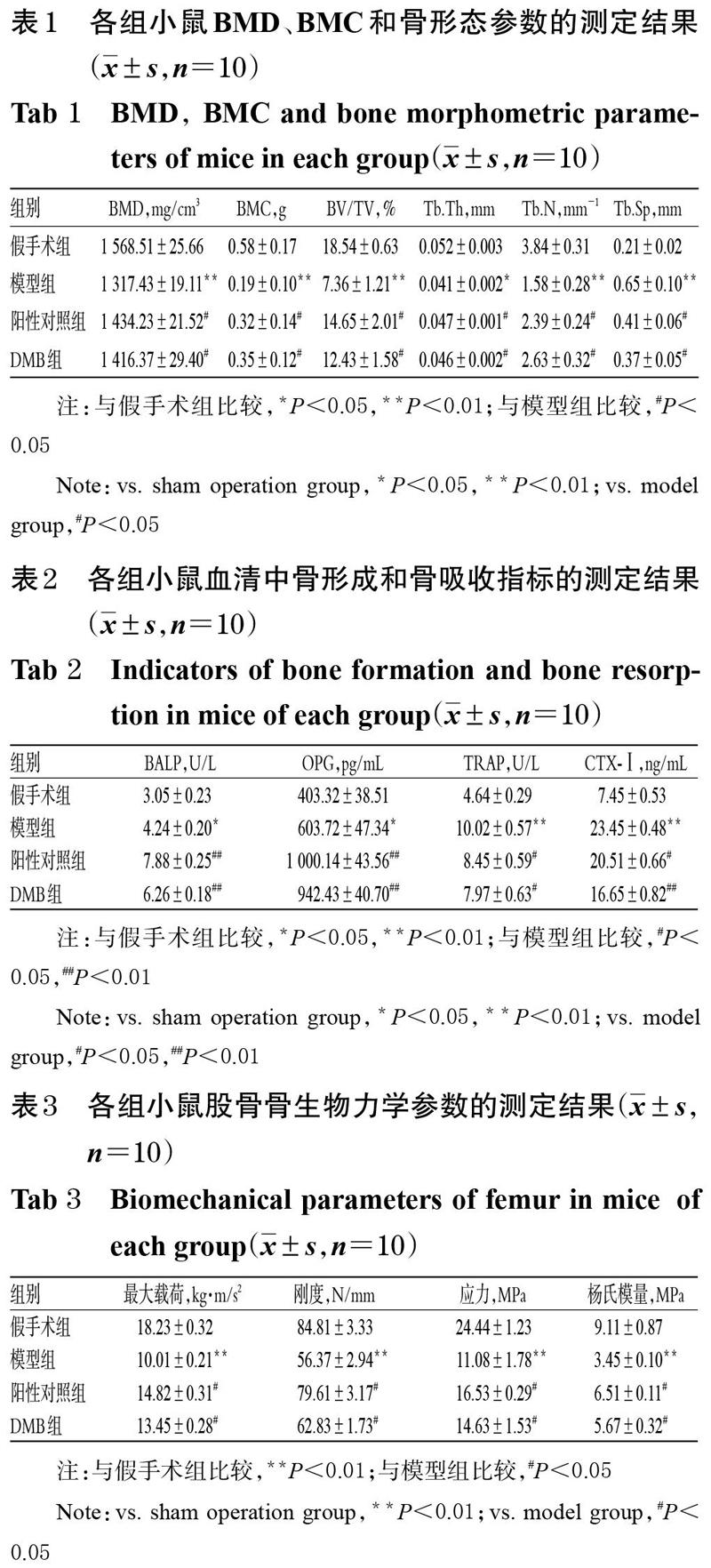
與假手術組比較,模型組小鼠的BMD、BMC、BV/TV、Tb.Th、Tb.N均顯著降低,Tb.Sp顯著升高(P<0.05或P<0.01);與模型組比較,陽性對照組和DMB組小鼠的BMD、BMC、BV/TV、Tb.Th、Tb.N均顯著升高(P<0.05),Tb.Sp顯著降低(P<0.05),詳見表1。
3.3 DMB對骨質疏松模型小鼠血清中骨形成和骨吸收指標的影響
與假手術組比較,模型組小鼠血清中的BALP、OPG、TRAP、CTX-Ⅰ水平均顯著升高(P<0.05或P<0.01);與模型組比較,陽性對照組和DMB組小鼠血清中BALP、OPG水平均顯著升高(P<0.01),TRAP、CTX-Ⅰ水平均顯著降低(P<0.05或P<0.01),詳見表2。
3.4 DMB對骨質疏松模型小鼠股骨骨生物力學的影響
與假手術組比較,模型組小鼠股骨的最大載荷、剛度、應力、楊氏模量均顯著降低(P<0.01);與模型組比較,陽性對照組和DMB組小鼠股骨的上述骨生物力學指標均顯著升高(P<0.05),詳見表3。
4 討論
目前,肽類GLP-1R激動劑如艾塞那肽、利拉魯肽、索馬魯肽等,主要用于2型糖尿病的臨床治療,其給藥方式主要是皮下或肌內注射,但患者使用不便且依從性很差[5,8]。雖然在2019年9月索馬魯肽的口服制劑被批準上市,但是其藥物劑量約是皮下注射劑量的數十倍,且價格非常昂貴[9]。現有GLP-1R激動劑中,根據化學結構可分為一氧二氮雜蒽類、硝基吡唑類、喹喔啉硫醚類、亞胺噻唑烷酮類、環丁烷類和喹喔啉類等,體外研究顯示,一氧二氮雜蒽類、硝基吡唑類和喹喔啉硫醚類化合物均能與GLP-1R競爭性結合[10],但尚無體內活性的研究報道。此外,亞胺噻唑烷酮類化合物本身并無任何活性,但當其與GLP-1R結合后,可增加GLP-1的生物活性[10-11];環丁烷類化合物(如Boc5)雖然具有體內降糖活性,但是其合成制備工藝復雜[11],因此開發價值有限;喹喔啉類化合物DMB可通過激活GLP-1R,促進胰島細胞系分泌胰島素和改善正常小鼠糖耐量,同時還可增加GLP-1對其受體的親和力[6-7],具有一定的開發潛力。
研究發現,GLP-1及其受體的信號轉導通路參與了骨代謝過程[12-14],如GLP-1受體激動劑可通過激活胰島素樣生長因子1/磷脂酰肌醇3-激酶/蛋白激酶B(IGF-1/ PI3K/Akt)信號通路,促進大鼠衰老成骨細胞的增殖[12];利拉魯肽可刺激小鼠前成骨細胞MC3T3-E1或人骨髓基質細胞向成骨細胞的分化[13];GLP-1(7-36)酰胺和艾塞那肽對骨吸收均具有抑制作用[13]。但小分子GLP-1R激動劑DMB是否也參與骨代謝的調節尚不明確。
經雙側卵巢切除術建立的模型小鼠是研究中老年女性絕經后骨質疏松較好的動物模型[15]。有研究指出,骨質疏松患者由于生理性骨轉換功能的改變,會降低骨骼中BMC的水平,從而增加骨折的風險[16];BMD可反映骨質疏松的程度,也是預測骨折風險的重要依據之一[4];此外,骨微結構的惡化也是導致骨強度下降和骨折風險增加的重要因素[3]。BALP、OPG是骨形成的標志物,其中OPG由成骨細胞分泌,能調節破骨細胞的分化;TRAP、CTX-Ⅰ是骨吸收標志物,TRAP可反映破骨細胞活性及骨吸收狀態,CTX-Ⅰ常用于評價抗骨吸收藥物的治療效果[17-18]。在骨質疏松發生的過程中,上述生化指標也會發生變化。
本課題組前期預實驗結果發現,DMB(0.2、1、5? ?mg/kg)可隨劑量增加而增加/降低骨質疏松模型小鼠血清中BALP/TRAP水平,這提示其可影響小鼠的骨代謝水平。基于此,本研究進一步探討了DMB改善骨質疏松的作用。結果顯示,模型組小鼠經雙側卵巢切除后,其骨量流失、骨微結構惡化,BMC、BMD和骨生物力學參數均顯著降低(P<0.05或P<0.01),血清中BALP、OPG、TRAP、CTX-Ⅰ水平均顯著升高(P<0.05或P<0.01),這是由于小鼠經雙側卵巢切除術后其體內雌激素缺乏,從而會刺激骨形成、骨吸收指標水平的升高[10];經E2和DMB干預后,小鼠骨量增加,骨微結構改善,BMC、BMD、骨生物力學參數和血清中BALP、OPG水平均顯著升高,而血清中TRAP、CTX-Ⅰ水平均顯著降低(P<0.05或P<0.01)。此結果與已報道的GLP-1R激動劑在多種動物模型中的促成骨作用相一致[19-21]。
綜上所述,DMB可通過增加骨量、改善骨微結構、升高骨形成相關指標的表達和骨生物力學參數以及降低骨吸收相關指標的表達來發揮改善骨質疏松的作用。由于DMB是小分子化合物,其空間結構和肽類激動劑不同,可能使其與GLP-1R的親和力和內在活性與肽類激動劑存在差異[22]。目前,多條信號通路已被證實與GLP-1R介導的骨代謝調節作用有關,如蛋白激酶C-β2(PKC-β2)[2]、IGF-1/IGF-1受體 [12]、PI3K/Akt和細胞外因子/β-聯蛋白[13]通路等,而DMB改善骨質疏松作用是否直接通過激動GLP-1R受體,或通過上述信號通路參與骨代謝調節還有待進一步研究。
參考文獻
[ 1 ] GIRDHAR K,DEHURY B,KUMAR SINGH M,et al. Novel insights into the dynamics behavior of glucagon- like peptide-1 receptor with its small molecule agonists[J].J Biomol Struct Dyn,2019,37(15):3976-3986.
[ 2 ] WANG Z,WANG X,ZHANG L,et al. GLP-1 inhibits PKC-β2 phosphorylation to improve the osteogenic diffe- rentiation potential of hPDLSCs in the AGE microenvironment[J]. J Diabetes Complications,2020. DOI:10.1016/J.JDIACOMP.2019.107495.
[ 3 ] JACOME-GALARZA CE,PERCIN GI,MULLER JT, et al. Developmental origin,functional maintenance and genetic rescue of osteoclasts[J]. Nature,2019,568(7753):541-545.
[ 4 ] PARIZAD N,BAGHI V,KARIMI EB,et al. The prevalence of osteoporosis among Iranian postmenopausal women with type 2 diabetes:a systematic review and meta-analysis[J]. Diabetes Metab Syndr,2019,13(4):2607- 2612.
[ 5 ] KNUDSEN LB,KIEL D,TENG M,et al. Small-molecule agonists for the glucagon-like peptide 1 receptor[J]. Proc Natl Acad Sci USA,2007,104(3):937-942.
[ 6 ] CHEONG YH,KIM MK,SON MH,et al. Two small mo- lecule agonists of glucagon-like peptide-1 receptor modulate the receptor activation response differently[J]. Biochem Biophys Res Commun,2012,417(1):558-563.
[ 7 ] IRWIN N,FLATT PR,PATTERSON S ,et al. Insulin-releasing and metabolic effects of small molecule GLP-1 receptor agonist 6,7-dichloro-2-methylsulfonyl-3-N-tert-butylaminoquinoxaline[J]. Eur J Pharmacol,2010,628(1/2/3):268-273.
[ 8 ] 蘆志偉,孫浩,李瑩,等.長效GLP-1受體激動藥索馬魯肽治療2型糖尿病療效和安全性的系統評價[J].中國藥房,2019,30(7):969-975.
[ 9 ] 李艷梅,唐祎偌,夏旋.索馬魯肽口服劑:開啟GLP-1受體激動劑的新時代[J].藥品評價,2019,16(24):1-3.
[10] GRAAF CD,DONNELLY D,WOOTTEN D ,et al. Glucagon-like peptide-1 and its class BG protein-coupled receptors:a long march to therapeutic successes[J]. Pharmacol Rev,2016,68(4):954-1013.
[11] ZHOU C,ZHOU Y,WANG J,et al. Emergence of Chinese drug discovery research:impact of hit and lead identification[J]. J Biomol Screen,2015,20(3):318-329.
[12] ZHANG M,XIE Y,ZHOU Y,et al. Exendin-4 enhances proliferation of senescent osteoblasts through activation of the IGF-1/IGF-1R signaling pathway[J]. Biochem Biophys Res Commun,2019,516(1):300-306.
[13] GAO L,LI SL,LI YK. Liraglutide promotes the osteoge- nic differentiation in MC3T3-E1 cells via regulating the expression of Smad2/3 through PI3K/Akt and Wnt/beta- catenin pathways[J]. DNA Cell Biol,2018,37(12):1031- 1043.
[14] NISSEN A,MARSTRAND S,SKOV-JEPPESEN K,et al. A pilot study showing acute inhibitory effect of GLP-1 on the bone resorption marker CTX in humans[J]. JBMR Plus,2019. DOI:10.1002/JBM4.10209.
[15] YOUSEFZADEH N,KASHFI K,JEDDI S,et al. Ovariectomized rat model of osteoporosis:a practical guide[J]. EXCLI J,2020. DOI:10.17179/EXCLI2019-1990.
[16] SANGHANI-KERAI A,MCCREARY D,LANCASHIRE H,et al. Stem cell interventions for bone healing:fractures and osteoporosis[J]. Curr Stem Cell Res Ther,2018,13(5):369-377.
[17] SZULC P. Biochemical bone turnover markers in hormo- nal disorders in adults:a narrative review[J]. J Endocrinol Invest,2020,43(10):1409-1427.
[18] DIEMAR SS,MOLLEHAVE LT,QUARDON N,et al. Effects of age and sex on osteocalcin and bone-specific alkaline phosphatase-reference intervals and confounders for two bone formation markers[J]. Arch Osteoporos,2020.DOI:10.1007/S11657-020-00715-6.
[19] LEI T,LIANG Z,LI F,et al. Pulsed electromagnetic fields (PEMF) attenuate changes in vertebral bone mass,architecture and strength in ovariectomized mice[J]. Bone,2018. DOI:10.1016/J.BONE.2017.12.008.
[20] SCHIELLERUP SP,SKOV-JEPPESEN K,WINDEL?V JA,et al. Gut hormones and their effect on bone metabolism. Potential drug therapies in future osteoporosis treatment[J]. Front Endocrinol (Lausanne),2019. DOI:10. 3389/FENDO.2019.00075.
[21] ZHANG Y,LIU MW,HE Y,et al. Protective effect of resveratrol on estrogen deficiency-induced osteoporosis though attenuating NADPH oxidase 4/nuclear factor kappa B pathway by increasing miR-92b-3p expression[J]. Int J Immunopathol Pharmacol,2020. DOI:10.1177/205873- 8420941762.
[22] WOOTTEN D,MILLER LJ. Structural basis for allosteric modulation of class BG protein-coupled receptors[J]. Annu Rev Pharmacol Toxicol,2020. DOI:10.1146/ANNUREV-PHARMTOX-010919-023301.
(收稿日期:2020-08-18 修回日期:2020-11-05)
(編輯:唐曉蓮)

