雙參數MRI 影像組學模型對前列腺良性增生結節和前列腺癌的鑒別價值*
邢朋毅,馬 超,陽青松,陸建平
前列腺癌是世界范圍內老年男性常見的惡性腫瘤之一,其發病率居美國男性腫瘤首位,病死率居男性腫瘤第二位[1],近年來我國前列腺癌的發病率亦不斷增加[2]。直腸指檢(directeral rectun examination,DRE)和前列腺特異性抗原(prostate specific antigen,PSA)篩查已成為前列腺癌診斷的公認方法。 但DRE 并不是前列腺早期病變的敏感工具,且需要長期的隨訪檢測,異常則多提示晚期癌癥[3]。 盡管PSA 篩查降低了前列腺癌患者的病死率,但篩查效率較低并存在局限性,假陽性率高,且隨后要進行不必要的前列腺活檢[4-6]。 此外,患有良性前列腺增生的患者也可以檢測到較高的PSA 水平[7,8]。
隨著多參數磁共振的應用推廣,越來越多的局灶性前列腺癌被檢出,該技術能夠精確定位,使得前列腺癌的早期精準治療成為可能[9]。 影像組學將傳統的影像圖像轉換為可挖掘的數據信息,并對之進行高通量定量分析,突破了基于形態學及半定量分析的傳統影像醫學模式, 融合了數字影像信息、統計學、機器學習等方法,充分深入挖掘和分析隱含在圖像中的額外信息,最高效地利用影像學檢查結果[10]。 當前影像組學在前列腺良惡性病變的鑒別、預后評價等方面的應用愈加廣泛。 筆者利用前列腺癌MRI 影像組學方法探討其對良性前列腺增生結節和前列腺癌的鑒別價值。
1 資料與方法
1.1 一般資料搜集2015 年3 月—2017 年6 月筆者醫院經手術病理證實的前列腺結節157 例作為研究對象,其中良性結節92 例,惡性結節65 例,年齡37~86 歲,平均(67±8)歲,血清前列腺特異抗原水平1.13~120.25 ng/ml,平均(24.17±21.24) ng/ml。納入標準:(1)術前接受MRI 平掃+增強檢查,且檢查時間與手術時間間隔<7 d;(2)術前經第二版前列腺影像報告和數據系統(Prostate Imaging Reporting and Data System version 2,PI-RADS v2)評分為≥2 分;(3)病灶直徑>5 mm;(4)在MRI 檢查之前未進行前列腺活檢、手術、放射治療或內分泌療法,且未見骨及其他遠處轉移灶。
1.2 檢查設備與方法采用3T MR 系統(MAGNETOM Skyra,Siemens Healthcare,Erlangen,Germany) 使用標準的18 通道相控陣體部線圈和32 通道集成脊柱線圈。 患者檢查前一天進食少渣食物,檢查前禁食4~6 h,檢查時盡量排空腸道及膀胱。 檢查時用綁帶對線圈進行固定,并用沙袋加壓,以減少患者呼吸運動產生的偽影。 橫軸位DWI 的主要參數:重復時間/回波時間(TR/TE)=5100/89 ms,視野(FOV)=224×280 mm2,矩陣=120×150,層數=20,層厚=4 mm, 層間距=0 mm,b 值=0,1500 s/mm2,采集時間=7m59s。 前列腺行橫軸面、矢狀面、冠狀面三方位2DT2WI 快速自旋回波序列掃描, 橫軸位T2WI 掃描參數為TR/TE=5460/104 ms,FOV=180×180 mm2,矩陣=384×384,層數=24,層厚=4 mm,層間距=0 mm,回波鏈長度=18,采集時間=3m49s。 橫軸位DWI 掃描在定位時盡量保證和T2WI 序列層面一致。
1.3 前列腺病理結果所有患者均經MR 引導下行前列腺靶向穿刺活檢或前列腺根治全切術(RP)。病理標本經HE 染色及免疫組織化學分析,由一名具有18 年經驗的泌尿病理專家觀察組織學切片,并確定病灶所在位置和邊界,診斷為癌者,則進行病灶的Gleason 評分, 選取具有最高Gleason 評分的臨床顯著癌病灶(體積≥0.5 cm3)進行分析,評分依照國際泌尿外科病理學會(ISUP)2014 年共識會議制定的前列腺癌分級指南[11]。 診斷為前列腺良性結節的患者, 選取直徑最大的結節進行病灶分析。
1.4 前列腺結節病灶分割及影像組學分析
1.4.1 病灶分割 由具有前列腺診斷經驗的8 年資質的放射科醫師使用ITK-SNAP 軟件繪制前列腺結節病灶的2D ROI。 使用T2WI 圖像來分割感興趣區域(ROI),并將參照DWI(b=1500 s/mm2)圖像進一步確定病灶范圍, 并與ADC 圖的ROI 進行匹配。 在符合納入標準的靶病灶上,于具有最大結節半徑的軸位層面圈劃ROI,并仔細排除周圍的非病灶結構。 為了驗證分割的效果,筆者在隊列中隨機選擇了30 張圖像, 并且該放射科醫師在間隔2 周后再次繪制ROI。采用R 軟件(http://www.Rrproject.org,Version:3.4.4)對數據進行一致性檢驗,計算2次圈劃的ROI 所提取的特征之間的組內相關系數(intraclass correlation coefficient,ICC), 保 留2 次ICC 均>0.75 的特征。
1.4.2 特征提取 利用影像組學軟件包提取影像組學特征。 在特征計算之前,首先對圖像進行預處理,主要包括體素重采樣、灰度離散化和圖像強度歸一化三個步驟。 將圖像重采樣到[1,1,1]體素大小,以確保體素各向同性,并且其特征是旋轉不變的。 灰度離散化有助于減少計算量,應用箱寬20 來離散灰度級, 利用μ±3σ 法進行強度歸一化以擴大類別之間的差異, 然后提取特征并對其進行分類,共提取影像組學特征396 個,42 個直方圖特征,180個RLM 特征,9 個形態特征,11 個GLSZM 特征,10個haralick 特征,144 個GLCM 特征。
1.4.3 特征選擇與模型構建 受試者按7∶3 的比例分為訓練隊列和驗證隊列。 采用雙特征選擇的方法對特征進行過濾。首先使用mRMR 方法排除了大部分特征,只保留了30 個特征之間的冗余度最小、與目標標簽相關性最大的特征。 然后,通過選擇優化的超參數λ 來選擇預測偏差最小并且最具預測性的特征子集 (圖1)。 最后利用剩余的特征用多元Logistic 回歸建立模型,并計算每個受試者的影像組學特征,通過特征乘以其相應的系數來計算影像組學標簽(圖2、3)。
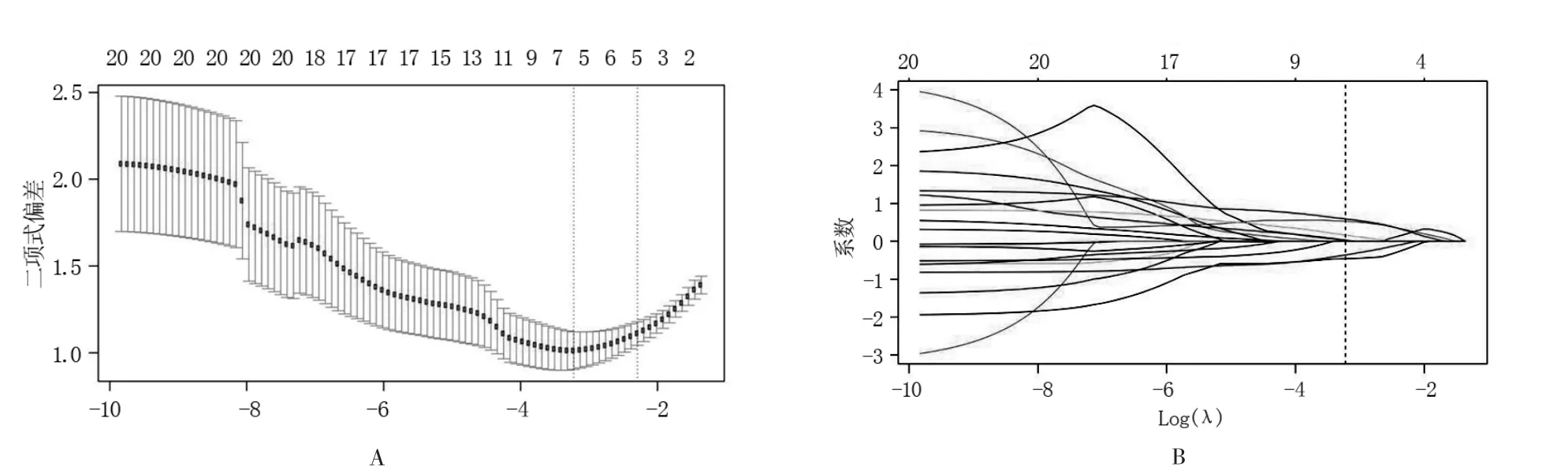
圖1 雙參數MR 聯合模型影像組學特征的選擇

圖2 雙參數MR 聯合模型篩選出的影像組學特征
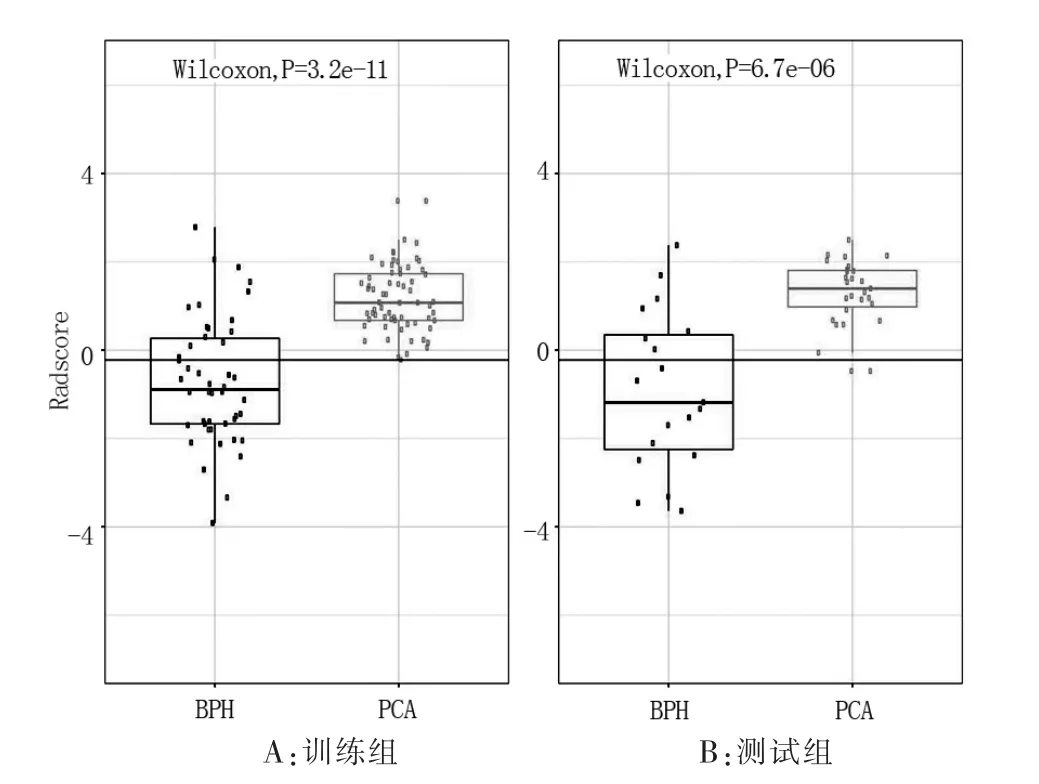
圖3 雙參數MR 模型訓練組與測試組影像組學評分的比較
1.4.4 模型驗證 使用ROC 分析來驗證不同模型的性能,基于T2WI 和ADC 圖在訓練隊列和驗證隊列中的表現。 為了得到更穩健的結果,筆者進行了100 次LGOCV(留組交叉驗證法),得到100 條ROC曲線的平均AUC,然后用Mann-Whitney U 檢驗比較不同模型之間的差異。 用DeLong 測試來比較不同模型的診斷效能,即曲線下面積(AUC)的對比,得到不同模型ROC 曲線的P 值,P<0.05 為差異具有統計學意義,最后用決策曲線比較每個模型的臨床實用性。
1.5 統計學分析采用R 軟件進行統計學分析。以受試者操作特征(receiver operating characteristic,ROC)曲線評價預測模型的影像組學評分在訓練組和測試組中鑒別前列腺良性增生結節和前列腺癌的效能,獲得靈敏度、特異度、準確率、陰性預測值(NPV)、陽性預測值(PPV)及ROC 曲線下面積(area under curve,AUC)。 校準曲線用于評測影像組學評分的預測結果與病理結果的一致性。采用χ2檢驗比較2 組患者年齡、病灶大小及PSA 值分布,采用獨立樣本t 檢驗 (方差齊) 或Mann Whitney U 檢驗(方差不齊) 比較訓練組和測試組患者年齡及PSA值的差異。 P<0.05 為差異有統計學意義。
2 結 果
3 種影像組學模型對前列腺良性增生結節和前列腺癌的診斷效能比較見表1。 表1 列出了3 種模型的AUC、準確性、敏感性和特異性,圖4 顯示了這3 種模型的ROC 曲線。訓練組及測試組中3 種組學模型預測前列腺結節良惡性的校準曲線(圖5),提示預測結果與病理結果一致性較好。ADC 影像組學模型、T2WI 影像組學模型和雙參數影像組學組合模型的決策曲線如圖6 顯示,無論是單參數影像組學還是雙參數組合模型對前列腺良性增生結節和前列腺癌都有一定的預測效能。
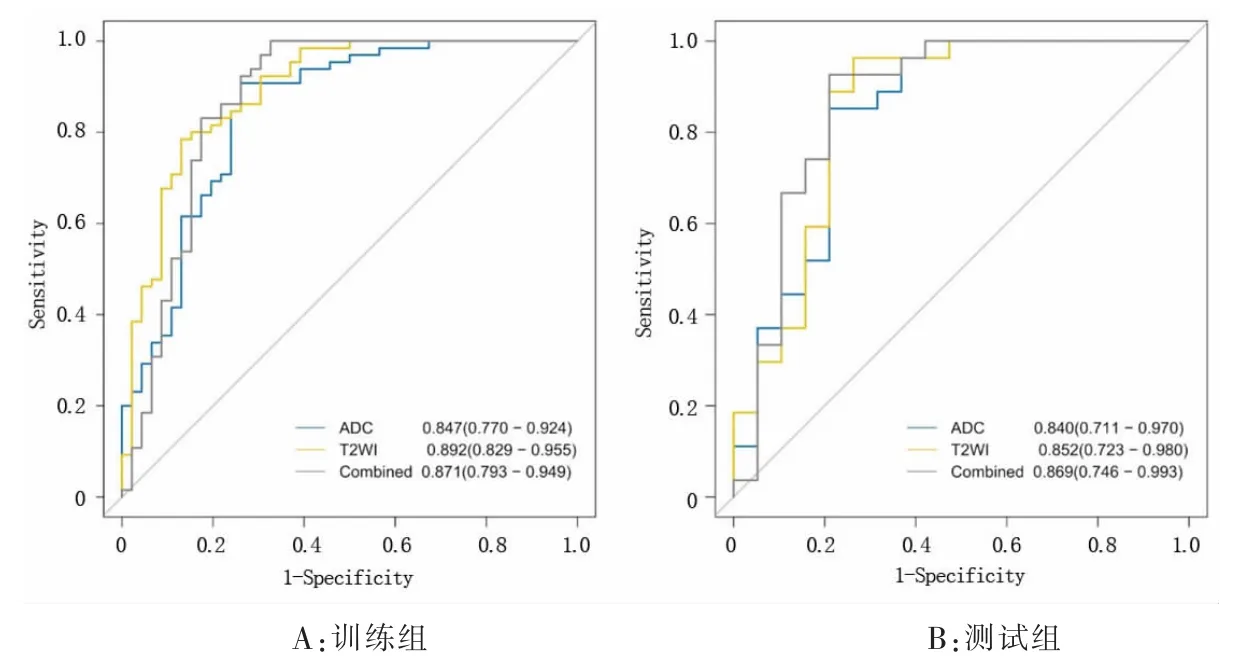
圖4 基于MR 的3 種影像組學模型診斷良惡性前列腺結節的受試者操作特征(ROC)曲線
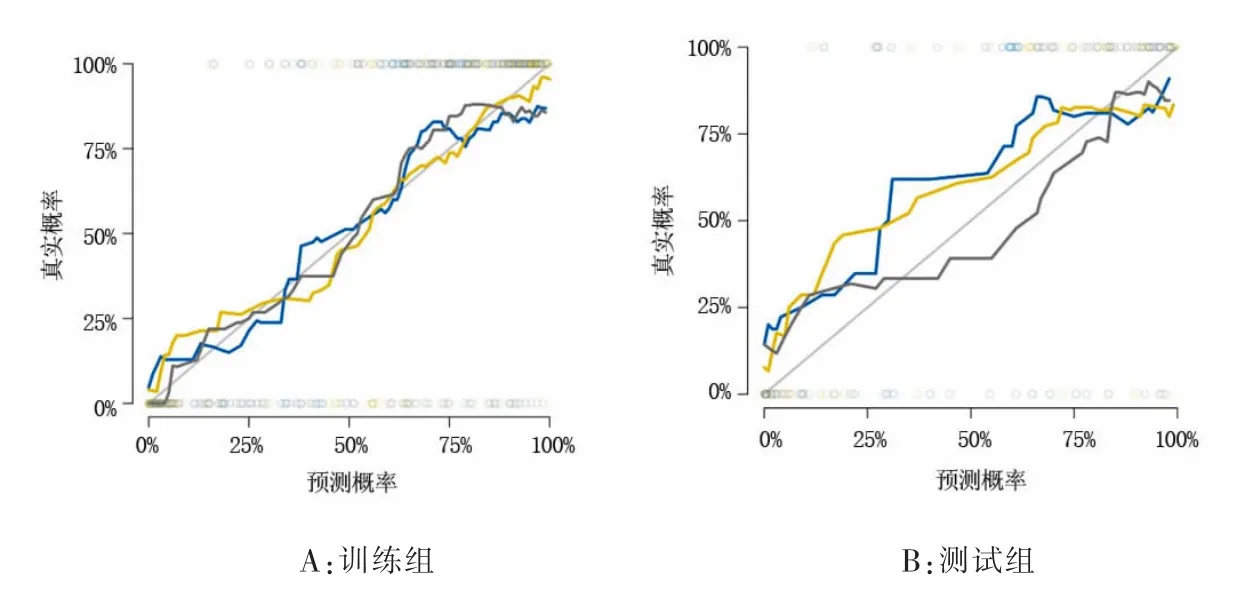
圖5 3 種影像組學模型預測前列腺結節良惡性的結果與病理結果一致性的校準曲線
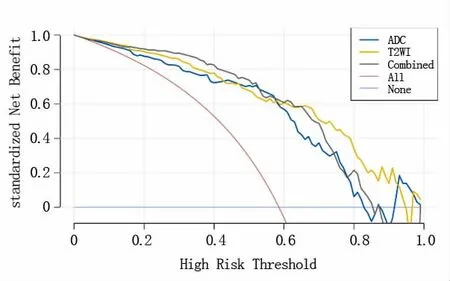
圖6 決策曲線評價3 種影像組學模型的臨床應用價值
3 討 論
前列腺特異抗原(PSA)水平升高或直腸指診異常的前列腺癌疑似患者,要進行標準的經直腸超聲引導下穿刺活檢, 這種方法會出現高級別的前列腺癌檢測不足和低級別的腫瘤過度檢出[12],多數患者進行了過度的治療以及隨訪檢測, 增加了患者和醫療保健部門的成本[13,14]。 隨著前列腺影像報告和數據系統(PI-RADS)的提出以及基于大數據、人工智能的影像組學蓬勃發展, 多參數磁共振成像(mp-MRI)成為前列腺疾病影像學檢查的最佳選擇,在前列腺癌早期診斷、治療方案選擇、療效評估及預后評價等方面具有重要價值。研究表明,bp-MRI(包括T2WI+DWI) 與mp-MRI (包括T2WI+DWI+DCEMRI) 的診斷效能和準確性相當,bp-MRI 的閱片者間一致性良好,圖像采集和解讀時間較mp-MRI 明顯縮短,且無須使用對比劑[15]。而DCE-MRI 的釓劑不良反應、額外的掃描時間和成本、閱片者間一致性較差等不足可能抵消其有限的輔助價值[16,17]。 基于雙參數MR 診斷篩查前列腺癌的衛生經濟學評價,筆者建立bp-MRI(包括T2WI+DWI)影像組學模型對前列腺良性增生病灶和前列腺癌進行鑒別。
術前經第二版前列腺影像報告和數據系統(PI-RADS v2.1)評分為3 分的前列腺結節病變,僅僅依靠單純的影像學鑒別比較困難。 醫學圖像中的宏觀異質性可能反映組織病理學水平上的微觀異質性[18,19],從 前 列腺MR 的T2WI 和ADC 圖中 提 取的影像組學特征可以作為鑒別良性前列腺增生結節和前列腺癌的潛在生物標志物。 雖然這是一個初步的工作,但基于MR 雙參數影像組學模型可能為評估前列腺癌的生物學特性和異質性提供一種無創的工具。 在病理學層面,良性前列腺增生結節和前列腺癌的內部細胞成分、液體含量、膠原水平和纖維肌肉間質特征存在差異, 前列腺癌分化較差,細胞密度高,細胞外間隙減少。 大量研究表明,這些組織病理學特征的差異可以通過定量分析和影像組學方法反映出來,影像組學模型所提取的紋理參數可用于前列腺癌的診斷和風險分類。Wibmer 等[20]使用T2WI 和ADC 圖, 證明Haralick 紋理分析的5個參數(能量、熵、相關性、均勻性和慣性)對評估前列腺癌和,Gleason 評分是有利的,特別是GS≤3+4和≥4+3 癌的能量和熵的ADC 圖有顯著差異。Sidhu 等[21]的研究結果表明,ADC 峰度和T1熵的紋理特征可以區分顯著的移行帶的前列腺癌,這兩個參數組合的AUC 值為0.86。 Nketiah 等[22]的研究顯示,結合T2WI 紋理特征[角二次力矩(ASM)、對比度、相關性和熵]比使用基于MRI 的生理參數[ADC和DCE 藥動學參數(Ktrans和Ve)]聯合使用(AUC:0.75)產生更高的分類性能(AUC:0.82)。 這些研究納入的患者數量相對較少,研究方法只側重于幾個有限的紋理特征的提取以及前列腺癌的惡性風險分級。 該研究擴展提取圖像紋理特征類型,建立基于MR 雙參數圖像的影像組學模型研究對良性前列腺增生結節和前列腺癌進行鑒別,對前列腺疾病的早期篩查和前列腺癌的診治有較高的臨床應用價值。
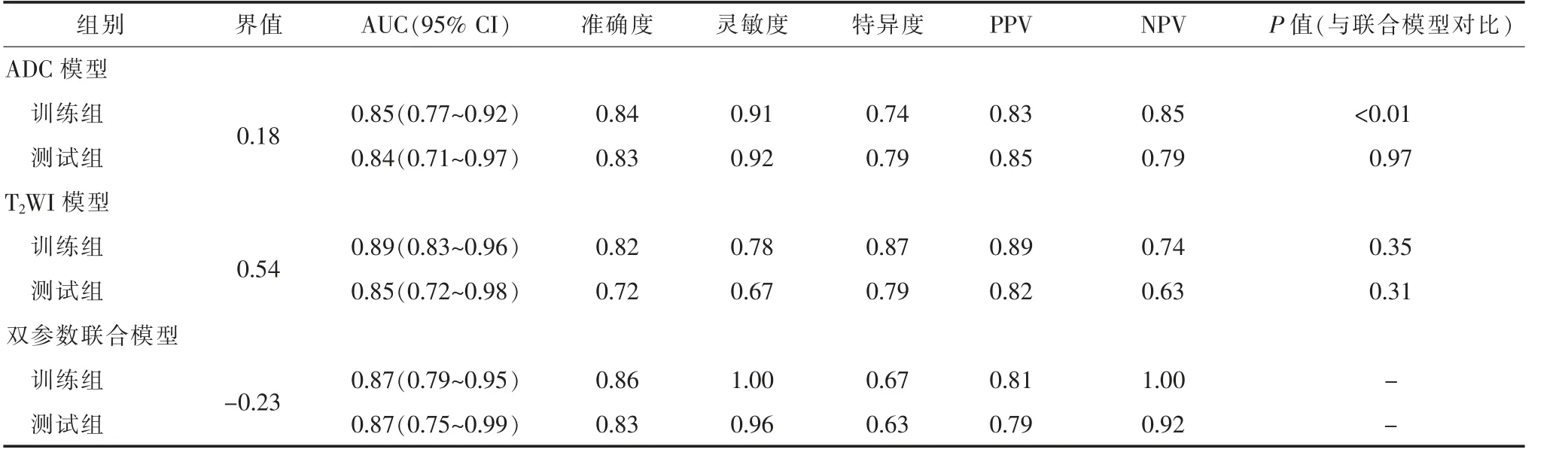
表1 3 種影像組學模型對前列腺良惡性結節的鑒別
該研究具有一定的局限性,首先,這是一項在單一機構進行的回顧性研究,雖然從這一組患者中提取了部分數據作為測試集來驗證模型,但只有進行大樣本量的多中心驗證才能獲得更好的臨床應用證據。 該研究病理結果的取得是通過穿刺或前列腺全切,依據穿刺結果圈劃的感興趣區可能偏差較大, 病理和MRI 對癌灶匹配具有一定的局限性,一些在MRI 上難以觀察到的病變,筆者根據病理結果和易于識別的MR 成像序列繪制病灶輪廓,部分病灶可能未包括在內,該研究的病理金標準應該是根治性前列腺切除術后標本的病理大切片, 并非TRUS 前列腺系統活檢, 穿刺病理可能降低了前列腺癌評估的準確性,不能準確反映前列腺真實的病理狀態,因此,下一步針對具有前列腺癌根治術病理大切片的患者,要加大研究樣本量。 目前,進行影像組學分析前的病灶識別與放射科醫師的診斷水平具有較大相關性。 計算機輔助分析技術有助于解決診斷標準化的問題,用計算機基于活體MRI 制備三維模型來指導切片,以獲得MRI 與病理切片的精確匹配,將有助于提高影像組學分析結果對前列腺MR 圖像解釋的可重復性。
雖然該研究建立的影像組學模型是定量的、相對客觀的,取得了較好的效果,但影像組學特征需與年齡、PSA 值、PI-RADS 評分等臨床指標進行聯合驗證比較,才能更準確地反映患者客觀的臨床狀態。

