改良背主動脈注射法對雞胚發育與轉基因表達效率的影響
韋金魚,韋蘢芹,徐小明,邢青波,肖艷宇,許夢緣,吳文德,李恭賀,鄭喜邦
(廣西大學動物科學技術學院,廣西南寧 530004)
家禽轉基因在提高家禽產肉產蛋率、提高抗病能力、建立生物反應器模型等方面具有重要的應用價值[1-3]。相比于哺乳動物生物反應器,禽類輸卵管生物反應器具有孵化時間短、世代間隔短、繁殖速度快、生產成本低、產量高等諸多優點[4-9]。目前,轉基因雞研究面臨的困難是無法采用核移植手段產生轉基因雞[10-11]。1988年,Perry[12]開發了雞胚培養體系(System I~III)。在System II 階段,將來自新鮮受精蛋的供體全胚轉移到受體蛋殼中;在System III 階段,將培養2.5 d 的雞胚轉移到更大的受體蛋殼中,繼續培養至出殼。雖然胚盤下腔注射法技術簡單,但注射后的雞胚需要進行2 次換殼,對雞胚造成較嚴重的機械性損傷,雞胚存活率低。傳統背主動脈注射法就是通過蛋殼鈍端開窗,將外源基因注射到HH14~16 期雞胚背主動脈中,封閉窗口,繼續孵化出殼[13]。背主動脈注射法的優點是無需換殼培養,缺點是殼內注射精準度低,轉基因效率也隨之下降[14],也不能對轉基因雞胚發育過程進行直視觀察。因此,傳統背主動脈注射方法有待改進。
本實驗采用殼外背主動脈注射與System III 換殼培養相結合,對傳統背主動脈注射法進行改良,對比改良背主動脈注射法與其他2 種注射法對轉基因雞胚存活率、孵化率及轉基因表達效率的影響。
1 材料與方法
1.1 實驗材料和試劑 本實驗所用受精蛋及非受精蛋(System II 待用受體)采購于廣西南寧富鳳農牧有限責任公司;雙黃蛋(System III 待用受體)購自南寧良鳳農牧有限責任公司;注射用AAV 病毒顆粒(HBAAVCMV-EGFP)購自上海漢恒生物科技有限公司,滴度為1×108轉導單位(Transducing Units,TU)/mL。
1.2 實驗分組 實驗組分別為X 期雞胚胚盤下腔注射組(以下簡稱胚盤下腔注射組)、HH14~16 期雞胚背主動脈注射組(以下簡稱傳統背主動脈注射組),HH14~16 期雞胚改良背主動脈注射組(以下簡稱改良背主動脈注射組)。各實驗組每次均注射30 枚受精蛋,進行5 次獨立實驗,各組共注射150 枚受精蛋。空白對照組不做任何處理,每次入孵12 枚受精蛋,總共入孵60 枚受精蛋。
雞胚孵化期間,每天觀察雞胚發育情況,記錄雞胚存活率。雞胚孵化出殼后,統計孵化率。對新鮮死亡的雛雞或引頸處死后的雛雞,用熒光蛋白手電筒照射觀察雛雞體表和內臟組織是否有綠色熒光蛋白表達,并統計EGFP 陽性率。
1.3 EGFP-AAV 顯微注射方法
1.3.1 胚盤下腔注射法 初產受精蛋作為供體,選擇比供體重3~5 g 的非受精蛋作為System II 受體,稱重并逐一配對,用0.01% 苯扎溴銨溶液清洗受精蛋與受體蛋殼外表面,再用75% 酒精噴灑消毒。用微型電磨機在受體蛋尖端切開直徑為32 mm 窗口,棄去內容物,蒸餾水沖洗內、外表面。受體蛋窗口朝下,放置在一個內襯濕潤紗布的陶瓷盤里。在超凈工作臺內輕輕敲破受精蛋蛋殼,將全胚移入System II 受體蛋殼中,使胚盤上浮,用口吸管連接顯微注射針,在體視顯微鏡下,借助冷光源照射,將2 μL EGFP-AAV 病毒注射至胚盤下腔,Saran Wrap 保鮮膜(5 cm×5 cm)封閉蛋殼窗口,窗口朝下,放入雞胚培養箱中,在37.8℃,相對濕度為60%的條件下培養2.5 d。對于存活雞胚,選擇比相應供體重30~35 g 雙黃蛋作為System III 受體。受體蛋殼的處理方法同System II,不同之處就是在受體蛋殼的鈍端開窗,直徑為42~45 mm。將存活雞胚轉移到System III 受體蛋殼中,Handi-Wrap 保鮮膜封閉窗口,窗口朝上,放入培養箱,繼續培養至出雛(圖1)。
1.3.2 傳統背主動脈注射法 將受精蛋置于孵化箱孵化,孵化條件為溫度37.8℃,相對濕度60%。孵化約2.5 d 后,將受精蛋鈍端朝上,水平靜置1~2 h。使用照蛋器確定氣室位置,并用鉛筆標記。75%酒精棉球擦拭蛋殼,用鑷子在鉛筆標識區域中央開一個直徑為 1~1.5 cm 窗口,殼膜表面滴加少許滅菌生理鹽水,撕破殼膜,口吸管連接顯微注射針,將2 μL EGFP-AAV 病毒液注射至雞胚背主動脈中。使用封口膜(Parafilm)封閉窗口。窗口朝上,繼續培養,直至出雛(圖2)。

圖1 胚盤下腔注射與換殼培養
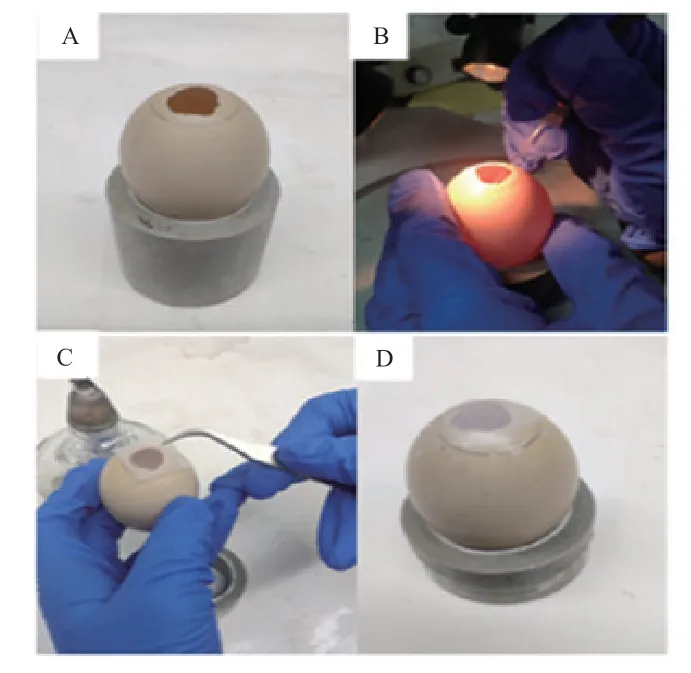
圖2 傳統背主動脈注射法
1.3.3 改良背主動脈注射法 新產受精蛋用作供體,稱量并記錄重量,將其放入溫度為37.8℃、相對濕度為60%的培養箱中。對發育至HH14~16 期(約2.5 d)雞胚,選用比相應供體重30~35 g 雙黃蛋為受體。受體蛋殼的處理方法同胚盤下腔注射法System III。用75%的酒精擦拭供體蛋殼表面,在超凈臺內輕輕敲破蛋殼,將全胚倒入一次性稱量盤中,雞胚朝上,口吸管連接顯微注射針,在體視顯微鏡下,2 μL EGFP -AAV 病毒注射至雞胚背主動脈中。將注射后的雞胚移入受體蛋殼內,Handi-Wrap 保鮮膜封閉窗口,窗口朝上放入培養箱,繼續培養至出雛(圖3)。
1.4 統計分析 計算培養至第8、14、18、21 天轉基因雞胚存活率和14 d 至出殼后雞胚EGFP 陽性檢出率。采用SPSS 22.0 單因素方差分析方法分析不同試驗組間的差異顯著性。P<0.05 表示差異顯著,P<0.01 表示差異極顯著。
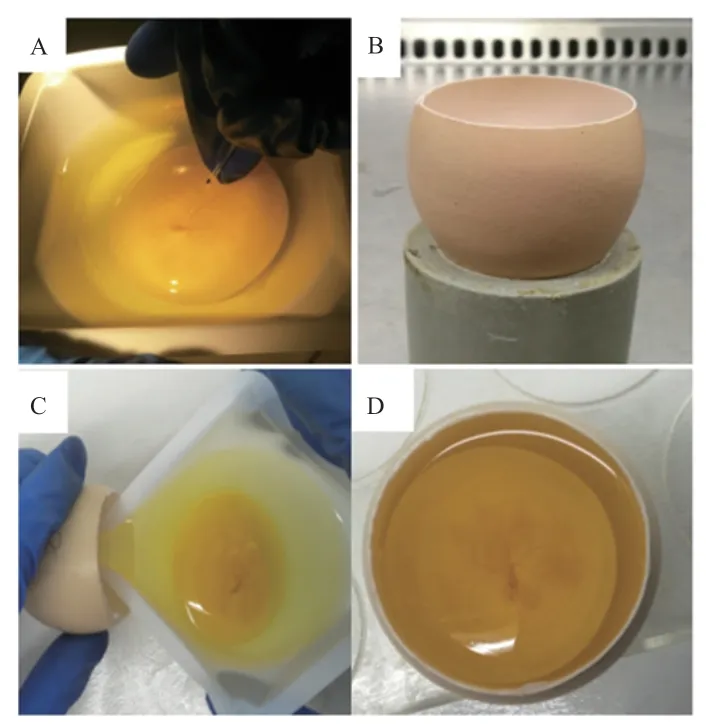
圖3 改良背主動脈注射法及換殼培養
2 結果
2.1 不同注射方法對雞胚發育的影響 如圖4 所示,雞胚發育至8 d 時,胚盤下腔注射組與傳統背主動脈注射組的雞胚存活率無顯著差異。然而,改良背主動脈注射組雞胚存活率高于傳統背主動脈注射組(P<0.01)。隨著時間推移,雞胚存活率總體呈現下降趨勢。但當雞胚胎發育至14、18、21 d 時,改良背主動脈注射組的存活率高于胚盤下腔注射組(P<0.05 或P<0.01)和傳統背主動脈注射組(P<0.01)。
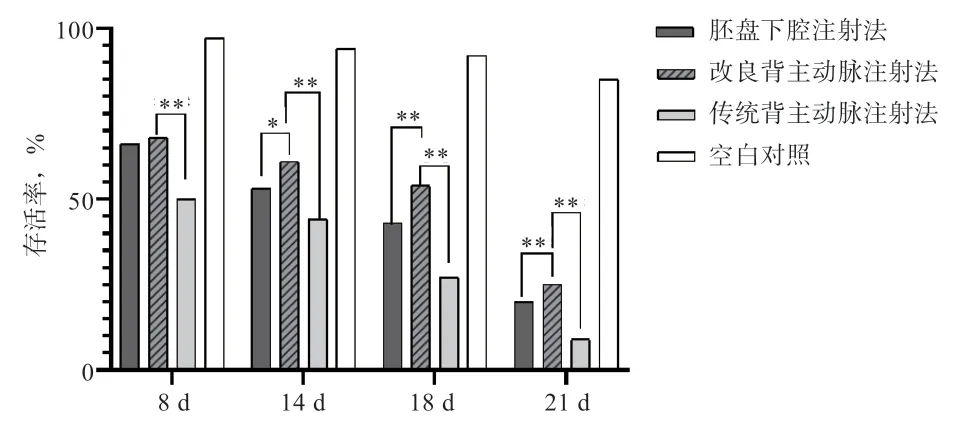
圖4 3 種注射方法對雞胚存活率的影響
2.2 不同注射方法對雞胚孵化率的影響 如圖5 所示,改良背主動脈注射組轉基因雞胚孵化率(37%)高于胚盤下腔注射組(26%)和傳統背主動脈注射組(16%)(P<0.01)。
2.3 不同注射方法對雞胚EGFP 表達效率的影響 對新鮮死亡或引頸處死后的雛雞,用熒光蛋白手電筒及其適配濾光鏡觀察綠色熒光蛋白的表達情況。單因素方差分析結果表明,改良背主動脈注射組雞胚EGFP 陽性率高于胚盤下腔注射組與傳統背主動脈注射組(P<0.01)(圖6)。EGFP 多在心臟、膽囊、胸骨、皮膚、喙等部位表達(圖7)。

圖5 3 種注射方法對雞胚孵化率的影響
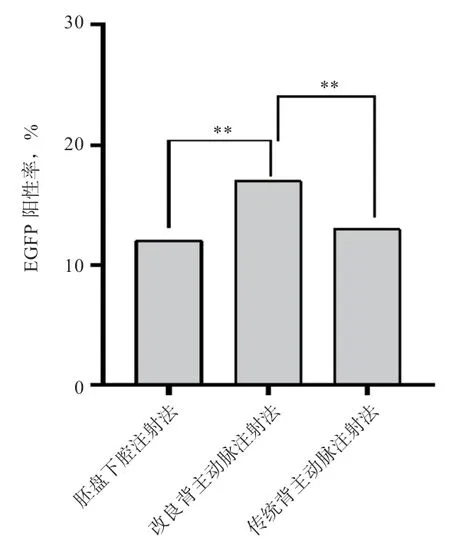
圖6 3 種注射方法對雞胚EGFP 表達效率的影響
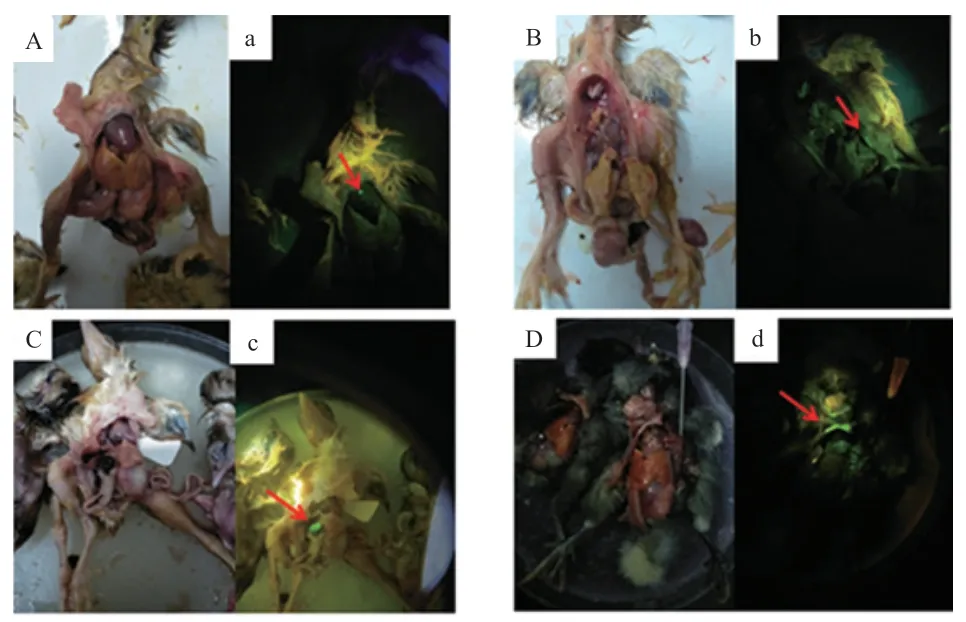
圖7 轉基因雞胚EGFP 檢測
3 討 論
換殼培養對禽類胚胎生物學基礎研究和轉基因家禽研究具有重要作用。本實驗中,胚胎從System II 至System III 階段胚胎存活率逐漸下降的原因之一,可能是由于胚胎換殼操作而引起的胚胎損傷所致[15-16]。另外,胚盤下腔注射和背主動脈注射也對胚胎造成機械性損傷,這也是造成胚胎死亡的原因。本實驗中改良背主動脈注射組轉基因雞胚孵化率高于胚盤下腔注射組,是因為前者只需要1 次換殼培養操作,對雞胚造成的機械性損傷小于后者。
顯微注射方法是生產轉基因嵌合體雞最為關鍵的環節,在不同發育時期進行顯微注射可能會直接影響后續胚胎存活率和外源基因的表達效率。作為精子和卵子的前體細胞,原始生殖細胞(Primordial Germ Cells,PGCs)被認為是制備轉基因雞較為理想的靶細胞,通過體內轉染或轉導PGCs 有希望獲得轉基因雞[17-18]。新產受精蛋已經處于雞胚發育HH 10 期,位于胚盤和卵黃之間的胚盤下腔內已經有5 萬~6 萬個胚胎細胞,但其中只有40 個PGCs;在HH 14~16 期(約2.5 日齡),當血島和血管形成時,PGCs 進入血液循環,其數量增加至100~200 個[18]。這也是本實驗改良背主動脈注射組轉基因雞胚EGFP 陽性率高于胚盤下腔注射組的原因。相對于傳統背主動脈注射法,改良背主動脈注射法實現了殼外背主動脈注射,提高了注射的準確度,進而提高了轉基因雞胚胎組織EGFP 陽性率。
種族親緣關系的遠近(種族發生間隔)也是影響孵化率的另一個因素。分別從雞、火雞、珍珠雞和鴨蛋分離稀蛋清作為受體蛋清,雞蛋殼作為System III 階段受體,雞胚在這些不同受體蛋清和相同受體蛋殼中的孵化率分別為60.4%、55.3%、47.9% 和19.1%[15],證明了雞胚在雞蛋清和雞蛋殼中的孵化率最高。因此,選用親緣關系較近的禽蛋作為受體進行換殼培養,就可以減少雞胚死亡率。在本實驗的System II 至System III 階段,均采用雞蛋清和雞蛋殼作為受體,在一定程度上降低了雞胚死亡率。
禽類胚胎在發育過程中高度依賴蛋殼,蛋殼不但可以保護胚胎免受物理應激和微生物感染,還能調節水分和提供礦物質;受體蛋殼的厚度和封口膜材質影響孵化率[19]。通過受體蛋殼改善氧氣供應是胚胎體外培養的重要因素,不同受體蛋殼會造成不同孵化率[20]。本實驗中,改良背主動脈注射組和胚盤下腔注射組均采用雞雙黃蛋為System III 受體,盡管有顯微注射操作造成的機械性損傷,改良背主動脈注射組和胚盤下腔注射組轉基因雞胚孵化率分別達到37%和26%。這可能是因為雙黃蛋用作System III 受體蛋殼,其厚度與供體雞胚蛋殼相等,改善了氧氣供應,防止因蛋殼厚度不同而導致的缺氧。封口用塑料薄膜造成的水分蒸發不足和透氣性欠佳也會導致雞胚死亡,進而降低孵化率[21-22]。在System III 階段,受體窗口封閉時,相對于Saran Wrap 膜,Handi-Wrap 膜封口后的孵化率提高了30%[11]。
位于蛋殼內的絨毛尿囊膜是很重要的膜系統,其與發育雞胚氣體交換和從蛋殼攝取鈣等礦物質直接相關。因此,正常膜系統發育是保證禽類胚胎正常孵化的前提條件。在換殼培養體系中,氧氣供應不足是一個重要問題。Kamihira 等[20]在胚胎發育后期供氧,使鵪鶉在雞蛋殼內的孵化率達到35%,減少了胚胎死亡率。但此種做法會提高實驗成本,在大規模實驗中缺乏可操作性。有研究報道,在無蛋殼體外培養體系中,利用可透氣的聚四氟乙烯膜[15]或聚二甲硅氧烷膜[23]用作替用蛋殼能獲得穩定的孵化率。這是因為聚四氟乙烯膜和聚二甲硅氧烷膜能夠保證各方向的氣體交換,同時,其疏水表面有利于絨膜尿囊膜的正常發育[19]。從氣體交換和絨毛尿囊膜的正常發育考慮,聚四氟乙烯膜和聚二甲硅氧烷膜可能是適宜的蛋殼替代品[15,19]。本實驗采用了Handi-Wrap 保鮮膜作為受體蛋殼窗口封閉材料,不具有疏水和透氣特性。如果將透明聚四氟乙烯膜或聚二甲硅氧烷膜作為System III 階段受體蛋殼封口膜,可能會進一步提高轉基因雞胚孵化率。
總而言之,改良背主動脈注射法實現了對雞胚的殼外背主動脈注射和對雞胚發育全過程的直視觀察,提高了注射的準確率,進而提高了轉基因雞胚孵化率和轉基因表達效率,改良背主動脈注射法對轉基因雞研究具有重要應用價值。

