動態血壓與動態心電圖聯合在腎實質性高血壓監測中的作用
張亞男 姚麗娜 牛文明 來子曼 劉希杰
高血壓為最常見的慢性病,臨床上高血壓病分為原發性高血壓和繼發性高血壓,而腎實質性高血壓是繼發性高血壓中最常見的一種,是由于各種原因引起的腎臟實質性病變所導致的血壓升高,包括各種原因引起的急慢性腎小球腎炎、糖尿病腎病、多囊腎等[1]。腎實質性高血壓的發病機制較為復雜,當腎交感神經興奮時,釋放去甲腎上腺素,并且可以激活腎素-血管緊張素-醛固酮系統,引起外周及腎臟血管收縮及阻力增加,從而引起血壓升高及腎功能的進一步惡化[2]。腎實質性高血壓與腎功能狀態有關[3]。腎實質性高血壓患者除了高血壓本身引起的心、腦、腎等臟器的損害外,還可有電解質紊亂、內分泌失衡等原因引起的獨立于高血壓之外的心腦血管損傷[4,5]。因此,較早預防、診斷和治療,既可以有效控制血壓,也可以達到較好的控制并發癥,延緩心、腦、腎等器官的損害。以往只關注患者診室血壓,然而很多診室血壓控制較好的患者,尤其是腎實質性高血壓患者,仍然會有不同程度的靶器官損傷。腎實質性高血壓的危害極大,應該積極進行預防和治療。在治療降壓的同時,應該注意保護腎功能。本研究通過監測腎實質性高血壓患者24 h動態血壓及動態心電圖變化,探討此類高血壓患者心血管事件與動態血壓的相關性,以及動態血壓與腎功能損害的關系。為預防、診斷和治療腎實質性高血壓患者及為此類血壓患者的靶器官保護提供臨床依據。
1 資料與方法
1.1 一般資料 選取我院2016年10月至2017年12月診斷為腎實質性高血壓患者50例(觀察組),患者經臨床癥狀,診室血壓以及診斷依據納入。根據臨床癥狀及肌酐水平情況,腎功能不全代償期(RICP)20例,其中男14例,女6例;年齡30~75歲,平均年齡(50.81±8.73)歲;體重47~70 kg,平均(60.20±9.45)kg;病程3~30個月,平均病程(5.72±0.43)個月。腎功能不全失代償期(RIDP)17例,其中男11例,女6例;年齡40~78歲,平均年齡(55.81±8.73)歲;體重50~70 kg,平均(60.20±9.45)kg;病程3~46個月,平均病程(12.54±0.78)個月。腎功能衰竭期(RF)13例,男9例,女4例;年齡42~76歲,平均年齡(50.81±8.73)歲;體重47~70 kg,平均(60.20±9.45)kg;病程3~56個月,平均病程(15.92±0.58)個月;另選同期治療的原發性高血壓患者50例為對照組,其中男27例,女23例;年齡25~72歲,平均年齡(47.82±7.36)歲;體重45~80 kg,平均(59.72±9.54)kg。觀察組與對照組患者年齡、性別比、體重等差異無統計學意義(P>0.05),具有可比性。
1.2 腎實質性高血壓的診斷依據[6](1)血壓超過正常范圍;(2)有明確的致高血壓的慢性腎臟病病史(如慢性腎炎、多囊腎等),且腎功能異常時間超過3個月,伴或不伴有腎小球濾過率(GFR)下降,血尿或病理等檢查異常;或GFR<60 ml·min·1.73 m-2,持續時間超過3個月。患者還需進行肝腎功能以及影像學檢查診斷,以排除嚴重肝腎、心肺功能障礙,嗜鉻細胞瘤以及其他任何原因引起血壓增高,排除因高血壓引起的腎臟病變,排除糖尿病等其他并發癥,排除心力衰竭等其他重要疾病。
1.3 檢測方法及標準 (1)2組患者均同時使用博英型號為PI200A-B的十二導聯同步心電圖行24 h動態心電圖監測,并同時使用AND TM-2430型動態血壓監測24 h動態血壓,選擇大小合適的袖帶縛于受試者左上臂,袖帶的下緣距離肘窩約2 cm,設定白天時間為(7∶00~22∶00)每30分鐘測量1次,夜間時間為(22∶00~次日07∶00)每60分鐘測量1次,監測期間患者保持正常活動和飲食,避免劇烈運動和較大情緒波動。應囑咐患者,袖帶充氣時應取坐位或上臂平放不動,上臂與心臟同水平,夜間測量時,應注意睡眠姿勢,避免左上臂被軀干或被物壓迫。24 h內有效監測次數>85%,或者連續缺漏測量超過1 h的,次日重新監測24h動態血壓。有效血壓數值標準設定:收縮壓70~260 mm Hg,舒張壓40~150 mm Hg。24 h動態心電圖心肌缺血診斷標準[7]:J點后80 ms開始測量ST段,ST段呈水平型或下斜型壓低>0.1 mV,持續時間>1 min,ST段恢復時間超過1 min后再次下降0.1 mV為再次發作。(2)2組患者行生化和尿檢,患者均需禁食>8 h,收集晨尿,抽取靜脈血液,采用美國貝克曼庫爾特AU5800全自動生化分析儀檢測尿微量白蛋白(mAlb)、血尿素氮(BUN)、血肌酐(Scr),試劑盒均購自上海君瑞生物技術有限公司。另外,患者同次尿液需進行尿常規檢查,以排除尿路感染,干擾本次尿液檢測結果。
1.4 觀察指標 比較2組患者動態心電圖及動態血壓,統計2組患者心率失常(各種類型的早搏,心房顫動,室性心動過速等)、ST-T改變情況、24 h平均收縮壓(24h SBP)、24 h平均舒張壓(24h DBP)、白天平均收縮壓(dSBP)、白天平均舒張壓(dDBP)、夜間平均收縮壓(nSBP)、夜間平均舒張壓(nDBP)、血壓類型(杓型及非杓型血壓)、晝夜變化節律以及晝夜血壓下降率、夜間血壓下降率=(日間收縮壓/舒張壓均值-夜間收縮壓/舒張壓均值)÷日間收縮壓/舒張壓均值×100%,下降率10%~20%為杓型,<10%為非杓型。
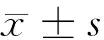
2 結果
2.1 2組杓型、非杓型血壓比較 非杓型血壓人數,觀察組68.00%(34/50)明顯高于對照組的36.00%(18/50),差異有統計學意義(P<0.01)。見表1。

表1 2組杓型、非杓型比較 n=50,例(%)
2.2 2組動態血壓比較 觀察組24 h SBP、dSBP、nSBP均高于對照組,差異有統計學意義(P<0.05或<0.01)。而2組患者24 h DBP、dDBP、nDBP組間差異無統計學意義(P>0.05)。見表2。

表2 2組動態血壓比較
2.3 2組心律失常及ST-T改變比較 觀察組夜間心律失常的發生率為34.00%(17/50)明顯高于對照組的16.00%(8/50),觀察組夜間ST-T改變的發生率為78.00%(39/50)明顯高于對照組的38.00%(19/50)(P<0.05),2組患者日間ST-T及心律失常的發生率,差異無統計學意義(P>0.05)。見表3。

表3 2組心律失常及ST-T改變比較 n=50,例(%)
2.4 mAlb、BUN、Scr與動態血壓的相關線性分析 以mAlb、BUN及Scr為因變量,以動態血壓相關參數為自變量,Spearman分析顯示,mAlb、BUN及Scr與24 h SBP、dSBP、nSBP呈正相關(P<0.05)。見表4。

表4 mAlb、BUN及Scr與動態血壓的Spearman相關性分析
3 討論
高血壓病是世界各國最常見的心血管疾病,其治療率僅占2/5,控制率僅占1/10[8],嚴重危害人類健康。長時間高血壓會引起心、腦、腎等靶器官的損害。
腎臟既是血壓調節的重要器官,又是高血壓損害的主要靶器官之一,血壓的進一步上升會使腎小動脈痙攣、硬化,腎小球高濾過、高灌注,使腎小球的濾過屏障遭到破壞,引起蛋白尿,蛋白尿又可導致腎小球高濾過,使腎小球毛細血管硬化加速及系膜細胞增生和纖維化。腎單位毀損加快,使腎功能進一步惡化,腎臟的加速病變又可進一步促進血壓的升高,使血壓較難控制,形成頑固性高血壓,二者相互作用,從而形成惡性循環。因此,對于腎實質性高血壓要加強重視,積極治療。
本研究結果顯示,腎實質性高血壓患者非杓型血壓為68.00%,原發性高血壓組為36.00%,差異有顯著性(P<0.05),腎實質性高血壓患者24 h SBP、dSBP、nSBP均高于對照組的患者,差異有統計學意義(P<0.05),但對24 h DBP、dDBP、nDBP的影響無統計學意義(P>0.05),提示在24 h動態血壓中,腎實質性高血壓以非杓型及收縮壓升高為主要表現,多表現為正常的晝夜節律減低或消失,夜間血壓無正常下降或有異常增高,而與舒張壓無明顯相關性。正常人在夜間睡眠時交感神經興奮性降低,體內的兒茶酚胺分泌也會減少,因而夜間血壓會比日間血壓有所減低,因此24 h血壓會呈現一種“雙峰-谷”的“杓”型生理節律性波動,而腎實質性高血壓患者血壓晝夜節律減弱或消失[9]。其原因可能是調節人體血壓的自主神經功能失衡。腎實質性高血壓會激活腎素-血管緊張素-醛固酮系統,血管阻力增加,不僅引起血壓的升高,還可能影響了自主神經的調節功能,故而夜間血壓升高。自主神經功能紊亂是慢性腎臟病患者血壓升高的機制之一:當腎組織發生損傷后,交感神經的興奮性增高,使血液中兒茶酚胺的水平升高,從而導致血管收縮、血管阻力增加、腎素釋放增加、腎小管重吸收水鈉增加,以此來調節血壓平衡,因此血壓升高。同時,當腎臟損傷缺血時,體內的激肽釋放也隨之減少,從而引起舒張血管作用的物質減少,也可導致血壓升高。
本研究顯示腎實質性高血壓患者夜間ST-T改變及心律失常發生率高于對照組,差異有統計學意義(P<0.05),提示慢性腎臟病患者夜間ST-T改變及心律失常的發生率較高,可能與CKD患者夜間血壓升高、晝夜節律消失有關。已有研究表明,動態血壓節律紊亂與心血管靶器官損害密切相關[10,11]。心血管事件的發生,是慢性腎臟病患者死亡的主要因素之一[12]。腎實質性高血壓導致ST-T改變及心律失常的機制較為復雜:高血壓會加重左心室后負荷,激活腎素-血管緊張素-醛固酮系統,進而導致左心室舒張功能障礙,降低了心室的順應性,使得心肌纖維變性,心房肌電位不穩定,從而發生各種早搏及心房顫動。外周阻力增加及左心室舒張末壓增加導致左心房增大,隨著血壓的進一步升高,左心室肥厚,代償能力增加,從而發生左心室重構。心臟在重構的過程中,出現心肌細胞的纖維化,肥厚的心室肌也可引起心肌電生理的異常及左心室功能障礙,從而導致各種室性心律失常。國外有研究報道,長期的高血壓狀態會刺激心室壁的化學感受器及機械感受器,引起心臟自主神經調節功能的失衡,因此增加了心肌電生理的不穩定性,降低了心室閾值,容易引起室性心律失常及心源性猝死[13]。
在慢性腎臟病的早期,憑借著腎臟強大的代償調節能力,可以滿足血壓升高所需要的排泄代謝產物,調節水、電解質平衡的能力的需要[14]。然而長期的高血壓可加速腎小球硬化,腎實質缺血,內皮細胞功能受損,腎小球濾過膜的通透性增加,電荷屏障的破壞以及尿白蛋白的含量增加。本研究顯示尿微量白蛋白(mAlb)、血尿素氮(BUN)、血肌酐(SCr)均與24 h收縮壓,夜間收縮壓成正相關,表明收縮壓尤其是夜間血壓越高,腎功能損傷越嚴重。 并且有學者研究顯示,夜間的高血壓較白天或全天的高血壓能更好的預測心血管事件的發生和CKD的進展[15],因此積極有效的控制血壓尤其是夜間血壓是延緩腎功能進展,預防心血管事件的發生的重要因素。根據《中國高血壓防治指南2018年修訂版》中指出,慢性腎臟病患者的降壓目標為:白蛋白尿<30 mg/d時,血壓降至<140/90 mm Hg,白蛋白尿在30~300 mg/d或>300 mg/d時降至130/80 mm Hg,>60歲的患者可以適當放寬降壓目標。現今治療高血壓的五大類藥中,血管緊張素轉化酶抑制劑類(ACEI)及血管緊張素Ⅱ受體拮抗劑類(ARB)多用于治療腎實質性高血壓患者,并且兩類藥物常常聯合使用。有研究顯示:強化減壓組中發生急性腎損傷或急性腎功能不全的比例高于正常降壓組[16],因此說明,對于腎實質高血壓患者尤其是CKD早期的患者,應綜合評定患者腎功能和血壓情況后進行降壓治療。
本研究中患者晝夜節律消失及夜間血壓增高許也是造成靶器官的重要因素。多項研究表明,非杓型高血壓是引起心血管事件的危險因素,并且隨著CKD分期的增加,非杓型高血壓的晝夜節律減弱或消失,不僅加速了腎臟功能的進一步惡化,還引起了其他臟器的損傷,因此,積極有效地預防、診斷和治療腎性高血壓,調整24 h動態血壓,維持血壓晝夜節律性,也許對延緩腎功能不全的發展,減少其他靶器官的損傷,改善患者的預后和生活質量有著重要的意義[17,18]。動態心電圖及動態血壓不僅能反應患者24 h的整體血壓情況,詳盡反應晝夜節律,ST-T功能,心律失常,及心率變異性等具體數值,還具有無創、方便的特性,為有效評價腎實質性高血壓患者血壓控制情況,預防心腦血管意外事件提供準確可靠的科學依據。

