miR-93在腫瘤發生發展中的作用機制
張 兵,祝永月,林 濤,陳 磊,李翠香,李秦瑞,沈體靜,蔣自文,何 喬,李東旭,趙 斌,殷德福,李高峰,梅加林
miRNAs是長度為20~25個核苷酸的非編碼RNA,通過抑制mRNA翻譯和誘導mRNA降解而調節靶基因的表達,人類大約30%的基因受miRNAs調節。研究發現,大量miRNAs在腫瘤中表達失調,發揮癌基因或抑癌基因的作用,參與調節腫瘤細胞的生長和轉移等過程。miR-93是miR-106b-93-25簇的成員,定位于7q22.1微小染色體維持復合蛋白(Minichromosome Maintenance Complex Component 7,MCM7)基因的第13號內含子中,其在多種腫瘤中表達升高,發揮癌基因作用。本文將綜述miR-93在腫瘤發生發展中的作用機制以及臨床應用方面的研究進展。
1 miR-93參與調控腫瘤細胞增殖和凋亡
miR-93通過調節特定靶基因調控腫瘤細胞增殖、分化和凋亡,廣泛參與腫瘤發生、發展等多種生物學過程。miR-93在胃癌組織中的表達量顯著升高,發揮促進增殖和抑制凋亡的作用。Guan等[1]使用熒光素酶報告基因和蛋白免疫印跡分析驗證了miR-93在胃癌中表達上調,發現miR-93通過靶向TIMP2促進胃癌的增殖和轉移并誘導胃癌細胞上皮-間質轉化(Epithelial-Mesenchymal Transition,EMT)。miR-106b-93-25簇在50%以上胃癌中表達增高,其中miR-93和miR-106b與轉錄因子E2F1存在反饋調節。高表達的miR-106b-93-25簇通過抑制靶基因周期素依賴性蛋白激酶抑制因子1A(Cyclin-Dependent Kinase Inhibitor 1A,CDKN1A/p21)和BCL2樣蛋白11(BCL2-like 11,BCL2L11/BIM),阻斷轉化生長因子(Transforming Growth Factor,TGF)信號通路,最終促進胃癌的發生。反之,降低miR-106b-93-25簇的表達,則可以抑制胃癌細胞的增殖和細胞貼壁能力[2]。PI3K/AKT信號傳導途徑的改變在調控細胞增殖、凋亡以及遷移等過程中發揮重要作用[3]。研究發現miR-93過表達與PI3K/AKT信號通路激活相關。PTEN、CDKN1A是miR-93的靶基因。Yuan等[4]發現miR-93高表達與腫瘤大小、TNM分期及淋巴結轉移相關,體外功能學實驗表明高表達miR-93可通過靶向調控p21、PTEN表達顯著促進胃癌細胞增殖、侵襲及遷移能力。Katsuya等[5]通過PCR檢測,證實了晚期肝細胞癌(Hepatocellular Carcinoma,HCC)患者中miR-93表達水平升高與預后不良有顯著相關性。通過生物信息學分析揭示了miR-93通過靶向抑制PTEN和CDKN1A表達,進而激活c-Met/PI3K/AKT信號通路刺激細胞增殖、遷移和侵襲、抑制細胞凋亡。此外,在肺癌細胞中,Li[6]等發現抑癌基因LKB1也是miR-93的靶基因。進一步研究發現miR-93通過靶向抑制LKB1、PTEN、CDKN1A表達進而激活PI3K/AKT信號通路促進腫瘤細胞增殖、轉移和侵襲。Li等[7]發現在乳腺癌中miR-106b和miR-93通過PTEN/PI3K/AKT信號通路的調控促進體內細胞的遷移和增殖。在神經膠質瘤中,miR-93通過靶向結合PTEN、PHLPP2和FOXO3的3′-UTR從而抑制其表達,進而激活PI3K/AKT信號通路,最終增強細胞克隆增殖以及遷移等能力[8-9]。高遷移率蛋白A2(High Mobility Group A2,HMGA2)是一類DNA非組蛋白,在細胞的增殖、分化、凋亡中扮演重要角色,研究發現HMGA2在多種腫瘤中表達異常,發揮癌基因作用。miR-93在胰腺癌中通過靶向調節致癌基因HMGA2發揮抑癌作用。研究發現RUNX1通過直接與miR-93啟動子中的DNA結合位點相互作用而對miR-93進行負調控,最終導致miR-93在胰腺癌組織中表達下調,miR-93過表達或敲除HMGA2均可降低胰腺癌的侵襲性[10]。在腎細胞癌中,miR-93通過靶向抑制RUNX3的表達,進而激活依賴Smad的TGF信號通路,最終抑制細胞凋亡,促進細胞增殖、入侵和遷移[11]。Yeung等[12]通過比較人T細胞白血病病毒1(Human T-Lymphotropic Virus 1,HTLV-1)轉化的T細胞和外周血單核細胞的miRNA表達譜,發現miR-93表達上調。功能實驗揭示miR-93通過抑制靶基因腫瘤蛋白53誘導的核蛋白1(Tumor Protein p53 Inducible Nuclear Protein 1,TP53INP1),而最終抑制細胞的凋亡。Singh等[13]通過用17-雌二醇處理的大鼠乳腺組織和人乳腺癌細胞系中發現miR-93表達升高,核因子E2相關因子2(Nuclear Factor Erythroid 2-Related Factor 2,NRF2)表達降低,而維生素C可以逆轉17-雌二醇對miR-93的誘導作用,以及miR-93對NRF2的抑制作用。
此外,研究發現miR-93是抑癌基因失活的重要機制。定位于3p21的抑癌基因融合肉瘤蛋白(Fused in Sarcoma,FUS1)在肺癌中表達降低。研究發現FUS1的低表達受miR-93的調控,同時在非小細胞肺癌組織標本中,miR-93的表達與FUS1的表達呈負相關[14]。肝細胞癌中miR-93通過直接抑制靶基因PTEN和CDKN1A表達,激活c-Met/PI3K/AKT通路,發揮促進增殖和抑制凋亡作用。鼻咽癌中,miR-93可以直接抑制靶基因TGF-R2的表達,進而激活依賴Smad的TGF信號通路和PI3K/AKT信號通路,最終促進鼻咽癌細胞增殖、浸潤和轉移等惡性表型。DAB2是近年來鑒定的腫瘤抑制基因,在多種腫瘤中表達下調。Du等[15]發現在肺癌中,DAB2的低表達與患者的不良預后相關,而細胞中過表達DAB2可以有效抑制肺癌細胞增殖。研究發現miR-93通過直接結合DAB2 mRNA的3′-UTR進而抑制DAB2的表達,是DAB2失活的重要機制。
綜上所述,miR-93在大多數腫瘤中表達升高并通過調節CDKN1A、BIM、LKB1、TGFBR2、ITGB8、TP53INP1、TGF-R2和DAB2等靶基因的表達發揮促增殖和抗凋亡的功能。高表達miR-93可以抑制結腸癌干細胞的增殖和克隆形成能力[16],發揮類似抑癌基因的功能,因此揭示miR-93在不同腫瘤背景中的不同作用機制將是未來研究的重點。
2 miR-93促進腫瘤細胞轉移
miR-93除了可增加腫瘤細胞的生存能力外,也發揮促進腫瘤轉移和血管生成的作用。高表達miR-93的腦膠質瘤細胞(U87細胞系)與內皮細胞共培養,可以促進內皮細胞的遷徙、生長、轉移和血管形成。研究發現,miR-93促進腫瘤生長和刺激血管形成的作用與其抑制integrin-8的表達有關[17]。Fabbri等[18]報道,miR-93通過抑制靶基因IL-8和VEGF的表達,進而調節參與神經膠質瘤的血管生成細胞因子、趨化因子和生長因子的分泌。
miR-93在乳腺癌細胞系中高表達,其通過抑制靶基因巨大腫瘤抑制基因同源物2(The Large Tumor Suppressor,Homology 2,LATS2),發揮促進血管的生成和腫瘤細胞肺轉移的作用[19]。在肺癌細胞系H1299中,過表達miR-93可以抑制靶基因F-box和WD重復結構域蛋白11(F-Box and WD Repeat Domain Containing 11,FBXW11)的表達,進而上調Snail家族鋅指蛋白1(Snail Family Zinc Finger 1,SZF1),最終誘導上皮-間質轉化的發生,并促進肺癌細胞的遷移和血管生成[20]。TGF在腫瘤發生發展過程中具有促進和抑制兩方面的功能,而轉移調節因子SIX同源異型盒1(SIX homeobox 1,SIX1)基因在TGF功能決定中起到分子開關的作用。研究發現SIX1通過增加miR-106b-93-25簇的表達,可誘導上皮-間質轉化和腫瘤發生。而miR-106b-93-25簇不僅可以通過調控靶基因p21和Bim,降低TGF介導的生長抑制作用,而且還可通過調節靶基因SMAD家族成員7(SMAD Family Member 7,Smad7),增加TGF受體的表達量,最終激活TGF通路。雖然截至目前,我們對miR-93促進腫瘤轉移的分子機制有了一定的認識,但考慮到不同腫瘤間組織和細胞類型具有較大的差異,因此闡釋miR-93在腫瘤轉移中的作用機制仍是未來研究的重點。此外,由于miR-93的促增殖和促轉移作用,以miR-93為靶點的抗腫瘤治療研究也將是未來研究的趨勢。
3 miR-93在腫瘤臨床治療中的應用
miR-93在彌漫大B細胞淋巴瘤、食管癌、喉鱗癌、宮頸癌和腎細胞癌等多種腫瘤中表達升高[21-24]。Pineau等[25]發現肝臟經肝硬化發展為肝癌的過程中,miR-93表達逐漸升高。在宮頸癌中,miR-93的表達與宮頸癌淋巴結轉移和腫瘤浸潤程度顯著相關[26]。在胃癌組織中,miR-93的高表達與臨床分期、浸潤程度和淋巴結轉移相關,同時高表達miR-93的患者,其術后總生存期和無疾病生存期較低表達者短[27-28]。同時,研究發現miR-93也是非小細胞肺癌早期診斷的生物標志物[29]。然而,與大多數腫瘤中的miR-93表達不同,其在結腸癌中低表達,并且其低表達與腫瘤分期、淋巴結轉移、遠處轉移和不良預后相關。多因素分析進一步顯示,結腸癌中miR-93的低表達是臨床分期、陽性淋巴結轉移和遠處轉移的獨立預測因子[30]。Xu等[12]通過研究發現,肝癌組織中miR-93呈高表達,在對其表達進行抑制后,HepG2細胞的增殖能力明顯下降,而且克隆增殖以及遷移等能力也受到較大影響,從而判斷抑制miR-93的藥物可用于肝癌治療。miR-93的表達水平可作為預測經化療后的食管癌3年生存率的有效生物標志物[9]。
此外,研究發現根據血漿中miR-93、miR-409-3p和miR-7的表達水平,可區分正常人與結直腸癌患者;根據血漿中包括miR-93在內的6個miRNAs的表達情況,可以區分急性髓樣白血病患者與正常人,提示其有可能成為結直腸癌和急性髓樣白血病的診斷標志物[31-33]。同時研究發現在卵巢癌患者血清中miR-93的表達顯著升高,而miR-93在高表達CA125的患者血清中的表達水平要顯著低于CA125低表達的患者[34]。Espinosa-Parrilla等[35]研究發現miR-106b-93-25簇的兩個SNP與賁門胃癌的發病相關。綜上所述,miR-93無論在預后判斷還是早期診斷方面都有較大的應用前景,但尚缺乏大樣本和多中心的系統研究。
4 miR-93與腫瘤耐藥性的關系
大量研究發現在腫瘤藥物耐受的細胞中,miR-93表達升高,而體外過表達miR-93也可誘導腫瘤細胞產生耐藥性;同時抗腫瘤藥物可以降低腫瘤細胞中miR-93的表達量,進而抑制細胞的增殖或誘導其凋亡,這些均表明miR-93在腫瘤產生耐藥性的過程中發揮重要作用。
表沒食子兒茶素(Epigallocatechin,EGC)和表沒食子兒茶素-3-沒食子酸酯(Epigallocatechin Gallate,EGCG)是兩種具有抗腫瘤活性的化合物,體外研究發現兩種化合物均可以下調miR-93的表達并誘導神經母細胞瘤細胞系SH-SY5Y和SK-N-DZ發生凋亡。而過表達miR-93則會降低兩種化合物的抗腫瘤活性[36]。抗腫瘤活性化合物4-羥苯基維甲酰胺(4-Hydroxy(Phenyl)Retinamide,4-HPR)和EGCG聯合使用,可以降低神經母細胞瘤細胞系SK-N-BE2和IMR-32中miR-93的表達量,過表達miR-93則增加腫瘤細胞的耐藥性[37]。在順鉑耐藥的卵巢癌細胞中,miR-93高表達,miR-93通過直接調節靶基因同源性磷酸酶張力蛋白(Phosphatase and Tensin Homolog,PTEN),進而調節蛋白激酶B(Protein Kinase B,PKB)/AKT信號通路來調節耐藥性的產生[38]。此外,順鉑通過下調miR-93來降低CDKN2A的表達進一步有效抑制肺腺癌細胞的增殖[39]。Katsuya等[5]通過抑制miR-93的表達,可以顯著改善肝癌細胞對5-Fu、CDDP、索拉非尼和Tivantinib的藥物敏感性。Zhou等[40]發現用5-Fu和奧沙利鉑處理結腸癌細胞系HCT-8和HCT-116后,miR-93的表達下降。Jing等[41]發現,在膀胱癌中降低miR-93表達能增強膀胱癌化療的敏感性,其作用機制可能是抑制miR-93的生物學作用上調抗腫瘤基因LASS2表達,進而增強化療敏感性,推測miR-93可以作為治療膀胱癌的新的治療靶點。替莫唑胺(Temozolomide,TMZ)是一種常用的治療膠質瘤的化療藥物。Chen等[42]研究發現下調miR-93的表達能增強U87細胞對TMZ的化學敏感性。但是潛在的分子機制尚未明確,推測miR-93可能直接作用于靶基因P21從而介導膠質瘤細胞對TMZ的化學耐藥作用。如上所述,miR-93與抗腫瘤藥物的耐藥性產生密切相關。
5 小結與展望
綜上所述,我們已經認識到miR-93在多數腫瘤中表達升高,并通過調節靶基因參與腫瘤的增殖、轉移、凋亡、預后及耐藥性等諸多生物學過程(圖1),但是miR-93參與腫瘤發生發展各階段的分子機制尚未完全揭示,尤其針對miR-93的抗腫瘤治療研究尚處于初級階段,因此未來仍需要更加深入的研究以致力于揭示其分子機制和推動其臨床應用。
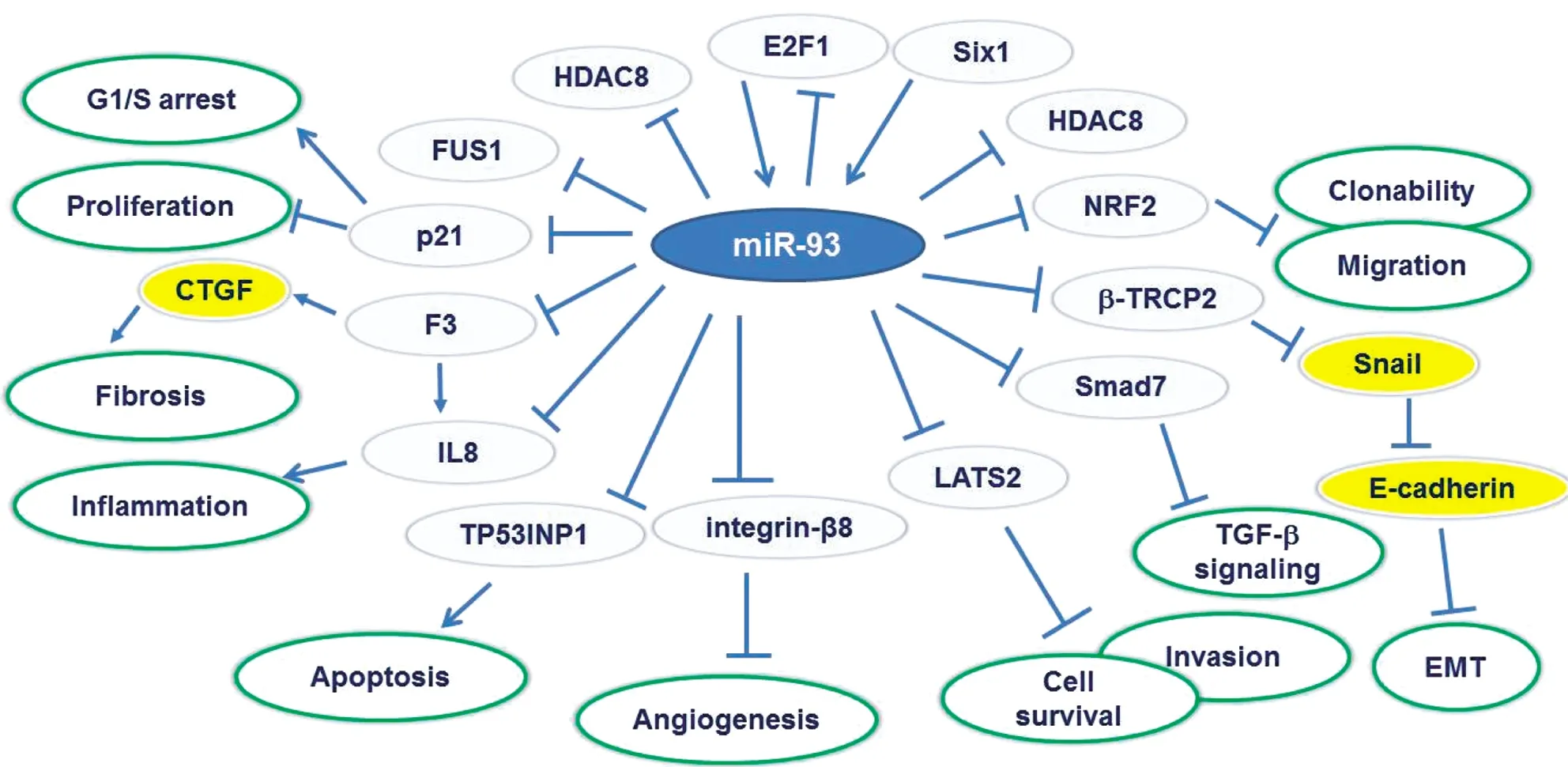
圖1 miR-93參與調控腫瘤發生發展的信號通路

