中國和東盟國家常用傳統藥物治療糖尿病及其并發癥藥理作用的研究進展
李意春,郝二偉, 2#,劉婧曦,杜正彩, 2,白 鋼,張鐵軍4,Wattanathorn Jintanaporn5,Sirisa-ard Panee 6,Tang Pei-ling, 7,侯小濤, 2*,鄧家剛, 2*,劉昌孝4*
中國和東盟國家常用傳統藥物治療糖尿病及其并發癥藥理作用的研究進展
李意春1,郝二偉1, 2#,劉婧曦1,杜正彩1, 2,白 鋼2,3,張鐵軍2, 4,Wattanathorn Jintanaporn2, 5,Sirisa-ard Panee2, 6,Tang Pei-ling1, 7,侯小濤1, 2*,鄧家剛1, 2*,劉昌孝2, 4*
1. 廣西中醫藥大學藥學院 廣西中藥藥效研究重點實驗室,廣西中醫藥科學實驗中心,廣西 南寧 530000 2. 廣西中醫藥大學 中國-東盟傳統醫學研究國際合作聯合實驗室,廣西 南寧 530200 3. 南開大學 藥物化學生物學國家重點實驗室,天津 300000 4. 天津藥物研究院,天津 300462 5. 孔敬大學 人類高性能與健康促進研究所,泰國 孔敬 40002 6. 泰國清邁大學藥學院 生藥學和制藥技術系,泰國 清邁 50200 7. 馬來西亞拉曼大學學院應用科學學院 生物科學系,馬來西亞 吉隆坡 53300
糖尿病是一種由于體內胰島素絕對或相對分泌不足而引起的以糖代謝紊亂為主的全身性疾病,嚴重威脅人類的身心健康,而中國和東盟地區更是糖尿病高發地區,患病人數居全球第1位。通過查閱《中國-東盟傳統藥物志》,中國和東盟國家用于治療糖尿病、消渴癥的傳統藥物有81種,其中在中國和東盟國家中應用較為廣泛且研究較為深入的有25種。利用中國知網、維普、Pubmed等數據庫系統地查閱和整理國內外關于25種傳統藥物治療糖尿病及其并發癥的相關文獻,對25種藥物降血糖藥理作用及其作用機制進行綜述,傳統藥物改善糖尿病及其并發癥的作用機制主要是通過抑制炎癥及過氧化反應,調節糖脂,改善胰島素抵抗,提高胰島素敏感性,修復胰島細胞,促進胰島素分泌等途徑,可為開發安全、有效的降糖藥以及加強中國和東盟國家進一步的研究合作提供有益的參考。
中國-東盟;傳統藥物;糖尿病;并發癥;藥理作用;作用機制
糖尿病是繼惡性腫瘤、心腦血管疾病之后,嚴重威脅人類健康的第3大疾病。根據國際糖尿病聯盟統計,2019年全球20~79歲的成年人中有4.63億人患有糖尿病,預計到2030年,糖尿病患者會達到5.784億;到2045年,糖尿病患者會達到7.02億[1],其主要發病原因是人體完全不能分泌或不能分泌足夠的胰島素或無法有效使用胰島素,糖尿病分為1型糖尿病和2型糖尿病,1型糖尿病臨床多見于多飲、多尿、多食和消瘦;2型糖尿病多見于疲乏無力和肥胖。根據國際糖尿病聯盟(International Diabetes Federation,IDF)2019年糖尿病全球概況數據可知,中國-東盟國家地區糖尿病患病人數占全球第1位,見圖1。
東盟10國指文萊、柬埔寨、印度尼西亞、老撾、馬來西亞、緬甸、菲律賓、新加坡、泰國、越南。東盟國家地理位置極為重要,是“一帶一路”向南開放、開展區域合作的重要門戶。中國與東盟國家地域、自然環境相近,都有豐富的藥用生物資源,且具有醫藥文化的共通性,以及藥材資源和消費市場的互補性,在傳統醫藥領域具有極大的研發合作潛力。本文針對在中國及東盟國家高發的糖尿病及其并發癥,概述常用于防治該病的傳統藥物近10年的藥理作用及其機制,并對發揮藥效的物質基礎進行簡要分析,為更好地利用中國及東盟國家的藥用資源、進行深入的研究開發和交流合作提供依據和參考。

圖1 2019年全球IDF地區糖尿病患病人數
1 中國-東盟常用于治療糖尿病的傳統藥物
《中國-東盟傳統藥物志》記載了中國及東盟10國常用350種傳統藥物的分布、化學成分、藥理作用及各國應用情況[2],據統計各國用于治療糖尿病、消渴癥的傳統藥物有81種,來自43科,見表1;其中苦瓜、匙羹藤、黃連等被多個國家用于治療糖尿病且研究較為深入,被多次報道。但是有些藥物如越南巴豆、鐵刀木、印尼莪術、桂葉山牽牛等雖有記載被東盟各國作為民間藥用,但是在機制和藥理方面的研究記載較少,本文依據藥物在中國-東盟國家的應用和研究情況,篩選出25種應用廣泛且研究深入的傳統藥物,分別是長春花、蓮、余甘子、番茄、梔子、積雪草、穿心蓮、麥冬、匙羹藤、辣木、地黃、黃連、桑、葛、苦瓜、紅瓜、菊花、東革阿里、木蝴蝶、腎茶、車前、金櫻子、蒲桃、波葉青牛膽、甜玉米。
2 治療糖尿病及其并發癥的藥效物質
25種傳統藥物的降血糖活性成分多種多樣,主要有黃酮類、生物堿類、多糖類、萜類等化學成分,藥物的降血糖活性成分及其機制見表2。
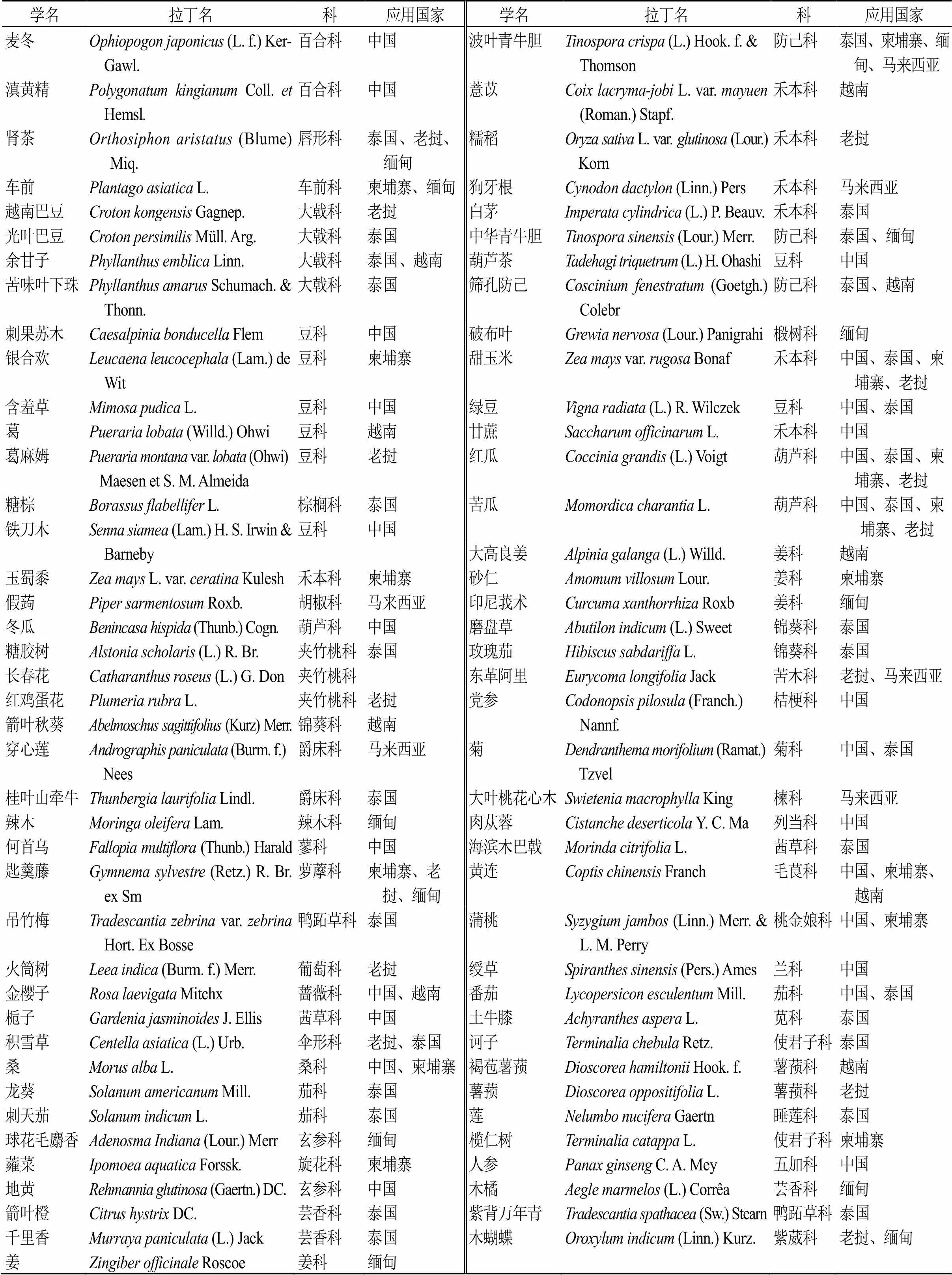
表1 中國-東盟國家可以治療糖尿病的傳統藥物
3 中國-東盟常用傳統藥物治療糖尿病的藥理作用及其機制
3.1 降糖作用
3.1.1 對α-葡萄糖苷酶的抑制作用 α-葡萄糖苷酶抑制劑通過抑制小腸黏膜刷狀緣的α-葡萄糖苷酶以延緩碳水化合物的吸收,降低餐后高血糖。劉率男等[3]研究發現α-葡萄糖苷酶抑制劑桑枝總生物堿能夠抑制蔗糖酶和麥芽糖酶的活性,是一個選擇性的雙糖酶抑制劑;長期給予桑枝總生物堿可以有效控制高糖飼養結合鏈脲佐菌素(streptozotocin,STZ)小鼠及糖尿病前期肥胖性胰島素抵抗C57小鼠血糖波動,改善糖脂代謝紊亂狀態。蒲桃枝葉醋酸乙酯及正丁醇部位分離出的2′,4′-二羥基-6′-甲氧基-3′-甲基查耳酮、槲皮苷能夠抑制α-葡萄糖苷酶活性[4]。葛根的活性成分daidzein、genistein、calycosin能夠抑制α-葡萄糖苷酶活性,此外三萜類成分lupeol和lupenone能夠抑制蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)活性,是有效的PTP1B抑制劑[5]。梔子活性成分梔子黃能夠抑制豬胰腸來源的α-葡萄糖苷酶、大米來源α-葡萄糖苷酶和酵母來源α-葡萄糖苷酶活性,具有一定降血糖活性[6]。腎茶50%醇提取物能夠顯著降低糖尿病大鼠的血糖水平,對α-葡萄糖苷酶具有抑制作用[7]。
3.1.2 提高耐糖能力,增加肝糖原含量,抑制糖原的分解 葡萄糖利用障礙和糖異生增加也是導致高血糖的因素之一。早期發現并給予干預糖耐量減退,可減少糖尿病的發生。葛根總黃酮能抑制四氧嘧啶誘導糖尿病小鼠餐后血糖升高,增強糖尿病小鼠葡萄糖的負荷糖耐量,通過抑制小腸中α-葡萄糖苷酶的活性,降低葡萄糖的吸收,進而降低糖尿病小鼠血糖含量[8]。麥冬提取物對實驗性2型糖尿病大鼠具有一定的保護作用,能夠顯著降低2型糖尿病大鼠的血糖,提高大鼠對外源胰島素的敏感性及肝糖原、骨骼肌糖原含量;降低腎指數、尿蛋白排泄率及胰腺的組織病理損傷[9]。玉米須多糖可降低四氧嘧啶制備糖尿病小鼠的空腹血糖,提高肝糖原含量,同時還能減輕造模藥物及高血糖引起的肝損害[10]。9-Hydroxycanthin-6-one是東革阿里的降血糖活性成分,通過抑制Wnt信號通路抑制糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)介導的磷酸化以及抑制胞質中的β-連環蛋白降解等作用發揮降血糖功能[11]。
3.1.3 促進周圍組織對糖的利用 桑葉總黃酮能夠降低高脂飼養結合STZ誘導糖尿病大鼠的血糖水平,其機制是通過增加糖尿病大鼠骨骼肌中己糖激酶活性,抑制GSK-3β蛋白的表達,從而促進肌糖原的合成貯存,減少血液中游離的葡萄糖,發揮降血糖作用[12]。地黃活性成分梓醇能夠降低STZ誘導糖尿病大鼠血糖,其降糖機制主要是通過增加糖尿病大鼠腎上腺分泌β-內啡肽來增加葡萄糖利用率[13]。辣木甲醇提取物通過刺激胰島素釋放,促進葡萄糖攝取和糖原合成顯著改善四氧嘧啶大鼠的糖耐量,使血清胰島素水平升高,提高糖原合成酶活性和糖原含量[14]。脫氧穿心蓮內酯通過調節PI3K/Akt信號通路,促進GLUT4轉位至質膜,從而提高大鼠L6骨骼肌細胞對葡萄糖的攝取,有效降低了STZ誘導的糖尿病大鼠的餐后血糖水平,并抑制了db/db小鼠的空腹血糖、血清胰島素、三酰甘油和低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)水平的上升[15]。
3.2 降低氧化應激
糖尿病的發病機制與氧化應激有著密切的聯系[16],氧化應激可通過激活細胞內信號通路損害胰島β細胞引起胰島細胞功能紊亂,這些信號通路與胰島素信號通路相互影響,導致胰島素抵抗[17],降低過高的氧化應激能夠改善糖尿病癥狀。葛根異黃酮能夠抑制STZ誘導糖尿病小鼠肝臟中丙二醛、蛋白羰基化水平的增加,增強超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)活性,增強糖尿病小鼠的抗氧化能力,改善糖尿病小鼠糖脂代謝,對糖尿病小鼠具有一定保護作用[18]。番茄紅素通過激活高脂高糖及STZ誘導糖尿病小鼠體內PI3K/Akt及其下游信號通路降低糖尿病小鼠胰腺中丙二醛水平,增加SOD、CAT、谷胱甘肽酶活力,從而抑制自由基的產生并加快其清除速率,提高抗氧化酶的活性從而實現降血糖的作用[19]。麥冬多糖能顯著降低STZ誘導的糖尿病大鼠血清、肝、腎組織中丙二醛水平,提高谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)和SOD活性,具有強大的抗氧化活性;同時,麥冬多糖還能降低糖尿病大鼠生長轉化因子-β1(transforminggrowth factor-β1,TGF-β1)和結締組織生長因子(connective tissue growth factor,CTGF)mRNA的表達,從而保護肝臟和腎臟免受糖尿病的損害[20]。黃連素通過轉錄因子NF-E2相關因子2(NF-E2-related factor 2,Nrf2)介導實現糖尿病大鼠抗氧化能力,降低糖尿病大鼠的肝質量指數和丙二醛水平,升高SOD活性,上調肝臟中Nrf2、SOD、CAT、GSH-Px、血紅素氧合酶1(heme oxygenase 1,HO-1)mRNA及蛋白表達水平,對肝臟具有一定保護作用[21]。杭白菊總黃酮能夠降低糖尿病小鼠丙二醛水平,同時提高CAT、GSH-Px和SOD的活性,其作用機制可能與抗氧化能力有關[22]。

表2 25種傳統藥物的降血糖活性成分及其機制
3.3 改善胰島素抵抗,增加胰島素敏感性
3.3.1 增加胰島素受體數目及與胰島素的結合力 苦瓜總皂苷通過下調細胞因子信號抑制物3(suppressors of cytokine signaling 3,SOCS-3)和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)的mRNA和蛋白表達量來增強胰島素信號轉導通路的作用,改善高脂高糖結合STZ誘導的2型糖尿病大鼠的胰島素抵抗[23]。梔子苷通過增強胰島素受體表達,下調核因子-κB(nuclear factor kappa B,NF-κB)表達,改善HepG2細胞胰島素抵抗[24]。積雪草醇提物可有效改善ZDF大鼠體質量、空腹血糖、空腹血清胰島素及胰島素抵抗指數水平,其機制是上調肝臟中胰島素受體2(insulin receptor substrate-2,IRS-2)基因轉錄,增加下游3-磷酸肌醇依賴性蛋白激酶1基因轉錄,上調葡萄糖轉運蛋白2(glucose transporter 2,GLUT2)表達,有效改善胰島素抵抗[25]。
3.3.2 增加胰島素受體及底物的磷酸化 葛根含藥血清通過上調瘦素受體和IRS-2蛋白表達,調節以磷酸化PI3K/PDK為中心節點的的胰島素信號通路;上調IR-HepG2細胞GLUT1和GLUT2表達量及增加GLUT1轉位到肝細胞膜上,減輕葡萄糖轉運障礙;通過PKB/Akt及其下游通路增加肝細胞內糖原合成,增強HepG2細胞胰島素敏感性,改善糖代謝[26]。苦瓜總皂苷通過上調蛋白激酶B(protein kinase B,PKB)和腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)的mRNA以及蛋白表達量,改善高脂高糖結合STZ注射誘導的2型糖尿病大鼠的胰島素抵抗[27]。地黃的生物活性成分梓醇通過減輕脂肪組織炎癥和抑制JNK和NF-κB途徑來改善高脂飲食誘導的小鼠胰島素抵抗[28]。木蝴蝶中的木蝴蝶苷A可以通過提高過氧化物酶體增殖體激活受體γ(peroxisome proliferator activated receptor γ,PPARγ)下游蛋白胰島素受體底物-1的磷酸化水平和GLUT2的表達量來增加葡萄糖吸收、增加胰島素的敏感性[29]。
3.3.3 增加GLUT4的含量 余甘子提取物可提高高脂飲食誘導糖尿病大鼠骨骼肌GLUT4 mRNA表達,增加GLUT4生物合成,提高PKB表達,促進原存在于細胞內被隔離的GLUT4蛋白易位到細胞表面,加速葡萄糖跨膜轉運及外周組織對葡萄糖的利用,從而改善糖尿病大鼠胰島素抵抗[30]。苦瓜總皂苷能夠有效降低高脂高糖飲食結合STZ誘導的2型糖尿病大鼠的血糖和血清胰島素水平,其降血糖機制是促進肝糖原合成、抑制肝糖原分解以及通過外周組織GLUT4表達增強進而增加胰島素敏感性[31]。匙羹藤總皂苷能夠調節2型糖尿病小鼠糖脂代謝水平,改善胰島素抵抗,其作用機制是通過激活PPARγ增加其下游CAP轉錄水平,激活Cb1-CAP信號通路,增加GLUT4 mRNA表達,從提高葡萄糖轉運作用,改善胰島素抵抗[32]。
3.4 抑制炎癥反應
炎癥反應已成為胰島素抵抗、胰島β細胞功能減退、代謝綜合征和心血管并發癥的“共同土壤”[33],炎癥因子通過血液和(或)旁分泌的作用影響胰島素的敏感性和胰島β細胞功能,因此抑制炎癥因子能夠起到改善胰島素抵抗、保護胰島β細胞和降低血糖的作用[34-37]。余甘子提取物通過升高GLUT-2和PPARγ mRNA的表達和過氧化物酶體增殖物反應元件報告基因的活性,降低NF-κB報告基因的活性,從而抑制脂多糖誘導的人肝LO2細胞的炎癥反應發揮降血糖作用[38]。黃連素通過IKK/NF-κB信號通路,抑制NF-κB核轉位,降低高脂飼料喂養聯合小劑量STZ誘導的妊娠期糖尿病大鼠肝臟組織中的炎癥反應,從而改善胰島素抵抗,降低血糖水平[39]。蓮子芽通過調節促炎/抗炎細胞因子基因的表達,降低非肥胖糖尿病小鼠脾臟的絕對質量,抑制脾細胞產生促炎因子腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)和白細胞介素-6(interleukin-6,IL-6),降低IL-6/IL-10的分泌比值,保護非肥胖糖尿病小鼠的脾臟和肝臟免受自發性炎癥的影響[40]。
3.5 調脂作用
糖尿病患者往往伴隨高胰島素血癥及脂代謝異常,改善脂代謝紊亂帶來的糖、脂毒性和胰島素抵抗是治療糖尿病的關鍵。匙羹藤通過改善脂肪細胞因子TNF-α和脂聯素的表達,降低自發性2型糖尿db/db小鼠空腹血糖、血清胰島素、總膽固醇、LDL-C水平,提高胰島素敏感指數,改善糖尿病糖脂代謝紊亂,增加胰島素的敏感性[41]。蓮葉的生物堿成分nuciferine通過激活PPARα/PGC1α通路,改善高脂/STZ誘導的糖尿病小鼠的血脂狀況,減輕肝臟脂肪變性[42]。桑酮堿能夠顯著降低高脂飼料聯合STZ建立的2型糖尿病大鼠的空腹血糖、糖化血清蛋白、糖化血紅蛋白、總膽固醇、三酰甘油、LDL-C、瘦素水平和胰島素抵抗指數,升高高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL-C)、脂聯素水平和胰島素敏感指數,通過改善2型糖尿病大鼠的胰島素抵抗和調節脂肪細胞因子水平,改善2型糖尿病大鼠糖脂代謝[43]。紅瓜甲醇提取物能夠恢復糖尿病大鼠的堿性磷酸酶、天冬氨酸氨基轉移酶、丙胺酸轉氨酶和乳酸脫氫酶(lactate dehydrogenase,LDH)水平,改善糖尿病大鼠的糖脂代謝[44]。
3.6 胰島素樣作用或修復胰島使其正常分泌
3.6.1 直接胰島素樣作用或直接促進胰島素分泌 胰島素分泌不足是導致糖尿病病發的重要因素,傳統藥物通過直接胰島素樣作用,或直接促進胰島素分泌降低血糖。苦瓜多肽-P被稱為“植物胰島素”,通過直接胰島素樣作用,降低糖尿病大鼠血糖值[45]。長春花中含有沒食子酸和綠原酸的酚類部位對正常和糖尿病小鼠有降血糖作用,其作用機制是刺激胰島素分泌[46]。蓮子芽多糖通過升高糖尿病小鼠血清HDL-C,降低LDL-C和總膽固醇水平,改善糖尿病小鼠的血脂;并且增加胰島細胞數量,增強胰島素分泌,保護胰島細胞[47]。苦瓜多糖IIa能明顯降低STZ糖尿病小鼠的血糖,升高血清胰島素濃度;且通過透射電鏡顯示,苦瓜多糖IIa能夠減STZ對小鼠胰腺組織損傷[48]。波葉青牛膽活性成分borapetol B能夠增加糖尿病大鼠的胰島素分泌。離體胰島灌流結果表明,borapetol B不會通過破壞胰島β細胞而導致胰島素泄漏,其通過刺激胰島素分泌,達到抗糖尿病作用[49]。
3.6.2 通過刺激胰島β細胞分泌胰島素 胰島β細胞分泌胰島素不足是引起機體高血糖的原因之一,通過刺激胰島β細胞增加胰島素分泌可有效降低血糖值。桑葉多糖通過促進凋亡抑制基因B細胞淋巴瘤/白血病-2基因的表達,同時抑制B細胞白血病-淋巴瘤-2相關X蛋白和半胱氨酸蛋白酶-3的表達,以降低高糖誘導的大鼠胰島素瘤INS-1細胞凋亡,促進INS-1細胞胰島素分泌[50]。匙羹藤葉提取物通過刺激胰島β細胞分泌胰島素,有效降低2型糖尿病患者的血糖,提高血漿胰島素和C肽水平[51]。梔子苷能夠降低高脂高糖飲食加腹腔注射STZ大鼠的空腹血糖,升高血清胰島素水平,具有降低血糖、促進胰島細胞分泌胰島素的作用[52]。余甘子提取物能夠降低糖尿病大鼠的空腹血糖,提高糖尿病大鼠血清胰島素水平,增加胰島素與葡萄糖的比率;胰腺免疫染色顯示,余甘子提取物使糖尿病大鼠的β細胞增大,而使β細胞數目增加;顯著升高血漿總抗氧化劑和肝臟GSH水平,降低肝臟硫代巴比妥酸反應物;其活性成分鞣花酸刺激了糖尿病大鼠離體胰島葡萄糖刺激的胰島素分泌,并降低糖尿病大鼠的糖耐量,表明余甘子提取物中的鞣花酸通過作用于胰腺β細胞發揮抗糖尿病作用[53]。
3.6.3 通過修復胰島β細胞維持胰島功能 胰島β細胞功能受損、胰島素分泌絕對或相對不足(胰島素抵抗),會使血糖升高,引發糖尿病[54],因此保護、修復受損胰島β細胞是降低血糖的機制之一。余甘子降血糖活性成分沒食子酸通過下調炎癥相關因子NOD樣受體熱蛋白結構域相關蛋白3(NOD-like receptor pyrin domain containing 3,NLRP3)和內質網應激因子硫氧還蛋白相互作用蛋白的表達,抑制高糖狀態下INS-1細胞凋亡,保護胰島細胞[55]。研究表明,桑葉可通過抑制2型糖尿病小鼠模型的內質網應激來維持胰島素水平和胰腺β細胞質量,飲食桑葉能夠減少2型糖尿病db/db小鼠胰腺內質網應激而減少細胞死亡以及促進胰腺β細胞增殖和胰腺十二指腸同源框-1 mRNA的表達[56]。黃連通過減少TNF-α、C-反應蛋白等炎癥因子表達,下調內質網PERK/ATF4/CHOP信號通道相關CCAAT/增強子結合蛋白同源蛋白(CCAAT/enhace-binding protein homologous protein,CHOP)、活化轉錄因子4(activating transcription factor 4,ATF4)、胰腺組織葡萄糖調節蛋白78和磷酸化蛋白激酶R樣內質網激酶(phosphorylated PKR like endoplasmic reticulum regulating kinase,p-PERK)因子表達,進而抑制炎癥反應及內質網應激,保護胰島β細胞,降低糖尿病大鼠的血糖值[57]。
4 治療糖尿病并發癥的藥理作用及其機制
長期處于高血糖水平會導致心血管、眼、腎、神經等微血管和大血管并發癥的出現。糖尿病并發癥是世界各地糖尿病患者死亡的主要原因,給國家醫療、生產力、經濟增長、弱勢家庭帶來巨大的負擔。
4.1 糖尿病腎病
糖尿病腎病是糖尿病最主要的微血管病變之一,1/3的1型糖尿病或2型糖尿病患者會發展為糖尿病腎病,是終末期腎疾病的主要原因。糖尿病腎病病理特征是腎小球和腎小管肥大,基底膜增厚,細胞外基質大量堆積和腎小球硬化等。積雪草含藥血清通過阻斷TGF-β1-CTGF-FN通路,降低高糖環境下體外培養大鼠近端腎小管上皮NRK52E細胞的結締組織生長因子(connective tissue growth factor)、纖維連接蛋白(fibronectin,FN)蛋白和mRNA表達水平,抑制腎間質纖維化,進而防治糖尿病腎病[58]。黃連素明顯抑制糖尿病小鼠血糖,腎質量/體質量比、血尿素氮、血肌酐和24 h尿蛋白異常增高;抑制腎臟肥大、FN和Ⅳ型膠原積聚,其作用機制是通過抑制腎臟鞘氨醇激酶-1-磷酸鞘氨醇(sphingosine kinase sphingosine 1-phosphate,SphK-S1P)信號通路激活,減少腎臟鞘氨醇激酶1型(sphingosine kinase 1,SphK1)活性、mRNA和蛋白表達,降低S1P的生成[59]。地黃的活性成分梓醇能夠下調STZ構建的糖尿病小鼠腎臟生長因子受體結合蛋白10的過表達,上調IGF-1/IGF-1R磷酸化表達,對糖尿病腎病具有保護作用[60]。車前草水提物能夠修復血糖代謝異常造成的腎組織損傷,隨給藥濃度增加,其抑制血清中與腎纖維化密切相關胱蛋白酶抑制劑C、基質金屬蛋白酶抑制劑1、TGF-β1、Ⅳ型膠原異常表達作用增強,其機制可能與p38 MAPK通路受到抑制及PPAR γ通路受到激活有關[61]。
4.2 糖尿病心肌病
鋅/番茄紅素能夠降低糖尿病大鼠的血糖,當機體處于氧化應激狀態時,番茄紅素與鋅結合,番茄紅素可能可以代替金屬硫蛋白清除自由基的作用,起到改善心肌能量代謝異常、氧化應激異常,對實驗性糖尿病小鼠心肌達到保護作用[62]。苦瓜總皂苷通過調控高脂高糖飲食聯合STZ誘導的2型糖尿病大鼠心肌組織中基質金屬蛋白酶-9和HO-1,顯著降低2型糖尿病大鼠血糖,心功能CK、肌酸激酶同工酶、LDH和羥丁酸脫氫酶,對糖尿病大鼠心肌具有一定保護作用[63]。積雪草酸調節糖尿病大鼠心臟氧化還原平衡,恢復糖尿病大鼠心臟SOD、CAT等抗氧化酶活性,降低丙二醛含量,此外還能抑制Fe2+和Vit C誘導的線粒體損傷腫脹和膜電位下降,減輕線粒體損傷程度,抑制線粒體脂質過氧化,改善糖尿病大鼠心臟損傷[64]。梔子苷通過沉默信息調節因子1(silent information regulator,SIRT 1)介導的TGF-β/ac-Smad3信號通路及氧化應激,抑制高糖誘導大鼠心臟成纖維CF細胞表型轉化及膠原合成,改善糖尿病心肌損傷[65]。
4.3 糖尿病腦病
糖尿病腦病又稱糖尿病認知障礙,指的是糖尿病引起的認知障礙和大腦的神經生理及結構的改變,臨床表現為記憶力減退,語言表達、理解能力下降,反應遲鈍,注意力下降等特征[66]。小檗堿可提高db/db小鼠的學習記憶能力,緩解了db/db小鼠海馬的神經退行性變和神經炎癥水平,其機制可能是通過調控SIRT1/ER stress通路實現[67]。荷花種胚生物堿成分neferine通過抑制氧化應激、神經炎癥反應和內質網應激,調節NLRP3炎癥體通路,改善糖尿病db/db小鼠的學習、記憶和認知功能障礙[68]。何首烏通過抑制1型糖尿病大鼠腦組織及血清肌球蛋白輕鏈激酶表達,減輕血腦屏障損傷,從而保護糖尿病大鼠認知功能[69]。穿心蓮內酯能夠減輕認知障礙、降低乙酰膽堿酯酶活性、氧化應激、改善糖尿病高血糖和胰島素缺乏,對糖尿病大鼠認知功能具有一定改善功能[70]。
4.4 糖尿病視網膜病變
糖尿病視網膜病變會使視網膜毛細血管損傷、毛細血管滲漏和毛細血管阻塞。它可能會導致視力下降,并最終導致失明。糖尿病視網膜病變是導致處于工作年齡(20~65歲)的成人視力下降的主要原因,約1/3的糖尿病患者具有一定程度的糖尿病視網膜病變,而1/10的患者將出現威脅視力的病情。番茄紅素通過降低血漿中內皮素水平、提高血漿中降鈣素基因相關蛋白水平和下調視網膜中血管內皮生長因子的表達,從而抑制視網膜增厚減輕STZ誘導大鼠的視網膜病變[71]。葛根素能夠降低STZ誘導的糖尿病大鼠的血糖水平,具有一定的降血糖作用;通過Nrf2/HO-1信號通路減輕氧化應激,阻止糖尿病大鼠白內障的發生發展。顯著降低糖尿病大鼠白內障發生率;降低氧化應激,恢復丙二醛和谷胱甘肽的水平,GSH-Px的活性。此外,降低視網膜血管內皮生長因子和白細胞介素-1 mRNA的表達水平,上調Nrf2 mRNA和HO-1 mRNA的表達水平,從而抑制氧化應激[72]。金櫻子提取物通過誘導HO-1的表達,抑制高糖條件下晶狀體上皮細胞活性氧的產生,增加線粒體膜電位的表達。其保護作用是通過PI3K/Akt和Nrf2/Are途徑介導的[73]。
傳統藥物治療糖尿病及糖尿病并發癥的機制見圖2。
5 結語與展望
《中國-東盟傳統藥物志》是我國第一部由中國專家聯合東盟7國專家在世界普遍高度關注傳統醫藥的時代背景下,歷經5年共同編撰的具有各國傳統藥物特色的學術專著,該書的出版問世,為中國和東盟各國開展傳統藥用植物資源和文獻研究提供了示范,對于增進我國與東盟國家在傳統藥物研究方面的合作與交流,提升我國傳統中醫藥學科在東盟國家的學術地位,具有極其重要的作用。本文首先以《中國-東盟傳統藥物志》為依據,從書中統計各國用于糖尿病的傳統藥物,繼而利用中國知網、維普、Pubmed等數據庫,以藥物拉丁名和糖尿病、降血糖、胰島素關鍵詞,查詢從2010—2020年的公開發表的研究文獻,從而篩選出在中國-東盟國家應用較為廣泛且研究深入傳統藥物有25種,并對這25種傳統藥物治療糖尿病及糖尿病并發癥的作用及其機制進行歸納整理,發現它們改善糖尿病及其并發癥的機制是多樣的,包括抑制炎癥及過氧化反應、調節糖脂、改善胰島素抵抗、提高胰島素敏感性、修復胰島細胞促進胰島素分泌等,見圖2。而且,隨著傳統藥物治療糖尿病及其并發癥研究的深入,傳統藥物的降血糖活性物質不斷被發現。中國及東盟國家豐富的藥用植物資源為各國傳統醫藥的發展提供了堅實的基礎和可靠的保障,中國與東盟地區國家相鄰,生態環境和人文環境相似,傳統醫藥方面的往來與交流具有悠久的歷史,本文對中國-東盟國家常用的25種傳統藥物治療糖尿病及其并發癥的藥理作用進行總結,可為開發安全、有效的降糖藥以及加強中國及東盟國家進一步的研究合作提供一些有益的參考。
利益沖突 所有作者均聲明不存在利益沖突
[1] IDF. Diabetes Ninth edition 2019 [OL]. [2019-11-14]. https://www. diabetesatlas. org/en/resources/.
[2] 鄧家剛. 中國-東盟傳統藥物志 (英文版) [M]. 北京: 北京科學技術出版社, 2019: 1-1433.
[3] 劉率男, 劉泉, 孫素娟, 等. α葡萄糖苷酶抑制劑桑枝總生物堿的抗糖尿病作用研究 [J]. 藥學學報, 2019, 54(7): 1225-1233.
[4] 張聲源, 莊遠杯, 林大都, 等. 蒲桃枝葉抑制α-葡萄糖苷酶活性部位及其化學成分研究 [J]. 天然產物研究與開發, 2018, 30(11): 1950-1956.
[5] Seong S H, Roy A, Jung H A,. Protein tyrosine phosphatase 1B and α-glucosidase inhibitory activities ofroot and its constituents [J]., 2016, 194: 706-716.
[6] 李春英, 夏依拉·艾尼, 毛建衛, 等. 梔子黃對α-葡萄糖苷酶抑制活性的研究 [J]. 食品工業科技, 2015, 36(24): 112-114.
[7] Mohamed E A, Ahmad M, Ang L F,. Evaluation of α-glucosidase inhibitory effect of 50% ethanolic standardized extract ofBenth in normal and streptozotocin-induced diabetic rats [J]., 2015, 2015: 754931.
[8] 方洪帥, 王艷蕊, 肖茜文, 等. 葛根總黃酮的提取及其降糖功效研究 [J]. 農產品加工, 2016(5): 6-10.
[9] 李晶, 蘇薇薇, 王永剛, 等. 麥冬提取物對實驗性2型糖尿病大鼠的保護作用 [J]. 中山大學學報: 自然科學版, 2017, 56(3): 119-124.
[10] 張眾一, 張淇, 揭毅, 等. 玉米須多糖對糖尿病小鼠肝損傷及糖代謝的影響 [J]. 山東大學學報: 醫學版, 2018, 56(5): 52-57.
[11] Ohishi K, Toume K, Arai M A,. 9-hydroxycanthin-6-one, a β-carboline alkaloid from, is the first wnt signal inhibitor through activation of glycogen synthase kinase 3β without depending on casein kinase 1α [J]., 2015, 78(5): 1139-1146.
[12] 劉冬戀, 廖夢玲, 周歡, 等. 桑葉總黃酮對T2DM大鼠骨骼肌糖代謝及GSK-3β表達的影響 [J]. 食品研究與開發, 2018, 39(19): 31-35.
[13] Shieh J P, Cheng K C, Chung H H,. Plasma glucose lowering mechanisms of catalpol, an active principle from roots of, in streptozotocin-induced diabetic rats [J]., 2011, 59(8): 3747-3753.
[14] Olayaki L A, Irekpita J E, Yakubu M T,. Methanolic extract ofleaves improves glucose tolerance, glycogen synthesis and lipid metabolism in alloxan-induced diabetic rats [J]., 2015, 26(6): 585-593.
[15] Arha D, Pandeti S, Mishra A,. Deoxyandrographolide promotes glucose uptake through glucose transporter-4 translocation to plasma membrane in L6 myotubes and exerts antihyperglycemic effect[J]., 2015, 768: 207-216.
[16] Rani A J, Mythili S V. Study on total antioxidant status in relation to oxidative stress in type 2 diabetes mellitus [J]., 2014, 8(3): 108-110.
[17] Evans J L, Goldfine I D, Maddux B A,. Are oxidative stress-activated signaling pathways mediators of insulin resistance and beta-cell dysfunction? [J]., 2003, 52(1): 1-8.
[18] 王蘭, 藍璟, 龔頻, 等. 葛根異黃酮降血糖活性及作用機制的研究 [J]. 食品科技, 2017, 42(3): 223-226.
[19] 王恩芳, 劉曙瑋. 番茄紅素通過激活PI3K/Akt信號通路對2型糖尿病小鼠治療機制研究 [J]. 實用糖尿病雜志, 2015, 11(5): 35-37.
[20] Chen X M, Tang J, Xie W Y,. Protective effect of the polysaccharide fromon streptozotocin- induced diabetic rats [J]., 2013, 94(1): 378-385.
[21] 張韞, 趙宗江, 李平, 等. 黃連素對2型糖尿病大鼠肝臟Nrf2介導的氧化應激反應的影響 [J]. 中華中醫藥雜志, 2020, 35(1): 150-154.
[22] 朱良榮, 殷紅, 陶鋒. 杭白菊總黃酮對糖尿病小鼠血糖及抗氧化能力影響的實驗研究 [J]. 中國中醫藥科技, 2016, 23(2): 163-165.
[23] 馬春宇, 王慧嬌, 于洪宇, 等. 苦瓜總皂苷對2型糖尿病大鼠胰島素信號轉導通路的影響 [J]. 中藥新藥與臨床藥理, 2015, 26(3): 289-294.
[24] 周潔, 李世朋, 馮凱祥, 等. 梔子苷對胰島素抵抗HepG2細胞的胰島素受體及核因子κB的影響 [J]. 中國臨床藥理學雜志, 2015, 31(5): 362-365.
[25] 吳莉娟, 孫文, 吳麗麗, 等. 積雪草醇提物對2型糖尿病ZDF大鼠肝臟胰島素抵抗的影響 [J]. 中國實驗方劑學雜志, 2017, 23(10): 104-110.
[26] 黎宇, 羅新新, 嚴奉東, 等. 葛根上調肝胰島素抵抗HepG2細胞OB-R, IRS2, GLUT1和GLUT2蛋白調節糖代謝的研究 [J]. 中國中藥雜志, 2017, 42(10): 1939-1944.
[27] 馬春宇, 于洪宇, 王慧嬌, 等. 苦瓜總皂苷對改善2型糖尿病大鼠胰島素抵抗關鍵因子的影響 [J]. 中國臨床藥理學雜志, 2015, 31(15): 1522-1525.
[28] Zhou J, Xu G, Ma S,. Catalpol ameliorates high-fat diet-induced insulin resistance and adipose tissue inflammation by suppressing the JNK and NF-κB pathways [J]., 2015, 467(4): 853-858.
[29] 孫文龍. 天然多酚胰島素增敏劑防治糖尿病的基礎研究 [D]. 大連: 大連理工大學, 2017.
[30] 董坤, 李昌煒, 曲卉, 等. 余甘子對胰島素抵抗大鼠骨骼肌PKB表達和GLUT4 mRNA表達的影響 [J]. 第四軍醫大學學報, 2009, 30(21): 2352-2355.
[31] 馬春宇, 于洪宇, 王慧嬌, 等. 苦瓜總皂苷對2型糖尿病大鼠降血糖作用機制的研究 [J]. 天津醫藥, 2014, 42(4): 321-324.
[32] 秦靈靈, 穆曉紅, 徐暾海, 等. 匙羹藤總皂苷對2型糖尿病小鼠脂肪組織GLUT4的調控作用 [J]. 西部中醫藥, 2019, 32(5): 16-19.
[33] G?khan S H. Inflammation and metabolic disorders [J]., 2006, 7121(444): 860-867.
[34] Xi L, Xiao C T, Bandsma R H,. C-reactive protein impairs hepatic insulin sensitivity and insulin signaling in rats: Role of mitogen-activated protein kinases [J]., 2011, 53(1): 127-135.
[35] Rabe K, Lehrke M, Parhofer K G,. Adipokines and insulin resistance [J].,, 14(11/12): 741-751.
[36] Wang N, Xu T Y, Zhang X,. Improving hyperglycemic effect of FGF-21 is associated with alleviating inflammatory state in diabetes [J]., 2018, 56: 301-309.
[37] Feng Y H, Chen L, Luo Q,. Involvement of microRNA-146a in diabetic peripheral neuropathy through the regulation of inflammation [J]., 2018, 12: 171-177.
[38] 李明璽, 黃衛鋒, 姚亮亮, 等. 余甘子提取物降血糖活性及其主要成分研究 [J]. 現代食品科技, 2017, 33(9): 96-101.
[39] 林峰, 吳潔, 王曉, 等. 黃連素改善妊娠期糖尿病大鼠胰島素抵抗及其機制研究 [J]. 中華全科醫學, 2019, 17(10): 1647-1651.
[40] Liao C H, Lin J Y. Lotus (Gaertn) plumule polysaccharide protects the spleen and liver from spontaneous inflammation in non-obese diabetic mice by modulating pro-/anti-inflammatory cytokine gene expression [J]., 2011, 129(2): 245-252.
[41] 李娟娥, 王磊, 秦靈靈, 等. 匙羹藤干預db/db小鼠胰島素抵抗及脂肪組織ADPN, TNF-α mRNA表達的實驗研究 [J]. 中華中醫藥學刊, 2015, 33(9): 2210-2212.
[42] Zhang C, Deng J J, Liu D,. Nuciferine ameliorates hepatic steatosis in high-fat diet/streptozocin-induced diabetic mice through a PPARα/PPARγ coactivator-1α pathway [J]., 2018, 175(22): 4218-4228.
[43] 蒯美玉, 馬志, 孫鑫, 等. 桑酮堿改善2型糖尿病大鼠的糖脂代謝 [J]. 中成藥, 2017, 39(1): 21-26.
[44] Krishnakumari S, Bhuvaneswari P, Rajeswari P. Ameliorative potential ofextract on serum and liver marker enzymes and lipid profile in streptozotocin induced diabetic rats [J]., 2011, 31(1): 26-30.
[45] 盛清凱, 趙紅波, 劉俊珍, 等. 苦瓜降糖多肽-P對2型糖尿病模型鼠血糖血脂的影響 [J]. 山東農業大學學報:自然科學版, 2008, 39(1): 23-25.
[46] Espejel-Nava J A, Vega-Avila E, Alarcon-Aguilar F,. A phenolic fraction fromL. stems decreases glycemia and stimulates insulin secretion [J]., 2018, 2018: 1-9.
[47] Liao C H, Lin J Y. Lotus (Gaertn) plumule polysaccharide ameliorates pancreatic islets loss and serum lipid profiles in non-obese diabetic mice [J]., 2013, 58: 416-422.
[48] Zhang C, Chen H M, Bai W Q. Characterization ofL. polysaccharide and its protective effect on pancreatic cells injury in STZ-induced diabetic mice [J]., 2018, 115: 45-52.
[49] Lokman F E, Gu H F, Wan Mohamud W N,. Antidiabetic effect of oral borapetol B compound, isolated from the plant, by stimulating insulin release [J]., 2013, 2013: 727602.
[50] 任春久, 王彥文, 崔為正, 等. 桑葉多糖通過抑制高糖誘導的INS-1細胞凋亡促進胰島素分泌[A] // 全國蠶桑資源多元化利用學術研討會[C]. 湖州: 中國蠶學會, 2014: 7.
[51] Al-Romaiyan A, Liu B, Asare-Anane H,. A novelextract stimulates insulin secretion from human isletsand[J]., 2010, 24(9): 1370-1376.
[52] 潘春, 唐定乾, 胡婧曄, 等. 梔子苷對2型糖尿病大鼠胰島細胞的保護作用[J]. 糖尿病新世界, 2018(8): 27-28.
[53] Fatima N, Hafizur R M, Hameed A,. Ellagic acid inexerts anti-diabetic activity through the action on β-cells of pancreas [J]., 2017, 56(2): 591-601.
[54] 阮凌玉, 吳陽, 范源. 中藥對糖尿病胰島功能保護研究進展 [J]. 云南中醫中藥雜志, 2017, 38(12): 90-92.
[55] 左曉霜, 馬定乾, 方山丹, 等. 余甘子中沒食子酸抑制高糖誘導胰島β細胞凋亡 [J]. 昆明醫科大學學報, 2018, 39(6): 14-21.
[56] Suthamwong P, Minami M, Okada T,. Administration of mulberry leaves maintains pancreatic β-cell mass in obese/type 2 diabetes mellitus mouse model [J]., 2020, 20(1): 136.
[57] 沈潔, 周珊珊, 萬曉剛. 黃連對2型糖尿病大鼠胰腺內質網應激PERK/ATF4/CHOP信號通路的影響 [J]. 中國實驗方劑學雜志, 2019, 25(16): 50-55.
[58] 康寧, 李強, 桑鋒, 等. 積雪草對高糖誘導的大鼠NRK-52E細胞CTGF和FN表達的影響 [J]. 中國中醫急癥, 2016, 25(5): 759-761.
[59] 彭晶, 蘭天, 黃凱鵬, 等. 黃連素調節鞘氨醇激酶-1-磷酸鞘氨醇信號通路抗糖尿病小鼠腎損傷的研究 [J]. 中國藥理學通報, 2011, 27(11): 1544-1549.
[60] 楊莎莎. Grb10在糖尿病腎病小鼠中作用機制研究 [D]. 重慶: 重慶醫科大學, 2016.
[61] 李新旗, 王超, 楊寒, 等. 基于p38 MAPK/PPAR-γ通路研究車前草水提物對糖尿病腎病大鼠纖維化的影響 [J]. 中國中西醫結合腎病雜志, 2018, 19(10): 885-887.
[62] 陳露, 趙熙杰, 湯佳佳, 等. 鋅/番茄紅素對糖尿病小鼠心肌的保護作用 [J]. 營養學報, 2016, 38(3): 261-266.
[63] 朱定君, 劉紫燕, 殷旭光, 等. 苦瓜總皂苷對2型糖尿病大鼠心臟組織中MMP-9和HO-1表達影響 [J]. 遼寧中醫藥大學學報, 2017, 19(1): 48-51.
[64] 方春錢, 高靜, 周軍, 等. 積雪草酸對糖尿病大鼠心臟及其線粒體的保護作用 [J]. 江蘇大學學報: 醫學版, 2010, 20(2): 157-161.
[65] 向家培, 雷玉華. 梔子苷抑制高糖誘導的乳鼠心臟成纖維細胞向肌成纖維細胞的表型轉化 [J]. 中華老年多器官疾病雜志, 2019, 18(9): 699-704.
[66] 曹月盈, 趙欣, 蒲小平. 糖尿病腦病的發病機制和藥物治療新進展 [J]. 中國新藥雜志, 2019, 28(9): 1065-1069.
[67] 李宏英. 黃連素通過SIRT1/ER stress通路保護糖尿病腦病的機制初探 [D]. 廣州: 廣州中醫藥大學, 2018.
[68] Wu X L, Deng M Z, Gao Z J,. Neferine alleviates memory and cognitive dysfunction in diabetic mice through modulation of the NLRP3 inflammasome pathway and alleviation of endoplasmic-reticulum stress [J]., 2020, 84: 106559.
[69] 任智晶, 羅武, 朱麗英, 等. 何首烏下調1型糖尿病大鼠MLCK表達及其對認知功能的影響 [J]. 時珍國醫國藥, 2015, 26(6): 1314-1316.
[70] Thakur A K, Rai G, Chatterjee S S,. Beneficial effects of anextract and andrographolide on cognitive functions in streptozotocin-induced diabetic rats [J]., 2016, 54(9): 1528-1538.
[71] 周曉燕, 應長江. 番茄紅素減輕糖尿病大鼠視網膜病變的作用及機制 [J]. 第二軍醫大學學報, 2014, 35(10): 1137-1140.
[72] Zhang D Z, Li M. Puerarin prevents cataract development and progression in diabetic rats through Nrf2/HO?1 signaling [J]., 2019, doi: 10.3892/mmr. 2019.10320.
[73] Liu Y F, Luo W M, Luo X Y,. Effects ofMichx. extract on reactive oxygen species production and mitochondrial membrane potential in lens epithelial cells cultured under high glucose [J]., 2015, 8(9): 15759-15765.
Research progress on pharmacological effects of traditional medicines in China and ASEAN countries in treatment of diabetes and its complications
LI Yi-chun1, HAO Er-wei1, 2, LIU Jing-xi1, DU Zheng-cai1, 2, BAI Gang2, 3, ZHANG Tie-jun2, 4, WATTANATHORNJintanaporn2, 5, SIRISA-ARD Panee2, 6, TANG Pei-ling1, 7, HOU Xiao-tao1, 2, DENG Jia-gang1, 2, LIU Chang-xiao2, 4
1. Guangxi Scientific Research Center of Traditional Chinese Medicine, Guangxi Key Laboratory of Efficacy Study on Chinese Materia Media, School of Pharmacy,Guangxi University of ChinesMedicine, Nanning 530000, China 2. China-ASEAN Joint Laboratory for International Cooperation in Traditional Medicine Research, Guangxi University of Chinese Medicine, Nanning 530200, China 3.State Key Laboratory of Medicinal Chemical Biology, Nankai University, Tianjin 300000, China 4. Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 5.Research Institute for Human High Performance and Health Promotion, Khon Kaen University, Khon Kaen 40002, Thailand 6.Department of Pharmacognosy and Pharmaceutical Technology, Faculty of Pharmacy, University of Chiangmai, Chiangmai 50200, Thailand 7. Department of Bioscience, Faculty of Applied Sciences, Tunku Abdul Rahman University College, Kuala Lumpur 53300, Malaysia
Diabetes is a systemic disease due to insufficient or relative secretion of insulin in the body, which leads to glucose metabolism disorder. It seriously threatens the physical and mental health of human beings. China and ASEAN are both high-risk regions of diabetes, with the top 1 patients in the world. By reviewing the book, 81 spieces of traditional medicines can be used to treat diabetes and Xiaoke in China and ASEAN countries, and 25 types that are widely used and studied in depth in China and ASEAN countries. CNKI, Vip, Pubmed and other databases are systematically searched and domestic and foreign literatures about 25 species of traditional medicines for the treatment of diabetes and its complications are organized in this paper. By reviewing the pharmacological effects of 25 species of traditional medicine and their mechanism of action, traditional medicines to improve the mechanism of diabetes and its complications are mainly through inhibiting inflammation and peroxidation, regulating glycolipids, improving insulin resistance, improving insulin sensitivity, repairing islet cells and promoting insulin secretion and so on, which can provide some useful references for development of safe and effective hypoglycemic agents and strengthening the further research cooperation between China and ASEAN countries.
China-ASEAN; traditional medicine; diabetes; complication; pharmacological effects; mechanism of action
R286.7
A
0253 - 2670(2021)04 - 1165 - 12
10.7501/j.issn.0253-2670.2021.04.031
2020-06-15
中國-東盟傳統藥物研究國際合作聯合實驗室建設(二期);廣西科技基地和人才專項(桂科AD19110155)
李意春(1997—),女,廣西人,碩士研究生,研究方向為中藥活性成分及質量控制研究。Tel: 18778291719 E-mail: 1075424315@qq.com
侯小濤,博士生導師,教授,主要從事中藥活性成分與質量控制研究。E-mail: xthou@126.com
鄧家剛,博士生導師,廣西終身教授,主要從事中藥基礎理論與藥效篩選研究。E-mail: dengjg53@126.com
劉昌孝,中國工程院院士,從事藥物代謝與藥動學研究。E-mail: liuchangxiao@163.com
#并列第一作者:郝二偉,男,研究員,主要從事中藥藥效篩選及基礎理論研究。Tel: 13407725749 E-mail: ewhao@163.com
[責任編輯 崔艷麗]

