基于數據挖掘和網絡藥理學的中藥抗血栓用藥規律分析
崔琳琳,苗明三
·循證醫學與臨床用藥·
基于數據挖掘和網絡藥理學的中藥抗血栓用藥規律分析
崔琳琳,苗明三*
河南中醫藥大學,河南 鄭州 450046
深靜脈血栓是新型冠狀病毒肺炎(coronavirus disease 2019,COVID-19)危重癥患者病亡和預后不佳的重要原因,挖掘中醫藥防治血栓的組方用藥規律,為中醫藥用于防治COVID-19危重癥患者出現深靜脈血栓提供參考。以中國知網和萬方數據庫收錄的相關文獻為資料來源,使用Excel 2010、Clementine 12.0軟件,對納入標準的中藥進行關聯規則分析,運用網絡藥理學的方法對核心藥物組合進行基因本體(gene ontology,GO)和京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,研究其作用機制并借助分子對接加以驗證。從中國知網和萬方數據庫中篩選出抗血栓方劑356個,發現25味高頻中藥,進一步關聯分析得到7個高頻藥物組合。其中,核心藥物組合“紅花-桃仁-赤芍-川芎”的有效化學成分23個,核心藥物組合與血栓的交集靶點41個,PPI網絡主要涉及IL-6、VEGFA、CASP3、ALB、EGFR、MAPK8等關鍵靶蛋白,GO功能富集分析,得到生物過程條目971個(<0.05),KEGG富集得到105條通路(<0.05),主要涉及卡波濟氏肉瘤皰疹病毒感染、人巨細胞病毒感染、流體剪切力和動脈粥樣硬化、乙型肝炎等通路;分子對接篩選得到與IL-6結合能力較好的活性成分是木犀草素、槲皮素、黃芩素。核心藥物組合中的關鍵活性成分可通過調控IL-6等關鍵靶點,借助卡波濟氏肉瘤皰疹病毒感染、人巨細胞病毒感染、流體剪切力和動脈粥樣硬化、乙型肝炎等通路發揮抗血栓作用,為新冠肺炎危重癥患者出現深靜脈血栓的預防和治療提供參考。
數據挖掘;網絡藥理學;分子對接;抗血栓;新型冠狀病毒肺炎;木犀草素;槲皮素;黃芩素
目前國外的臨床研究發現,重癥監護病房(intensive care unit,ICU)的新型冠狀病毒肺炎(coronavirus disease 2019,COVID-19)患者出現靜脈血栓栓塞(venous thromboembolic events,VTE)的概率明顯升高,普通病房接收的COVID-19患者中深靜脈血栓(deep venous thrombosis,DVT)的發病率也很高(14.7%),且D-二聚體水平升高是重癥COVID-19患者的常見表現[1],患者處于一種高風險血栓疾病狀態,包括急性冠脈綜合征(acute coronary syndrome,ACS)、靜脈血栓栓塞如DVT或肺栓塞(pulmonary embolism,PE)或卒中[2]。對此,我國研究人員也進行了相關研究,Zhang等[3]對位于武漢的一家大型轉診治療中心的COVID-19患者DVT形成進行調查,發現COVID-19患者中DVT的患病率為46.1%,武漢大學中南醫院對新冠肺炎重癥患者進行DVT篩查,發現85.4%的患者出現DVT[4],且2項臨床研究均提出DVT的形成可能與COVID-19肺炎危重癥患者的不良預后有相關性。《新型冠狀病毒肺炎相關靜脈血栓栓塞癥防治建議(試行)》提出DVT脫落后有發生PE的潛在風險[5],這顯著影響到COVID-19患者的死亡率及預后,因此做好DVT的防治有利于降低COVID-19患者的死亡風險[6]。現代醫學多使用肝素、尿激酶、低分子右旋糖酐、華法林等來抗血栓,但同時消化系統潰瘍等不良反應的發生率也隨之增高[7]。血栓與中醫的血瘀證在生理病理認識方面非常相似,血液充盈、心氣充沛和脈道通利是血液正常運行的基本條件,任何一個環節異常都會引起血行不暢,導致血瘀[8],中醫善于運用內服、外治、針灸、外敷、熏蒸、局部熨燙防治靜脈血栓形成。本研究探索中醫藥抗血栓形成的用藥規律,并運用網絡藥理學對核心藥物組合抗血栓的作用機制進行探討,以期為中醫藥防治COVID-19的DVT形成提供參考。
1 資料與方法
1.1 數據來源
以“中藥”“血栓”為檢索詞,在中國知網數據庫和萬方數據庫中進行搜索,時間范圍是1980年1月—2020年6月,共檢索到7993篇文獻。
1.2 納入標準
①文獻須為臨床病例(不區分是否為隨機對照試驗);②文獻與中藥復方抗血栓相關;③文獻中的復方包含完整藥物組成;④文獻須涉及D-二聚體纖維蛋白原(fibrinogen,Fbg)、凝血酶原時間(prothrombin time,PT)、凝血酶時間(thrombin time,TT)、活化部分凝血活酶時間(activated partial thromboplastin time,APTT)等體現抗栓效果的生化指標或彩色多普勒超聲檢查;⑤樣本數大于等于10。
1.3 排除標準
①重復文獻、非復方文獻;②細胞、動物等基礎研究;③綜述、理論研究類文獻;④無具體藥物組成的文獻研究[9]。
1.4 數據分析
使用Clementine 12.0對納入標準的中藥進行網絡化可視分析展示,并利用Apriori建模進行關聯規則分析[10];使用R語言3.6.2程序基于“bioconductor”數據包提取信息;對核心藥物組合抗血栓的潛在作用靶標進行基因本體(gene ontology,GO)和京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)富集分析;使用Cytoscape軟件構建“疾病-藥物-活性成分-靶點”網絡圖和活性成分與疾病共同靶點的蛋白質-蛋白質相互作用(Protein-protein interactions,PPI)網絡,從RSCB數據庫中下載關鍵靶蛋白的晶體結構,使用AutoDockTools 1.5.6軟件將晶體結構中的水分子刪除,進行加氫處理,并且對蛋白質進行電荷計算,最后保存為pdbqt格式文件,從PubChem數據庫中下載篩選出的關鍵活性化合物3D結構的SDF格式文件,利用Chem3D 17.0軟件和PyMOL進行蛋白小分子結構處理,再上傳化合物文件使其能量最小化,最后運用AutoDock vina軟件進行分子對接,用PyMOL軟件對結果進行可視化[11]。
2 結果與分析
2.1 數據篩選
依據上述納入及排除標準,篩選出符合標準的文獻337篇,將文獻中方劑的基本方進行錄入處理,加減藥物舍去,整理后共得到356首方劑。數據庫檢索及文獻、方劑刪選的具體流程見圖1[12]。

圖1 文獻檢索流程
2.2 單味中藥使用情況
參照《中國藥典》2015年版[13]和《中藥學》[14]對356首方劑中的藥物名稱進行統一,共計出現198種中藥,累計出現頻率3482次,取用藥頻次在前10%作為高頻藥物[15],共包含25種中藥(頻次≥38),累計頻次2437次(占總頻次的69.99%),使用頻數較高的前6味中藥分別是當歸(頻次224,62.92%)、紅花(頻次205,57.58%)、川芎(頻次201,56.46%)、赤芍(頻次188,52.81%)、桃仁(頻次173,48.60%)、牛膝(頻次165,46.35%),見表1。

表1 單味中藥的使用情況(頻次≥38)
2.3 高頻藥物關聯規則分析
Apriori算法是關聯規則挖掘的經典算法,其基于2步頻率集的思想,利用遞推方法分析頻繁項集中隱匿的關聯規則[16-17],在Clementine 12.0軟件中對高頻藥物(使用頻次≥38)進行關聯規則分析,利用Apriori建模,設置支持度為20,置信度為90%,最大前項數為5,提升度≥1等條件[18],在356首方劑中挖掘出7個潛在藥物組合,潛在藥物組合的提升度均大于1,說明這些藥物組合在統計學上均有意義[17],置信度和提升度最高的核心藥組為紅花-桃仁-川芎-當歸,具體參數見表2。高頻藥物間的關聯網絡展示圖見圖2。

表2 高頻藥物間的關聯規則分析

圖2 高頻藥物間的關聯網絡展示
2.4 關聯藥物用量情況
為確保關聯藥物組合防治COVID-19的DVT臨床用藥的準確性、有效性,本研究對得到的關聯藥物組合中涉及的中藥進行用量統計分析,發現當歸、桃仁、紅花、赤芍、川芎的主要用量區間均在10~15 g,牛膝的主要用量區間為10~18 g(表3)。
2.5 基于網絡藥理學核心藥物組合抗血栓的機制分析
2.5.1 核心藥物組合活性成分、作用靶點及血栓作用靶點信息收集 紅花-桃仁-赤芍-川芎是所得置信度和提升度最高的核心藥物組合,在中藥系統藥理學數據庫分析平臺(TCMSP,http://tcmspw.com/ tcmsp.php)檢索紅花、桃仁、赤芍、川芎4味中藥的活性成分和作用靶點,并根據口服生物利用度(oral bioavailability,OB)≥30%以及類藥性(drug- likeness,DL)≥0.18[19],除去重復項和未存在的映射關系,篩選出46個化學成分、109個作用靶點。通過GeneCards數據庫(https://www. genecards.org/)獲取血栓的相關靶標,得到798個作用靶點。
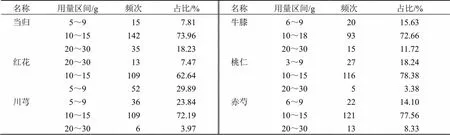
表3 關聯藥物用量情況
2.5.2 疾病-藥物-活性成分-靶點網絡和PPI網絡分析 通過Venn圖得到4味中藥的活性成分與疾病的交集靶點41個,利用STRING(https://string-db. org/)數據庫獲取蛋白互作關系,最后利用Cytoscape軟件構建疾病-藥物-活性成分-靶點網絡(圖3)和PPI網絡(圖4),使用R包制作靶蛋白Barplot圖(圖5)。疾病-藥物-活性成分-靶點網絡圖包含69個節點(41個靶基因、23個藥物活性成分、4個中藥名和1個疾病名),其中槲皮素、β-谷甾醇、黃芩素、木犀草素、山柰酚、豆甾醇是對應靶標最多的化學成分,見表3。PPI網絡圖中靶蛋白之間作用關系的強弱與靶蛋白對應圓的大小、顏色深淺以及蛋白之間連線的粗細、顏色深淺呈正相關,靶蛋白Barplot圖將PPI網絡中每個靶蛋白所連接節點的數量用柱狀圖的形式展示,連接的節點越多代表與其他靶蛋白之間的互作關系越強,最終發現作用強度較強的靶蛋白(節點數目>25)是白細胞介素-6(intedeukin-6,IL-6)、血管內皮生長因子A(vascular endothelial growth factor A,VEGFA)、胱天蛋白酶3(caspase-3,CASP3)、血清白蛋白(albumin,ALB)、表皮生長因子受體(epithelial growth factor receptor,EGFR)、絲裂原激活蛋白激酶8(mitogen-activated protein kinase 8,MAPK8)。
2.5.3 GO功能富集與KEGG通路富集分析 通過數據庫(https://org.Hs.eg.db)對核心藥物組合抗血栓作用靶標進行GO和KEGG富集分析,通過R語言的ClusterProfilerGO.R運行包得到生物功能和通路富集分析的高級氣泡圖(前20條),其中點越大則富集基因越多,值越小顏色越紅,代表與核心藥物組合防治血栓關系越密切[11]。通過GO分析得到971條生物過程(biological process,BP),主要涉及氧化應激反應、解剖結構穩態、細胞對氧化應激的反應、對脂多糖的反應、對酸性化學物質的反應、對細菌源分子的反應等生物過程。通過KEGG通路富集得出105條信號通路(<0.05),主要涉及卡波濟氏肉瘤皰疹病毒感染、人巨細胞病毒感染、流體剪切力和動脈粥樣硬化、乙型肝炎等通路(圖6、7)。

圖3 疾病-藥物-活性成分-靶點網絡
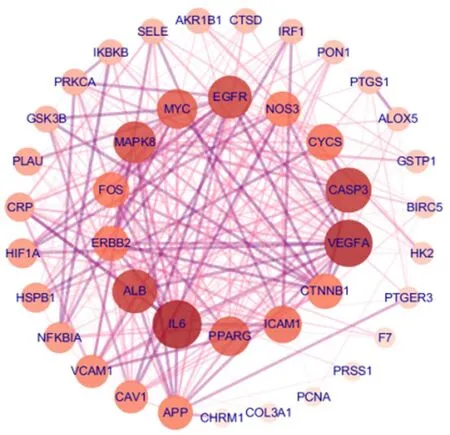
圖4 PPI網絡

圖5 靶蛋白Barplot圖
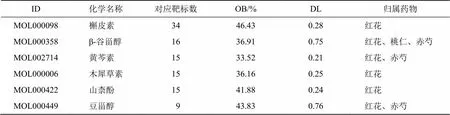
表3 疾病-活性成分-靶點網絡圖中對應靶標最多的活性成分

圖6 GO富集分析的生物過程條目氣泡圖

圖7 KEGG通路富集氣泡圖
2.6 分子對接驗證核心藥物組合抗血栓共有活性成分與核心靶點間的相互作用
將核心藥物組和中作用靶點最多的化學活性成分與PPI網絡中連接節點數目最多的核心靶蛋白IL-6進行分子對接(表4),從而對網絡藥理學所得結果加以驗證。分子對接中結合能小于0提示配體與受體可自發結合[20],且結合構象越穩定結合能越低,小分子化合物與蛋白發生作用的可能性越大[21],本研究選取結合能≤?20 kJ/mol作為篩選條件[12],對接結果顯示,6種活性成分均能與IL-6結合,對接情況見圖8,其中木犀草素、槲皮素、黃芩素結合活性較好。

表4 核心藥物組合作用靶點最多的活性成分與IL-6的結合能
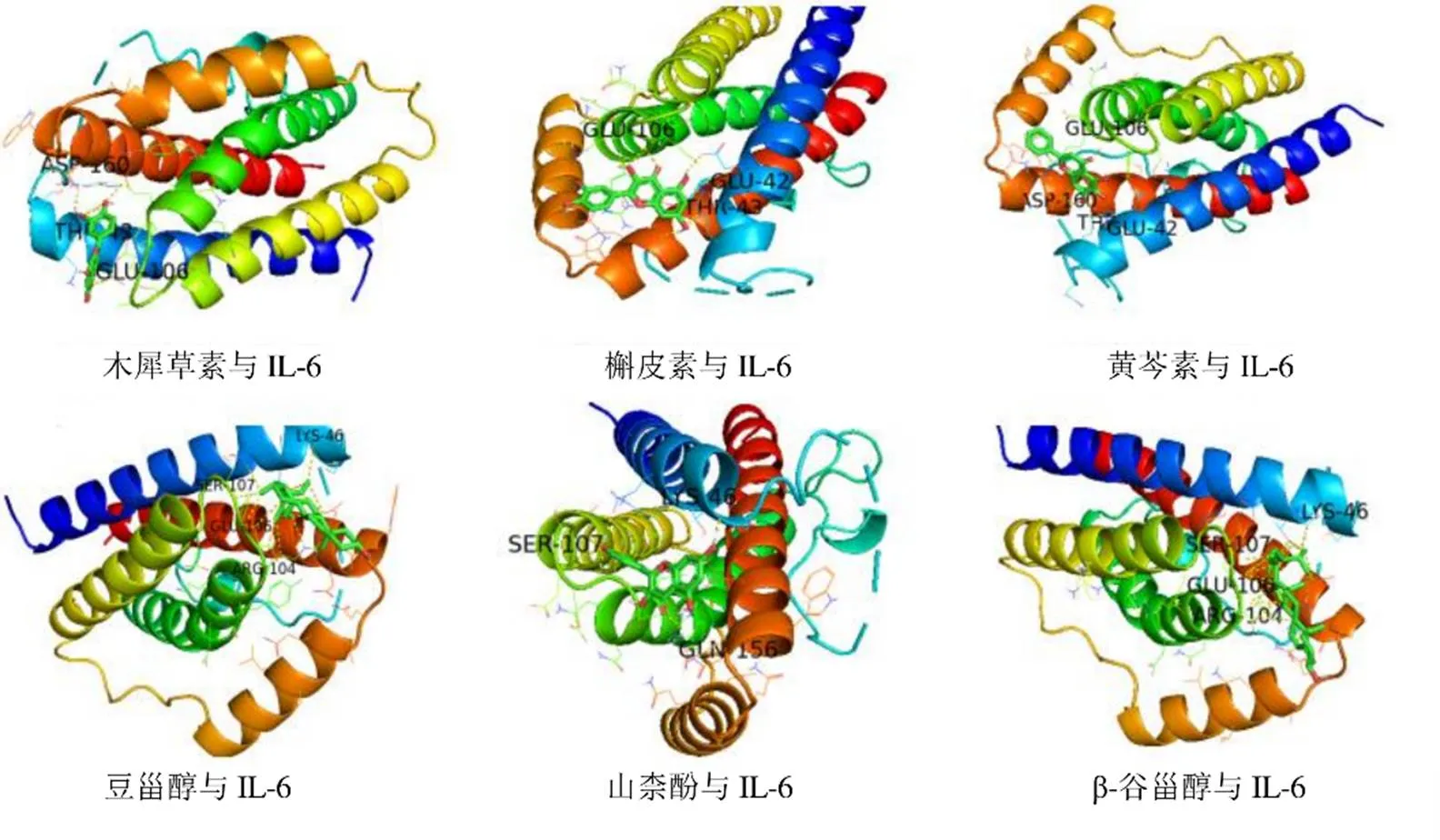
圖8 核心藥物組合活性成分與IL-6的分子對接三維圖
3 討論
目前國內外研究已證實2型嚴重急性呼吸系統綜合征冠狀病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)與血栓栓塞癥之間聯系密切,但生理病理學尚未完全闡明其發生機制,現有的數據表明COVID-19患者體內D-二聚體明顯升高,患者機體處于高凝狀態[22]。有學者認為這與COVID-19引起的炎癥因子風暴有關,COVID-19患者血漿腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β、IL-8水平均顯著升高[23],致使血小板活化、內皮功能障礙進而形成血栓;近期國外有學者在COVID-19患者內皮細胞上發現病毒存在的證據,故另一種解釋是血管緊張素轉換酶2(angiotensin converting enzyme,ACE2)受體在內皮細胞中廣泛表達,SARS-CoV-2與之結合,導致內皮損傷,進而誘發動、靜脈血栓[24]。此外,嚴重的肺部疾病、患病者年齡偏高、長期臥床也是COVID-19血栓形成及不良預后的可能原因,最重要的是,目前雖采取標準劑量或高劑量進行預防性抗凝治療,但血栓形成的風險依然很高,且抗凝的最佳劑量尚未確定,臨床上也亟待發現除D-二聚體外的更多預測性生物標志物[25]。因此,將中醫藥抗血栓的寶貴經驗運用到COVID-19防治血栓的治療中,或對改善危重癥患者不良預后大有裨益。
本研究通過對知網、萬方數據庫中與抗血栓相關的356首方劑進行挖掘分析,發現25味高頻中藥、7個關聯藥物組合,并統計關聯藥物組合中各中藥用量情況,為以后臨床上COVID-19抗血栓治療提供參考。其中紅花-桃仁-赤芍-川芎為本研究所得核心藥物組合。中醫將DVT歸屬瘀血、脈痹范疇,病機為氣機不暢、瘀血阻塞經脈[26],而核心藥組中桃仁、紅花主活血化瘀,赤芍涼血散瘀,川芎行氣活血,共奏破血、行氣、化瘀之功,恰與血栓形成的基本病機相吻合。依據網絡藥理學的分析結果,可知核心藥物組合關鍵靶點蛋白主要是IL-6、VEGFA、CASP3、ALB、EGFR、MAPK8等,其中IL-6能激活血小板,增加其促凝活性,還可誘導肝臟產生如C-反應蛋白、纖維蛋白原等急性反應蛋白,增加凝血因子數量,促進血栓形成[27];VEGF可促進間質血管內皮細胞的增生[28],起到抗血小板作用[29],而VEGFA是其主要成員;CASP3是Caspase家族成員,是凋亡信號的關鍵執行者[30];ALB具有肝磷脂樣的活性,可與NO結合,抑制其失活,從而相對延長血小板的聚集,從而發揮抗凝作用[31];EGFR是具有酪氨酸激酶活性的跨膜糖蛋白,結合其受體后可對細胞增殖、凋亡及血管新生等發揮調控作用[32];MAPK8在炎癥細胞的增殖、分化和產生過程中起著關鍵的作用[33]。以上提示,核心藥物組合可能通過抗炎、抗血小板、促進血管新生發揮抗血栓作用。
對核心藥物組合活性成分進行GO富集,富集靶點最多的生物學過程為氧化應激反應,研究發現COVID-19引起的過激免疫反應會使機體產生大量自由基,導致氧化應激-自由基堆積[34],致使機體氧化與抗氧化失衡,引起血管內皮細胞氧化損傷,最終誘導血栓形成[35]。KEGG通路富集數目較多的主要是卡波西肉瘤相關皰疹病毒感染、人巨細胞病毒感染、流體剪切力和動脈粥樣硬化等通路,值得注意的是,這4個通路大多涉及VEGF或IL-6。VEGF既能增加血管通透性,又能與血管內皮細胞受體特異性結合,促進血管內皮細胞的分裂和增殖,而血管內皮細胞能產生舒血管因子如前列環素,從而擴血管、抑制血小板聚集[36]。研究發現,IL-6在輕型、普通型COVID-19患者體內升高不明顯且短期內可隨治療大副遞減,而重型患者在住院第3天有明顯升高,這可能是機體在對抗SARS-CoV-2的感染,即“細胞因子風暴”[37],IL-6既是機體炎癥促發關鍵因子[38],又能刺激肝細胞產生大量的凝血因子VIII和血漿組織因子(tissue factor,TF),加速凝血途徑,還可以促進巨噬細胞的增殖與成熟,導致血小板的產量增加[21]。
目前許多報道[39-40]已證實COVID-19患者血清中的IL-6顯著升高,且表達水平與COVID-19病情的嚴重程度呈正相關性,此外,IL-6可通過激活內皮細胞,誘導高凝狀態增加血栓性疾病發生的風險,生成的血栓又會刺激IL-6的高表達,形成惡性循環[41],故IL-6可能是防治新冠肺炎危重癥患者血栓形成預后評價的參考指標和治療靶點。網絡藥理學分析結果也顯示IL-6是核心藥物組合發揮抗血栓的關鍵靶蛋白,而且分子對接結果提示木犀草素、槲皮素、黃芩素與IL-6結合活性較好,其中木犀草素可與IL-6蛋白A鏈上的Glu106、Glu42、Asp160形成氫鍵作用,槲皮素可與IL-6蛋白A鏈上的Thr43、Glu42、Glu106形成氫鍵作用,黃芩素可與IL-6蛋白A鏈上的Glu106、Thr43、Asp160形成氫鍵作用。有研究發現,木犀草素能明顯抑制促炎細胞因子IL-6的分泌,發揮抗炎作用[42],槲皮素可通過抗血小板聚集抗血栓[43],黃芩素可抑制膠原和花生四烯酸誘導的血小板聚集,抑制凝血酶誘導纖維蛋白原向纖維蛋白轉化,發揮抗凝血、抗血栓形成作用[44]。
綜上,本研究基于數據挖掘和網絡藥理學對中醫藥抗血栓的組方用藥規律及其作用機制進行探討,發現核心藥物組合(紅花-桃仁-赤芍-川芎)中的關鍵活性成分可通過調控IL-6等關鍵靶點,借助與病毒感染及炎癥血管性疾病相關通路,對抗氧化應激反應,修復血管內皮損傷,抑制血小板聚集,發揮抗血栓作用,為COVID-19危重癥患者出現DVT的預防和治療提供數據支撐與理論指導。
利益沖突 所有作者均聲明不存在利益沖突
[1] Demelo-Rodríguez P, Cervilla-Mu?oz E, Ordieres-Ortega L,. Incidence of asymptomatic deep vein thrombosis in patients with COVID-19 pneumonia and elevated D-dimer levels [J]., 2020, 192: 23-26.
[2] Watson R A, Johnson D M, Dharia R N,. Anti-coagulant and anti-platelet therapy in the COVID-19 patient: A best practices quality initiative across a large health system [J]., 2020, 48(4): 169-179.
[3] Zhang L, Feng X K, Zhang D Q,. Deep vein thrombosis in hospitalized patients with COVID-19 in Wuhan, China: Prevalence, risk factors, and outcome [J]., 2020, 142(2): 114-128.
[4] Ren B, Yan F F, Deng Z M,. Extremely high incidence of lower extremity deep venous thrombosis in 48 patients with severe COVID-19 in Wuhan [J]., 2020, 142(2): 181-183.
[5] 中華醫學會呼吸病學分會肺栓塞與肺血管病學組,中國醫師協會呼吸醫師分會肺栓,塞與肺血管病工作委員會, 等. 等新型冠狀病毒肺炎相關靜脈血栓栓塞癥防治建議(試行) [J]. 中華醫學雜志, 2020, 100(11): 808-813.
[6] 高倩, 甄凱元, 劉鵬, 等. 關注新型冠狀病毒肺炎相關靜脈血栓栓塞癥的預防和診治: 《新型冠狀病毒肺炎相關靜脈血栓栓塞癥防治建議(試行)》解讀 [J]. 中華普通外科雜志, 2020, 35(3): 259-262.
[7] 周勝元, 劉玥, 付濱, 等. 中藥復方制劑抗血栓作用機制的研究進展 [J]. 遼寧中醫雜志, 2015, 42(4): 893-896.
[8] 阮灝, 馬曉娟, 孫明月, 等. 益氣活血中藥抗血栓作用研究進展 [J]. 中西醫結合心腦血管病雜志, 2019, 17(1): 71-74.
[9] 武晏屹, 葉琳, 苗明三. 基于數據挖掘的中藥霧化吸入治療下呼吸道感染用藥規律分析 [J]. 中藥藥理與臨床, 2020, 36(4):47-51.
[10] 武晏屹, 田碩, 雷會霞, 等. 基于數據挖掘的中藥增強機體免疫功能用藥規律分析 [J]. 中藥藥理與臨床, 2020, 36(1): 41-45.
[11] 崔琳琳, 宋亞剛, 苗明三. 基于網絡藥理學和分子對接的陳皮干預COVID-19的可能機制 [J]. 中藥藥理與臨床, 2020, 36(5): 28-33.
[12] 宗陽, 丁美林, 馬世堂, 等. 以血管緊張素轉換酶Ⅱ(ACE2)為受體挖掘治療新型冠狀病毒肺炎(COVID-19)潛在中藥及單體成分 [J]. 中草藥, 2020, 51(5): 1123-1129.
[13] 中國藥典 [S]. 一部. 2015: 3-384.
[14] 任艷玲. 中藥學 [M]. 北京: 中國中醫藥出版社, 2018.
[15] 梁楊, 丁長松. 基于數據挖掘的冠心病辨證用藥規律研究 [J]. 中草藥, 2020, 51(14): 3742-3746.
[16] 馬潔, 馬瑞改, 白秋江. 基于Apriori算法的阿托伐他汀聯合降壓藥相互作用不良反應高危因素的關聯性分析 [J]. 中國醫院藥學雜志, 2020, 40(18): 1962-1967.
[17] 熊平. 數據挖掘算法與Clementine實踐 [M]. 北京: 清華大學出版社, 2011: 88-89.
[18] 馬林納, 王瑞, 苗明三. 基于數據挖掘的治療肺纖維化中藥用藥規律分析 [J]. 中草藥, 2020, 51(6): 1406-1411.
[19] 唐標, 鄧常清. 基于網絡藥理學的降脂理肝湯治療非酒精性脂肪肝病作用機制研究 [J]. 中草藥, 2018, 49(15): 3493-3500.
[20] 姚運秀, 賀楨翔, 劉曉鳳, 等. 基于網絡藥理學和分子對接技術的抗病毒顆粒治療新型冠狀病毒肺炎(COVID-19)的潛在物質基礎研究 [J]. 中草藥, 2020, 51(6): 1386-1396.
[21] 宗陽, 姚衛峰, 單進軍, 等. 基于網絡藥理學和分子對接法探尋清宣止咳顆粒治療兒童新型冠狀病毒肺炎活性化合物 [J]. 世界中醫藥, 2020, 15(4): 477-483.
[22] Woehl B, Lawson B, Jambert L,. 4 cases of aortic thrombosis in patients with COVID-19 [J]., 2020, 2(9): 1397-1401.
[23] 鄒海, 李慧洋, 張有志, 等. 新型冠狀病毒感染與凝血功能關系的研究進展 [J]. 醫藥導報, 2020, 39(4): 448-451.
[24] Varga Z, Flammer A J, Steiger P,. Endothelial cell infection and endotheliitis in COVID-19 [J]., 2020, 395(10234): 1417-1418.
[25] Bikdeli B, Madhavan M V, Jimenez D,. COVID-19 and thrombotic or thromboembolic disease: Implications for prevention, antithrombotic therapy, and follow-up: JACC state of the art review [J]., 2020, 75(23): 2950-2973.
[26] 孫春霞, 白霞. 淺談深靜脈血栓的中醫預防及護理 [J]. 世界最新醫學信息文摘, 2019, 19(A5): 253.
[27] 石錦, 莫建文. IL-6在創傷性深靜脈血栓中的研究進展 [J]. 贛南醫學院學報, 2020, 40(3): 302-307.
[28] 黃友, 楊莎莎, 林夏, 等. 基于網絡藥理-分子對接研究附子理中丸治療潰瘍性結腸炎的作用機制 [J]. 藥學學報, 2020, 55(8): 1812-1822.
[29] 張飛. VEGF及SiRNA和AP-2α對動脈粥樣硬化斑塊的影響 [D]. 長沙: 中南大學, 2009.
[30] 宋朝彥, 董曉輝, 謝東. 丁苯酞對大鼠腦創傷后caspase-3的表達與細胞凋亡的影響 [J]. 臨床神經外科雜志, 2015, 12(2): 107-110.
[31] 張英霞, 張云. 血清白蛋白的功能及應用 [J]. 海南大學學報: 自然科學版, 2007, 25(3): 315-320.
[32] 張偉. EGFR與VEGF在食管鱗癌組織中的表達分析 [J]. 中國醫藥指南, 2019, 17(31): 37.
[33] Kim H I, Hong S H, Ku J M,. Tonggyu-tang, a traditional Korean medicine, suppresses pro- inflammatory cytokine production through inhibition of MAPK and NF-κB activation in human mast cells and keratinocytes [J]., 2017, 17(1): 186.
[34] 張巖, 唐德志, 舒冰, 等. 基于文獻探討中藥干預新型冠狀病毒肺炎的作用機制 [J]. 中醫雜志, 2020, 61(13): 1110-1117.
[35] 甘曉, 應燕萍. 氧化應激與血栓性疾病關系的研究進展 [J]. 臨床心血管病雜志, 2019, 35(8): 758-762.
[36] 劉振江. VEGF、ENOS表達影響內皮細胞膜穩定性促DVT形成的研究 [D]. 昆明: 昆明醫科大學, 2014.
[37] 梁晗. PCT與IL-6聯合檢測對新冠病毒感染肺炎的臨床價值研究 [J]. 智慧健康, 2020, 6(29): 20-22.
[38] 孫晶晶, 劉純, 楊增偉, 等. 血清加熱滅活法對新型冠狀病毒肺炎患者的降鈣素原和白細胞介素-6檢測結果的影響研究 [J]. 蘭州大學學報: 醫學版, 2020, 46(2): 10-13.
[39] 昌仲勇, 楊為斌, 王強, 等. 血清hs-CRP、IL-6、PCT對新型冠狀病毒肺炎患者的診斷及預后評估的臨床意義 [J]. 現代藥物與臨床, 2020, 35(3): 417-420.
[40] 鄒青旭, 林風武, 王巖, 等. 老年新型冠狀病毒肺炎患者血清IL-2R、IL-6、TNF-α水平變化及臨床意義 [J].長春中醫藥大學學報, 2020, 36(4): 692-694.
[41] 丁萌, 張青云, 景陽, 等. C-反應蛋白、白介素-6和D-二聚體在下肢深靜脈血栓形成患者干預前后血清中的表達及意義 [J]. 中國實驗診斷學, 2017, 21(1): 63-65.
[42] 余潔, 彭哲, 謝婷, 等. 木犀草素對哮喘患兒外周血單核細胞TNF-α和IL-6分泌的影響及機制研究 [J]. 中國免疫學雜志, 2019, 35(13): 1580-1583.
[43] 梁艷玲, 蔣威. 槲皮素的心血管保護作用研究進展 [J]. 解剖學研究, 2018, 40(5): 444-448.
[44] 張喜平, 李宗芳, 劉效恭. 黃芩素的藥理學研究概況 [J]. 中國藥理學通報, 2001, 17(6): 711-713.
Analysis of antithrombotic medication of traditional Chinese medicine based on data mining and network pharmacology
CUI Lin-lin, MIAO Ming-san
Henan University of Traditional Chinese Medicine, Zhengzhou 450046, China
Deep venous thrombosis is an important cause of death and poor prognosis in critically ill patients with COVID-19. This paper excavates the prescription rules of TCM in preventing and treating thrombosis, so as to provide reference for Chinese medicine in preventing and treating deep venous thrombosis in critically ill patients with COVID-19. Methods Based on the journal literature collected from CNKI and Wan-fang database, excel 2010 and Clementine 12.0 software were used to analyze the association rules of the included standard traditional Chinese medicine, and analyze the enrichment of GO and KEGG in the core drug groups with the method of network pharmacology. The mechanism of action was studied and verified by molecular docking.A total of 356 antithrombotic prescriptions were screened from CNKI and Wan-fang database, 25 high-frequency herbs were found, and seven high-frequency drug groups were obtained by further correlation analysis. Among them, there were 23 effective chemical components in the core drug group “Honghua ()-Taoren ()-Chishao ()-Chuanxiong ()”, 41 intersection targets between core drug group and thrombus. PPI network mainly involved key target proteins such as IL6, VEGFA, CASP3, ALB, EGFR, MAPK8, etc. Go functional enrichment analysis revealed 971 biological process entries (< 0.05), and 105 pathways (< 0.05) were obtained from KEGG enrichment, which mainly involved Kaposi's sarcoma herpes virus infection, human cytomegalovirus infection, fluid shear force, atherosclerosis, hepatitis B and other pathways. The results showed that luteolin, quercetin and baicalein were the active components with better binding ability to IL-6.The key active components in the core drug group can play an antithrombotic role by regulating key targets such as IL-6, and by means of the pathways of Kaposi's sarcoma herpesvirus infection, human cytomegalovirus infection, fluid shear force, atherosclerosis, hepatitis B, etc., with view to providing a reference for the prevention and treatment of deep vein thrombosis in critically ill patients with COVID-19.
data mining; network pharmacology; molecular docking; antithrombotic; coronavirus disease 2019 (COVID-19); luteolin; quercetin; baicalein
R285
A
0253 - 2670(2021)04 - 1063 - 10
10.7501/j.issn.0253-2670.2021.04.020
2020-08-11
國家重大新藥創制項目(2017ZX09301071);國家國際合作基地項目(2016-65)
崔琳琳(1994—),女,碩士研究生,從事中藥藥理學研究。Tel/Fax: 15639715423 E-mail: 2998807529@qq.com
苗明三(1965—),男,教授,從事中藥藥理學研究。Tel/Fax: (0371)65962546 E-mail: miaomingsan@163.com
[責任編輯 潘明佳]

