機器人肝切除術與腹腔鏡肝切除術治療結直腸癌肝轉移的對比研究
任昊楨,湯寧,王帥,張玉衡,施曉雷
(南京大學醫學院附屬鼓樓醫院 肝膽外科,江蘇 南京 210008)
結直腸癌是世界范圍內最常見的惡性腫瘤之一,其發病率在男性和女性惡性腫瘤中分別處于第三位和第二位,極大地威脅人們的生命健康[1]。肝臟是結直腸癌最好發的轉移部位[2],雖然臨床上對結直腸癌肝轉移有不少的治療手段,手術切除仍是最有效的治療方法[3]。開腹手術由于手術切口大、創傷大,患者康復速度慢,微創手術日益成為結直腸癌肝轉移手術切除的主流方式。腹腔鏡肝切除術因對患者創傷小,術后康復快,并發癥較少,已在臨床廣泛開展[4]。腹腔鏡系統由于采用二維平面圖像、器械固定關節自由活動度小,學習曲線長,限制了其在復雜肝切除術中的應用。達芬奇機器人手術系統不僅擁有更高倍的三維手術視野,還具備靈活且穩定的器械,彌補了腹腔鏡設備的缺陷,因此對于結直腸癌肝轉移的手術,尤其是對部分復雜部位的肝切除處理更具優勢[5]。目前機器人肝切除術治療結直腸癌肝轉移的文獻報道非常有限,缺乏與腹腔鏡肝切除療效之間的比較。南京大學醫學院附屬鼓樓醫院肝膽外科自2019年4月開展達芬奇機器人肝切除術,目前已完成300余例。本研究通過回顧性分析我科開展的機器人肝切除術和腹腔鏡肝切除術治療結直腸癌肝轉移患者的病例資料,評估達芬奇機器人手術系統治療結直腸癌肝轉移的安全性及有效性。
1 資料和方法
1.1 一般資料
納入標準:(1)既往有結直腸癌根治性手術病史并經病理證實,術后發現存在肝轉移;(2)術前經PET-CT檢查排除肝外轉移,并經腹部CT和磁共振確定為肝轉移可切除;(3)手術方案為肝葉切除、半肝切除或肝段切除。排除標準:(1)開腹手術;(2)術前檢查已存在肝外轉移,僅行肝轉移姑息性切除。
2019年4月至2020年6月共納入53例符合上述標準的結直腸肝轉移病例。根據手術方式的不同分為機器人組(25例)和腹腔鏡組(28例)。我們統計了兩組患者的基本情況:性別、年齡、BMI、基礎疾病、腫瘤位置、腫瘤數量和肝切除方式;術中情況包括:手術時間、術中出血量、是否輸血、肝門阻斷時間和有無中轉開腹;術后情況包括:術后住院時間、通氣時間、首次排便時間、術后正常進食時間、下床活動時間和術后24 h肝功能;并發癥情況包括:腹腔出血、膽漏、切口感染、胸腔積液和腸梗阻等并發癥并進行回顧性分析。手術前各組患者肝功能Child-Pugh評分均為A級,DDG試驗吲哚菁綠的15 min滯留率小于10%。術前均采用IQQA?-3D Liver軟件進行肝臟三維重建,計算殘余肝臟體積,保障手術安全。本研究經所在醫院倫理委員會的審核與批準,并與患者及家屬溝通簽署治療知情同意書。手術由本科室具備機器人及腔鏡豐富經驗的同一組醫師完成。
1.2 手術方法
所有患者均采用相同的術前準備,麻醉予呼吸機輔助通氣和靜脈麻醉,心電監護、橈動脈插管檢測動脈壓、深靜脈留置導管檢測中心靜脈壓及補液。
本文主要介紹機器人手術組,其中使用設備包含機器人手術系統、腹腔鏡下超聲探頭和其他腹腔鏡、開腹手術常用器械。如病灶在左肝,患者體位為分腿式平臥位,頭側抬高15°~20°。如病灶在右肝,患者體位為左側半臥位,右側抬高30°~45°。Trocar布局根據病灶部位及肝切除方式決定,通常采用五孔法,扇形分布,機器人手臂Trocar之間距離>8 cm。左肝手術時,鏡頭孔置于臍下,1、2機械臂孔分別置于左肋緣下及右肋緣下鎖骨中線水平,助手孔分別置于鏡頭孔與機械臂孔連線中點偏外側(見圖1);右肝手術時,鏡頭孔置于臍右側,1、2機械臂孔分別置于劍突下及右肋緣下緣,助手孔分別置于鏡頭孔與機械臂孔連線中點偏外側(見圖2)。機器人床旁操作臂系統自患者頭側推入,主操作者坐于控制臺,助手立于患者兩側。術中使用腹腔鏡下超聲來確定病灶所在部位并明確切除范圍,按計劃行半肝切除、肝葉切除或肝段切除術。術中常規置放置肝門阻斷帶,在必要時通過Pringle法將入肝血流阻斷。術中采用超聲刀離斷肝實質,雙極電凝配合止血。肝內管道結構3 mm以下時采用超聲刀離斷,較粗管道采用鎖扣夾夾閉或Prolene線縫合處理。肝蒂或肝靜脈以Endo-GIA連同相應肝實質一并切斷。肝斷面通過沖洗后仔細檢查是否存在出血、膽漏,在可靠的縫合處理后,于肝斷面處放置同樣的止血材料。切除的組織使用標本袋取出。
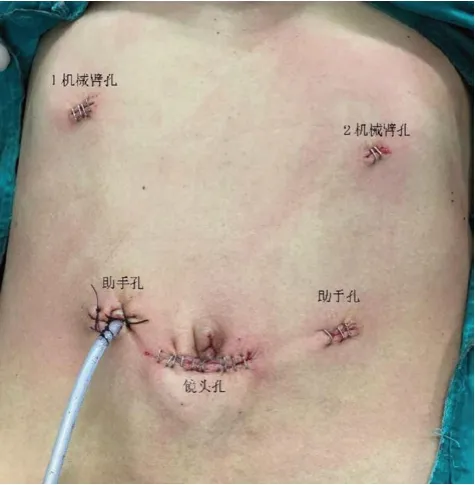
圖1 左肝切除Trocar分布圖示
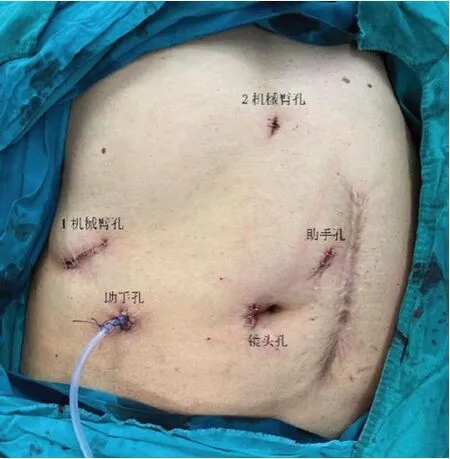
圖2 右肝切除Trocar分布圖示
1.3 圍手術期管理
圍手術期嚴格遵循快速康復外科理念,兩組處理一致,在手術前不嚴格限制飲食,不常規放置鼻胃管,患者手術前夜進食流質飲食,術中控制性補液并維持患者手術時體溫,術后控制性補液,并預防性應用抗生素,術后3 d內予以抗炎鎮痛處理,手術后積極對患者進行宣教,促使患者早期進食流質并下床運動。
1.4 統計學分析
采用SPSS 23.0 統計軟件對兩組數據進行統計分析。計量資料以(±s)表示,采用t檢驗或Mann-Whitney檢驗;計數資料采用χ2檢驗進行比較。當P<0.05為差異具有統計學意義。
2 結果
2.1 入組患者資料
篩選出和條件相符的患者共53例,其中行機器人組25例,行腹腔鏡組28例。兩組患者的性別、年齡、BMI、基礎疾病、腫瘤位置、腫瘤數量和肝切除方式等一般資料比較,不存在統計學差異(P>0.05),具備可比性,見表1。
2.2 術中情況
兩組患者在術中平均輸血量和肝門阻斷時間無統計學差異。與腹腔鏡組相比,機器人組手術時間短,術中出血少,輸血例數少,差異有統計學意義(P<0.05),顯示出機器人在術中安全性方面的優勢。在中轉開腹方面,機器人組與腹腔鏡組相比,差異具有統計學意義(P<0.05)。機器人組中轉開腹1例,因腫瘤位于肝7段,術中出血難以控制,影響手術操作而中轉開腹;腹腔鏡組中轉開腹9 例,6 例因出血難以控制而中轉開腹,2例因腫瘤分別與膈肌和肝門部粘連,難以分離而中轉開腹,1例因腫瘤位于肝臟深部,腔鏡B超探查難以確定腫瘤而中轉開腹。患者術中結果見表2。
2.3 術后情況和并發癥情況
機器人組與腹腔鏡組相比,在術后康復時間方面具有一定優勢。機器人組的術后住院時間和肛門排氣時間更短,術后進食時間更早,差異具有統計學意義(P<0.05)。此外機器人組雖然在排便時間和下床活動時間和腹腔鏡組比較沒有統計學差異(P>0.05),但仍優于后者。兩組患者術后24 h肝功能方面如ALT、AST、ALB、TBIL的比較差異均無統計學意義(P>0.05)。
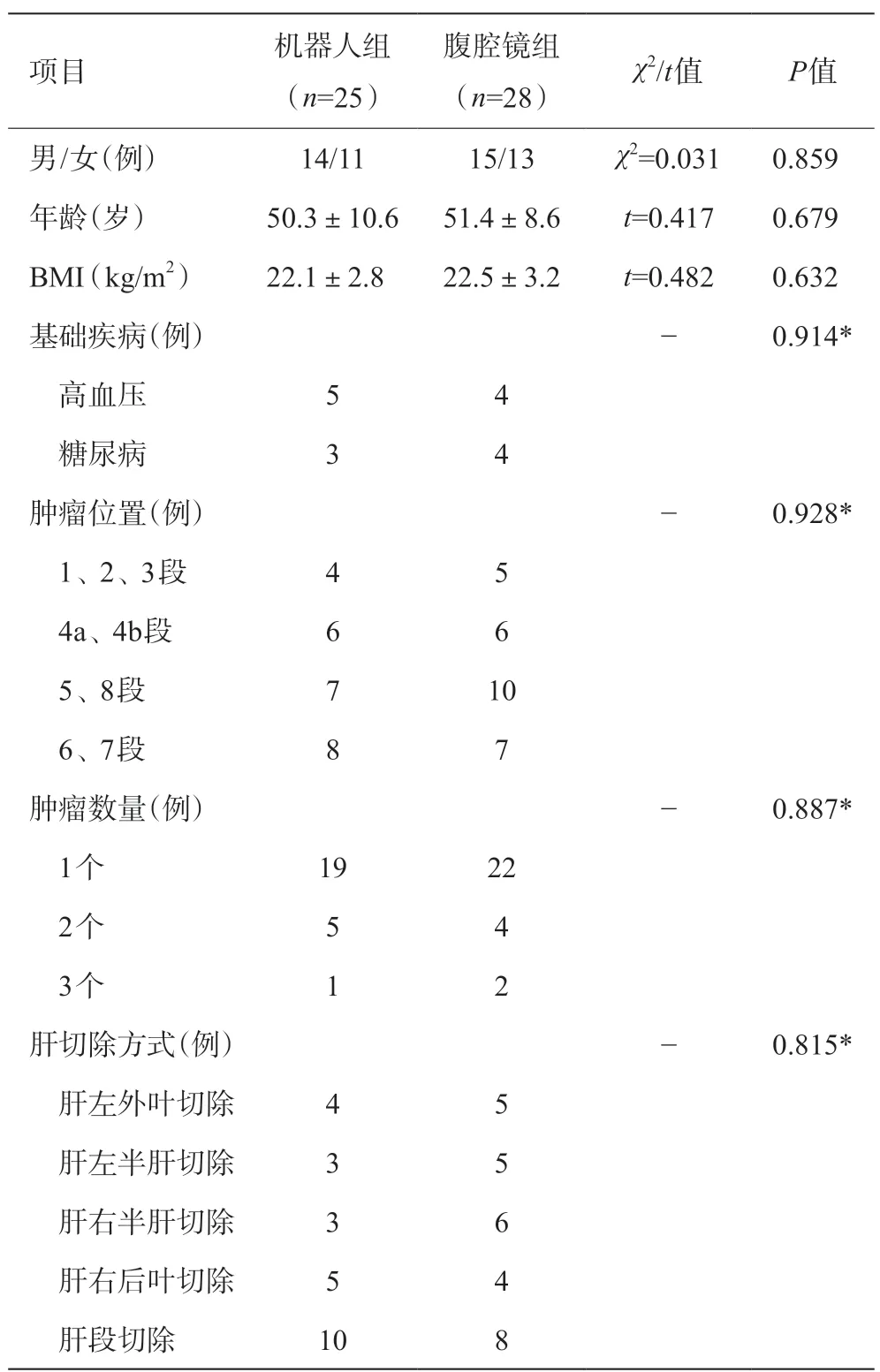
表1 兩組患者術前一般情況
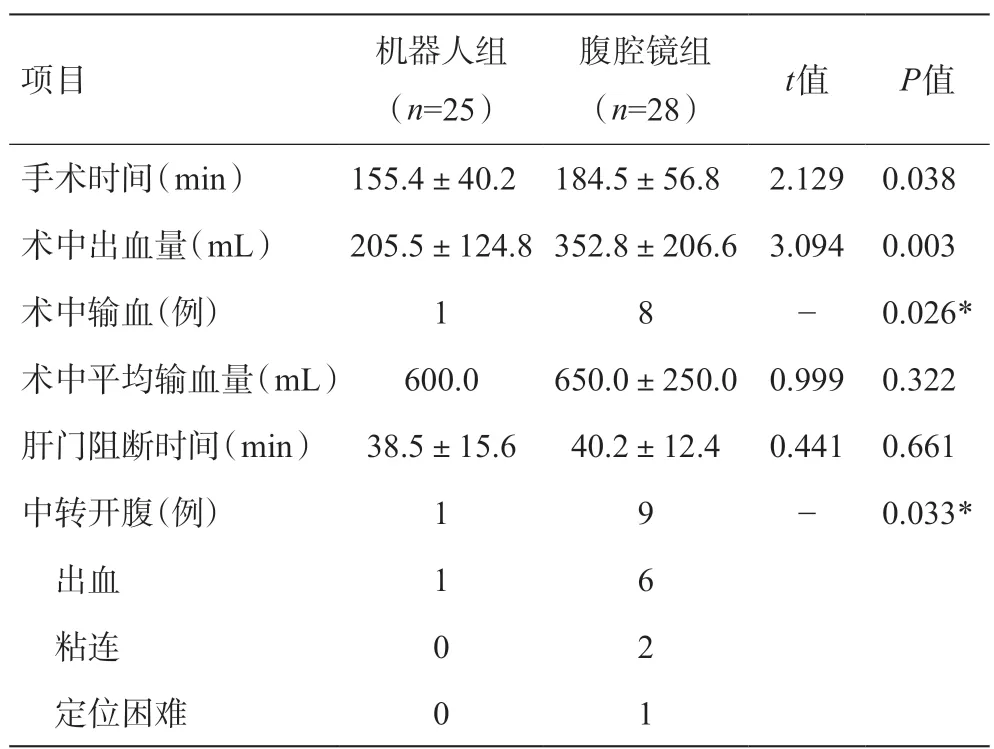
表2 兩組患者術中情況比較
兩組患者的并發癥指標包括腹腔出血、膽漏、切口感染、胸腔積液和腸梗阻,經比較兩組之間差異無統計學意義(P>0.05)。機器人組僅分別出現1例輕微膽漏和胸腔積液,未行特殊處理患者自行好轉;腹腔鏡組出現1例腹腔出血,2例膽漏,2例切口感染,2例胸腔積液和1例腸梗阻,都經保守對癥治療后康復出院。患者術后結果見表3。
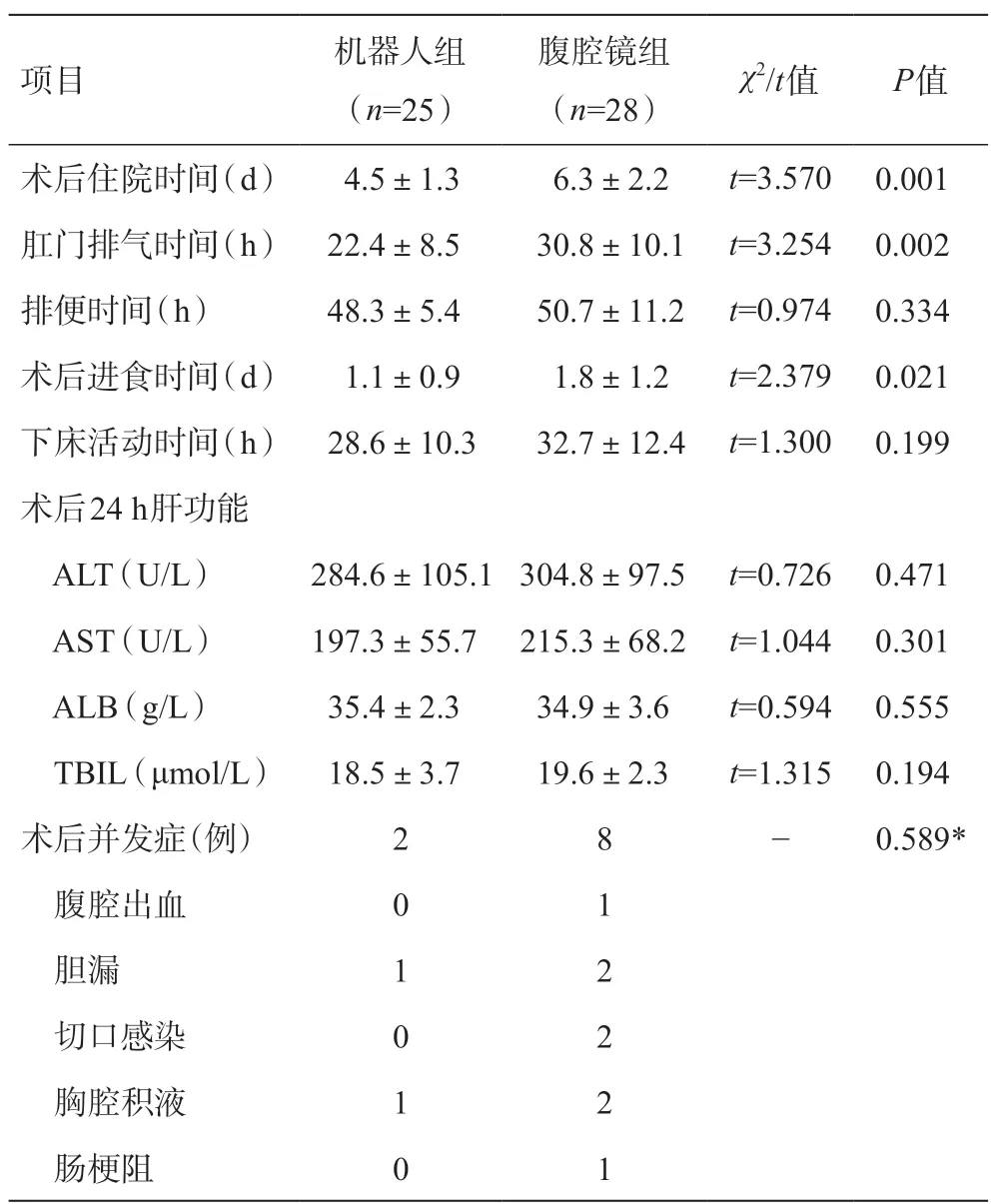
表3 兩組患者術后情況比較
3 討論
目前,外科手術是治療結直腸癌肝轉移唯一有效的方法,手術切除原發灶和肝轉移灶的患者五年生存率可達35%~58%[6]。相比開腹手術,腹腔鏡手術具有縮短患者住院時間、加速患者術后康復及術后疤痕更美觀等優勢,在結直腸癌肝轉移切除術中顯示出得天獨厚的優勢[7]。但是,腹腔鏡手術由于二維平面圖像降低主刀醫師手眼間的協調性、腔鏡手術器械活動度有限,完成復雜手術學習曲線較長等因素,限制了其在結直腸癌肝轉移復雜手術中的應用[8-9]。達芬奇機器人手術系統創新性地為術者提供三維高清立體術野圖像,操作時手眼協調性更佳,相較于腹腔鏡手術更適合在空間有限的部位進行精細解剖、內鏡縫合及顯微吻合等操作,操作方式更接近開腹手術。因此,無腹腔鏡手術基礎的外科醫師更容易掌握,學習曲線更短。這些都在本研究中得到證實,機器人組的手術時間、術中出血量、輸血例數和中轉開腹率都顯著好于腹腔鏡組。相對于腹腔鏡,術者對機器人操作的熟練程度決定了手術時間的長短,隨著手術量的增加和操作器械的熟悉,手術時間大大縮短,這與Giulianotti等[10]報道的采用達芬奇機器人手術系統對伴有可切除肝轉移的結腸癌患者實施二期肝切除手術相符合。
對于肝臟7、8段和尾狀葉等部位的腫瘤,由于特殊的位置和彎曲的肝切面,腹腔鏡手術往往非常困難,通常需要擴大肝切除范圍或經胸腔入路甚至手輔助才能完成,這樣切除的正常肝臟往往很多[10-11]。雖然機器人手術系統超聲刀和腹腔鏡超聲刀一樣無法彎曲,但由于其靈活轉動的內腕可360°彎曲,完全可以垂直肝臟表面操作,分離縫合止血等精細操作可輕松完成。結合機器人專用超聲,術中采用內腕靈活控制超聲探頭,探查肝臟各個部位,做到腫瘤的精確定位和精準切除[12]。機器人系統擁有3 個機械臂,左右手都可靈活操作,且左右手器械可以隨時交換,比如可以左手雙極電凝,右手超聲刀,同時開弓,切肝過程出血少且迅速。我們采用2個機械臂加2個助手孔的方式,既能幫助術者準確穩定地顯露術野,又能減少機器人耗材使用,降低患者費用。機器人手術系統三維圖像的高清晰放大功能,能幫助術者肝切除時清晰地觀察到肝內管道走形,尤其在解剖肝門及肝后下腔靜脈時更具優勢,這樣既能保證預定切除肝臟區域的完全切除,達到腫瘤根治性,又可以避免損傷保留的血管和膽管組織,減少出血和膽漏。本研究24例順利完成機器人肝切除術,僅有1例中轉開腹,并且術中術后無嚴重并發癥發生,術后恢復快,證實對于結直腸癌肝轉移的二次手術,機器人肝切除安全有效。此外,患者經過機器人手術后不到兩周就可恢復正常體力,接受后續的化療等抗治腫瘤綜合治療,有助于縮短患者術后恢復等待時間,改善患者的治療效果,延長生存時間。
我們還總結了機器人肝切除的手術技巧:(1)手術入路—循肝蒂及肝靜脈入路微創解剖性肝切除:首先循肝蒂解剖,阻斷需要手術部位肝段相應的肝蒂,依據肝表面缺血線確定手術范圍;其次循肝靜脈解剖,暴露相關肝靜脈作為相應的解剖標記;最后在缺血線和肝靜脈走向中明確手術需要切除的范圍。(2)機器人Trocar數量、位置和取標本切口:術者應根據手術操作需要、不同體位等設計各Trocar的位置,確定鏡頭孔,1、2臂孔和助手孔,肝臟標本可由標本袋裝好后延長Trocar切口取出,既避免額外增加損傷,又減少腫瘤種植機會。
4 小結
本研究表明,對于結直腸肝轉移患者而言,機器人肝切除術安全可行,很多方面還優于腹腔鏡肝切除術,對復雜和特殊部位的肝切除具有一定優勢,有較好的圍手術期療效。雖然機器人肝切除術仍存在一定局限,如需要有豐富腹腔鏡手術經驗的助手、術者可使用的離斷手術器械較腹腔鏡或開腹手術少、費用較高昂等。但機器人手術時間短,中轉開腹率低,促進術后恢復,便于術后化療和可能改善預后,尤其適用于結直腸癌肝轉移的手術切除治療,為部分患者提供了較好的手術方案選擇。相信隨著新型手術機器人的研發,微創肝切除術有望發生質的突破。

