Toric IOL植入與角膜緣松解切開術矯正白內障低中度角膜散光的效果及安全性觀察
黃燕治,歐婷婷,吳瑜瑜
隨著醫學水平發展和患者對術后視功能要求的提升,白內障手術已逐漸演變為屈光性手術,摘除混濁晶狀體同時矯正角膜散光并控制手術源性散光(surgically induced astigmatism, SIA)對改善患者術后視力具有重要意義[1]。角膜切開術和散光矯正型人工晶狀體(toric intraocular lens, Toric IOL)植入均為現階段矯正角膜散光常用方法,對提升白內障術后視功能具有重要意義,其中角膜緣松解切開術(limbal relaxingincision, LRI)是角膜切開常用術式,操作簡單且經濟實用,尤其對低中度角膜散光(1.0~2.0 D)效果良好[2-4]。既往研究表明,Toric IOL植入可對1.0~4.5 D的散光進行矯正,LRI最高可以矯正約3 D的散光[5],但關于二者對低中度角膜散光治療效果的報道尚少。本研究主要分析Toric IOL植入和LRI對白內障患者低中度角膜散光的矯正效果和安全性,為臨床選擇合理手術方案提供更多循證醫學證據。
1 資料與方法
1.1一般資料 選取2016年1月—2020年1月我院行白內障超聲乳化及散光矯正治療患者90例(90眼)。納入標準:①完成白內障超聲乳化及散光矯正治療;②角膜規則散光1.0~2.0 D;③年齡18~80歲;④單眼患病;⑤Emery-Little分級Ⅰ~Ⅳ級;⑥術后完成6個月隨訪且臨床資料完整;⑦患者及家屬知曉本研究并簽署同意書。排除標準:①有其他眼部器質性疾病或病史;②伴眼內手術或外傷史;③角膜不規則散光或伴高度近視。90例根據手術方案不同分為兩組,其中觀察組38例(38眼),男17例,女21例;年齡43~79(61.85±9.27)歲;左眼17例,右眼21例;Emery-Little分級包括Ⅰ級8例、Ⅱ級13例、Ⅲ級15例及Ⅳ級2例。對照組52例(52眼),男28例,女24例;年齡41~78(62.14± 9.56)歲;左眼27例,右眼25例;Emery-Little分級包括Ⅰ級11例、Ⅱ級19例、Ⅲ級17例及Ⅳ級5例。兩組臨床資料比較差異無統計學意義(P>0.05),具有可比性。本研究經福建醫科大學附屬第二醫院醫學倫理委員會批準。
1.2研究方法 兩組入院后完善相關檢查并擇期手術。觀察組將術眼角膜曲率K1、K2及其軸位和眼軸長度等信息導入SRK/T公式計算人工晶狀體球鏡度數,然后綜合SIA等數據采用愛爾康公司在線計算器選擇Toric IOL型號和預設軸位。術前3 d給予妥布霉素滴眼液預防感染,每日3次,術前30 min予復方托吡卡胺滴眼液散瞳,每5 min 1次,至瞳孔直徑約8 mm后向結膜囊滴加聚維酮碘消毒30 s并以0.9%氯化鈉注射液沖洗,術前15 min采用0.5%丁卡因表面麻醉,在裂隙燈顯微鏡下根據術前標記的0°和180°軸位做手術切口和Toric IOL軸位標記,3 mm角膜緣內三階梯透明切口,5~6 mm連續環形撕囊,水分離后采用超聲乳化術粉碎并吸除晶狀體核,I/A系統吸除晶狀體皮質并拋光后囊膜,囊袋內填充黏彈劑,植入Toric IOL并順時針方向旋轉至距目標軸位10°~20°后徹底清除Toric IOL前后方黏彈劑,繼續調整Toric IOL軸位使其與術前預設軸位一致,輕壓光學部以確保Toric IOL貼附后囊,完成后重建前房并水密切口,術后第1日起采用妥布霉素滴眼液,每日4次,每5 d減量1次,至0次后停藥,同時每日睡前給予復方托吡卡胺滴眼液3~4次散瞳,每次間隔5 min,術后1個月復查無異常后停藥。
對照組術前在裂隙燈下采用Pentacam測量散光軸位并標記陡峭軸位置,根據每90° LRI矯正1.5 D角膜散光,將K值、SIA和隧道位置導入公式計算角膜緣松解切口,術前常規消毒鋪巾并以0.5%丁卡因表面麻醉,采用角膜散光定位環在角膜周邊血管拱內標記LRI切口弧長,設置角膜鉆石刀深度為周邊角膜厚度的90%,于角膜緣作2.8 mm切口,向前房內注入黏彈劑,5~6 mm連續環形撕囊,水分離和水分層后以超聲乳化術吸除晶狀體核,I/A系統吸除晶狀體皮質,后囊膜拋光后將人工晶狀體植入囊袋,清除黏彈劑,調整人工晶狀體并將其貼附后囊后水密切口,術后處理同觀察組。
1.3觀察指標 ①患眼視力:采用標準化最小分辨角對數(LogMAR)視力表檢查兩組術前和術后3個月時裸眼視力(UCVA)和最佳矯正視力(BCVA)。②角膜散光相關指標和SIA:采用Thibos矢量分析法[6]計算兩組術前和術后3個月時角膜散光相關指標,根據切口位置和K1、K2及其軸位采用在線計算機計算術后實際SIA。③眼前節參數:記錄兩組術前和術后3個月時散瞳前后眼壓(采用日本TOPCON公司生產的CT-800型非接觸式眼壓計測量)、前房容積(采用德國Oculus公司生產的Pentacam三維前房分析儀測量)以及中央區和切口區角膜厚度(采用德國Heidelberg公司生產的Spec-KT-06426型光學相干斷層掃描儀測量)變化情況。④角膜高階像差:采用Humphrey角膜地形圖儀測量并計算兩組術前及術后3個月時瞳孔6 mm范圍內彗差(Coma)、三葉草像差(Trefoil)及總高階像差(HOA)。⑤并發癥:記錄兩組術中及術后3個月并發癥發生率。
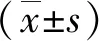
2 結果
2.1兩組手術前后UCVA和BCVA比較 術后3個月,兩組UCVA和BCVA較術前均明顯降低,且觀察組UCVA低于對照組,差異有統計學意義(P<0.01);但術后3個月兩組BCVA比較差異無統計學意義(P>0.05)。見表1。
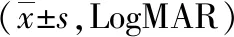
表1 不同方法治療的白內障低中度角膜散光兩組手術前后UCVA和BCVA比較
2.2兩組手術前后角膜散光比較 術后3個月,兩組角膜散光、CJ0和CJ45均較術前明顯降低,且觀察組角膜散光、CJ0和CJ45低于對照組,差異均有統計學意義(P<0.05或P<0.01)。見表2。
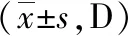
表2 不同方法治療的白內障低中度角膜散光兩組手術前后角膜散光比較
2.3兩組SIA比較 兩組術前預設SIA均為0.5 D,術后3個月時,兩組SIA分別為(0.56±0.14)D和(0.58±0.19)D,兩組比較差異無統計學意義(P>0.05)。
2.4兩組散瞳前眼前節參數比較 術后3個月,對照組散瞳前切口區角膜厚度較術前明顯增加(P<0.01),眼壓、前房容積及中央區角膜厚度較術前無明顯改變(P>0.05);觀察組手術前后上述指標比較差異均無統計學意義(P>0.05)。術后3個月對照組僅散瞳前切口區角膜厚度高于觀察組(P<0.01),余指標兩組間比較差異均無統計學意義(P>0.05)。見表3。
2.5兩組散瞳后眼前節參數比較 術后3個月,對照組散瞳后切口區角膜厚度較術前明顯增加(P<0.01),眼壓、前房容積及中央區角膜厚度較術前無明顯改變(P>0.05);觀察組手術前后上述指標比較差異均無統計學意義(P>0.05)。術后3個月對照組僅散瞳后切口區角膜厚度高于觀察組(P<0.01),余指標兩組間比較差異均無統計學意義(P>0.05)。見表4。
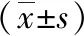
表3 不同方法治療的白內障低中度角膜散光兩組散瞳前眼前節參數比較
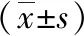
表4 不同方法治療的白內障低中度角膜散光兩組散瞳后眼前節參數比較
2.6兩組手術前后角膜高階像差比較 術后3個月,對照組Coma、Trefoil和HOA較術前明顯增加(P<0.01),觀察組Coma、Trefoil和HOA較術前未見明顯變化(P>0.05);且術后3個月時觀察組Coma、Trefoil和HOA均低于對照組,差異有統計學意義(P<0.05或P<0.01)。見表5。
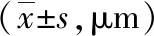
表5 不同方法治療的白內障低中度角膜散光兩組手術前后角膜高階像差比較
2.7兩組并發癥比較 兩組術中均未發生嚴重并發癥。觀察組術后3個月發生黃斑囊樣水腫1例(2.63%),給予抗炎治療1周后逐漸恢復。對照組術后3個月發生角膜上皮脫落1例,采用繃帶鏡治療2周后恢復正常,發生干眼癥2例,隨訪3個月時自行緩解,并發癥發生率為5.77%。兩組并發癥發生率比較差異無統計學意義(χ2=0.509,P=0.476)。
3 討論
白內障是臨床常見致盲性眼病,常見病因包括年齡相關退行性病變以及中毒或輻射等[7]。文獻報道全世界約2.85億人存在視力受損,其中盲人3900萬,且由白內障導致者占比為51%[8-9]。約95.2%的白內障患者術前合并角膜散光,27.5%散光度數≥1.25 D,有研究認為散光超過0.75 D即可引起視物模糊、重影或炫光等不適癥狀,對白內障患者術后視力恢復造成不利影響,因此角膜散光矯正逐漸成為白內障手術治療的重要組成部分[10-11]。
角膜切開術即在角膜緣不同位置作1個或多個切口來松解角膜,利用眼壓作用降低彈性應力方向角膜屈光度,同時提升垂直方向屈光度,從而減少角膜散光,隨著飛秒激光技術的快速發展和應用,術后矯正效果明顯提升且角膜相關并發癥也大幅度減少[12]。LRI矯正效果與切口數量、位置以及弧長等因素緊密相關[13]。Toric IOL取代普通人工晶狀體治療白內障合并角膜散光,在理論上較角膜切開術更為快捷和高效,一次手術即可同時解決兩種問題,且可根據散光程度選擇不同型號柱鏡,手術效果可預測性好,故有利于降低術后殘余散光,改善UCVA并提升脫鏡率[14]。本研究回顧性分析LRI和Toric IOL植入對白內障低中度角膜散光的矯正效果,結果顯示兩組術后3個月時UCVA和BCVA較術前均明顯降低,且觀察組UCVA低于對照組,表明LRI對UCVA的改善效果不及Toric IOL植入,但通過眼鏡等進行矯正可以達到彌補效果。同時本研究分析了兩組術后角膜散光情況,結果顯示術后3個月時兩組角膜散光、CJ0和CJ45較術前明顯降低,且觀察組角膜散光、CJ0和CJ45均明顯低于對照組,表明Toric IOL植入對白內障中低度角膜散光的改善效果具有明顯優勢。CJ0和CJ45為散光矢量分解結果,分別代表順逆方向散光和斜向散光[15]。SIA是影響散光矯正效果的重要原因,角膜切開與手術切口、是否縫線及超聲乳化等因素有關,而Toric IOL植入則主要受植入后散光軸位置與角膜最陡峭經線偏差影響[16-17]。本研究中對照組采用3 mm角膜緣內三階梯透明切口,而IOL組Toric IOL由疏水性丙烯酸酯材料制成,可與囊袋緊密貼附并防止Toric IOL旋轉,結果顯示兩組術前預計SIA為0.5 D,術后3個月兩組SIA比較未見明顯差異,產生此種結果的原因與SIA無關,因Toric IOL植入較LRI本身就有一定優勢,與既往文獻[18]報道結果一致。
Toric IOL植入和LRI兩種手術方案均需植入Toric IOL替代病變晶狀體,區別為Toric IOL植入兼有矯正散光的作用,無需再行角膜切口,術前即可根據患眼角膜曲率和軸位等數據選擇合適Toric IOL型號,植入后調整散光軸位與角膜最陡峭經線保持重合即可完全矯正角膜散光,因而效果更為穩定可靠,具有可預測性,且對眼壓、角膜厚度和眼房容積等參數影響較小[19]。本研究結果顯示,觀察組對散瞳前后眼壓、前房容積及中央區角膜厚度均無明顯影響,但對照組術后3個月時散瞳前后切口區角膜厚度明顯增加,其原因可能與角膜切口造成的炎性反應和增生有關,并可能對角膜散光矯正效果造成不利影響。另外本研究分析了兩組手術前后角膜高階像差變化情況,結果顯示對照組術后3個月時Coma、Trefoil和HOA較術前明顯增加,觀察組Coma、Trefoil和HOA較術前未見明顯變化。文獻報道角膜前表面像差較后表面像差高約3倍,LRI主要通過調節角膜前表面屈光度來矯正散光,因此切口數量、大小和位置均與Coma、Trefoil和HOA等參數緊密相關并對角膜散光矯正效果造成影響,進一步減少切口數量和大小有利于控制Coma、Trefoil和HOA增加,對提升手術效果具有積極作用[20]。本研究比較兩組術后并發癥顯示,觀察組術后3個月發生黃斑囊樣水腫1例,對照組術后發生角膜上皮脫落1例、干眼癥2例,均在隨訪期間恢復正常且未對手術效果造成不利影響,可見兩種手術方案已較為成熟,均具有良好安全性,可根據患者病情和醫療條件進行合理選擇。
綜上所述,Toric IOL植入和LRI兩種手術方案治療白內障低中度角膜散光均具有良好效果和安全性,但Toric IOL植入有利于減少切口對角膜厚度和高階像差的影響,UCVA和角膜散光改善效果較LRI更具優勢。

