神經生長因子對兔牙髓干細胞體外增殖、成骨分化影響的實驗研究
路曉淼,姜 晟,李孝亮,田瑞雪,劉姍姍,趙莉莉,張 凱
牙髓干細胞(dental pulp stem cells,DPSCs)是外胚層來源的干細胞,具有較高的細胞活性及多向分化潛能,因其取材豐富、易于培養等優點一直受到研究者的青睞。DPSCs可參與牙髓的修復與重建[1-2],具有高增殖、自我更新的能力,在適當的誘導下可以分化為脂肪組織、軟骨組織和神經組織等,因其高增殖率、高克隆潛力、高礦化潛力和較低的免疫原性,目前被認為是口腔醫學中骨組織工程的種子細胞[3-5]。
神經生長因子(nerve growth factor,NGF)是目前醫學上應用較為廣泛的外源性調節因子,具有營養神經和修復神經損傷等方面的作用[6-7],在傷害性感受器的功能調節中起關鍵作用。外源性NGF還可通過注射的方式補充內源性NGF的含量,避免其凋亡,保護受損的神經元[8]。本研究在前期的實驗研究中發現NGF可以在體外將骨髓間充質干細胞定向分化為軟骨并促進其向成骨方向分化,但 NGF對DPSCs 的影響機制尚不明確,且NGF聯合DPSCs用于種植體周圍是否能夠促進種植體早期骨結合也尚未可知。因此,本研究旨在探討NGF對兔DPSCs的增殖活性及成骨分化的影響,分析NGF和DPSCs的聯合應用對牙髓損傷的修復,以期為探索NGF和 DPSCs促進骨生成提供一定的依據和思路。
1 資料與方法
1.1 實驗動物、主要試劑與儀器 選取健康的新西蘭兔3只,3~4周齡,體質量1.5~2.0 kg,雌雄不限(由東方集團提供)。飼養環境:溫度(25±2)℃、濕度(60±5)%,動物生產許可證號SCXK(蘇)2015-0005。新西蘭兔于蚌埠醫學院科研中心適應性喂養1周后用于實驗。主要試劑:胎牛血清(FBS)(美國GIBCO公司)、DMEM培養液(美國Hyclone公司)、0.25% EDTA胰蛋白酶消化液(北京Solarbio公司)、青霉素-鏈霉素混合液(美國Hyclone公司)、Ⅰ型膠原酶(北京Solarbio公司)。儀器:細胞培養箱(德國Eppendorf公司)、離心機(上海盧湘儀)、倒置顯微鏡(上海蔡康光學)、超凈臺(蘇州德匯)、移液槍(北京康林)。
1.2 兔DPSCs的培養 在局麻環境下拔除兔前牙及前磨牙,放入三倍雙抗液中浸泡30 min,在超凈臺中用0.1 mmol/L的PBS溶液沖洗3次,用無菌拔髓針拔出牙髓組織,剪去距根尖1mm左右組織,余下牙髓組織剪成1 mm×1 mm×1 mm大小塊狀,置于15 mL離心管中。在離心管中加入3 g/L Collagenase-1和4 g/L分解酶各1 mL,混勻后置入37 ℃水浴中消化50 min,觀察細胞的消化情況。通過細胞篩網(孔徑200目)篩揀出未通過的組織塊,用0.1 mmol/L的PBS溶液沖洗3次,加入培養液后,置入CO2培養箱中,待細胞貼壁后,3 d換液一次。
1.3 細胞傳代 顯微鏡下觀察細胞形態的變化,瓶底的細胞鋪滿80%左右時,去除原培養液,用PBS溶液沖洗3次。加適量的胰蛋白酶,置于37 ℃的細胞培養箱中孵育3 min。后離心加入培養基,放入培養箱中培養,每隔3 d換一次液,在倒置顯微鏡下觀察細胞的生長,2~5代的細胞用于后續實驗。
1.4 DPSCs成骨分化能力的比較
1.4.1 實驗分組 將生長良好的第3代DPSCs設置為3組:空白組為純DPSCs組,含10%FBS,1%雙抗的DMEM高糖培養液;實驗組為DPSCs加NGF組,10%FBS,1%雙抗的DMEM高糖培養液加入100 μg/L的NGF;對照組為DPSCs加礦化液組,10%FBS,1%雙抗的DMEM高糖培養液加入10 mmol/L β-甘油磷酸鈉、100 nmol/L地塞米松、50 mg/L抗壞血酸。分別在7、14 d后收集細胞進行后續實驗。
1.4.2 細胞堿性磷酸酶(ALP)活性檢測 第3代DPSCs以5×104個/孔細胞接種于24孔板中,隨機分為3組,在培養7、14 d時各組取一個24孔板,用0.1 mmol/L PBS沖洗3次,490 nm 處酶標儀測吸光度值計算裂解液中ALP水平。
1.4.3 RT-qPCR檢測COL-1、Runx-2和OCN基因表達 取第三代細胞1×106個/孔接種于6孔板中分組培養,分別于培養7、14 d時提取細胞RNA,第一鏈cDNA模板通過逆轉錄試劑盒合成,以β-actin為內參對照,設置無模板陰性對照。PCR反應條件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 30 s,60 ℃ 30 s,40循環(引物序列見表1)。

表1PCR引物序列
1.5 統計學方法 采用t檢驗、方差分析和q檢驗。
2 結果
2.1 DPSCs組織形態學觀察 酶解組織法順利培養出兔DPSCs,2 d即可見周圍組織塊有細胞游出(見圖1),細胞呈集落生長,胞質均勻,形狀呈圓形。5~6 d后可匯合達80%,此時可進行再次傳代。實驗7、14 d時3組細胞形態見圖2。實驗7 d時,與空白組和對照組比較,實驗組細胞呈聚集性生長,梭形細胞逐漸向多角形分化;14 d時,實驗組細胞間隙增多,多角形改變更加明顯。
2.2 細胞ALP活性結果 實驗14 d時的空白組、實驗組和對照組的ALP活性值均高于7 d時的活性值(P<0.01);實驗7 d和14 d時3組間ALP活性值差異均有統計學意義(P<0.01),實驗組高于空白組(P<0.05),對照組高于實驗組(P<0.05)(見表2)。


2.3 3組兔DPSCs RT-qPCR結果 各組培養在7 d時實驗組中COL-1和OCN基因的表達值均高于空白組(P<0.05);培養14 d時實驗組中COL-1、Runx-2和OCN基因的表達值均高于空白組(P<0.05)(見表3~5)。
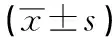
表2 空白組、實驗組和對照組7、14 d的ALP活性比較
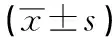
表3 兔DPSCs中COL-1基因表達情況
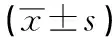
表4 兔DPSCs中Runx-2基因表達情況
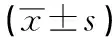
表5 兔DPSCs中OCN基因表達情況
3 討論
DPSCs具有成骨分化能力,而且其是存在于牙髓組織中的一類成體干細胞,具有高度自我更新能力和多向分化潛能,在口腔顱頜面部的缺損修復中具有一定的同源優越性。自 GRONTHOS等[11]成功從成人牙髓源性細胞中分離出間充質干細胞以來,DPSCs就開始在再生醫學的應用中發揮著重要的作用。
NGF是多種組織再生中的理想細胞因子,由于其潛在的成骨誘導作用,也讓其成為近期的研究熱點[12-13]。NGF是在1952年發現的第一個神經營養因子。早期研究證實了NGF是重要的神經營養蛋白,可以促進神經的再生、營養和發育[14]。相關研究[15-16]顯示NGF有很好的促進骨修復的作用,可以促進兔脛骨骨折部位的愈合,也能促進人體四肢骨的骨折愈合,使其愈合時間縮短。近期研究[17]顯示,NGF可在小鼠肋骨的骨折部位檢測到,2 d達到高峰值,說明NGF與骨的形成有關。
NGF可加速干細胞向成骨方向分化,因此,本研究擬在前期基礎上,通過ALP檢測、RT-qPCR等技術明確DPSCs體外在NGF作用下的成骨影響,研究結果,發現實驗組ALP水平明顯高于空白組,RT-qPCR結果顯示14 d時實驗組中COL-1、Runx-2和OCN基因的表達量均高于空白組,具有一定加速成骨向分化的作用。
綜上所述,本研究證實NGF體外能夠促進兔DPSCs向成骨向分化,縮短臨床種植骨結合修復的時間,為其運用到頜面部及種植體周圍骨缺損的修復提供新的視角和思路。

