Graves病患者外周血單個核細胞中環狀RNA表達譜分析
王雪華, 彭輝勇, 朱樟偉, 鄒君麗, 柳迎昭
(江蘇大學附屬人民醫院 1. 內分泌科; 2. 醫學檢驗科,江蘇 鎮江 212002)
Graves病(Graves′ disease,GD)又稱毒性彌漫性甲狀腺腫,是一種自身免疫性甲狀腺疾病,主要表現為游離三碘甲狀腺原氨酸(free triiodothyronine, FT3)和游離甲狀腺激素(free thyroxine, FT4)升高,促甲狀腺激素(thyroid stimulating hormone, TSH)下降,其致病抗體主要為促甲狀腺激素受體抗體(TSH receptor autoantibody, TRAb)[1]。Graves病是甲狀腺功能亢進的主要原因,約占甲狀腺功能亢進的85%,甲狀腺功能亢進可進一步引起甲狀腺毒性周期性癱瘓、心血管系統疾病、卵巢早衰等[2-5]。為了實現Graves病的早期診斷和及時治療,有必要進一步探索新型生物標志物。環狀RNA(circular RNA,circRNA)是一類缺少5′帽和3′尾的封閉環狀非編碼RNA,具有廣泛性、保守性、穩定性等特征。1979年,Hsu和Coca-Prados首次通過電子顯微鏡觀察到真核生物細胞質中的circRNA,早期研究認為circRNA是剪接的副產物[6],隨著高通量測序技術的發展,人們認識到其在多種生物學活動及疾病的發生發展中發揮重要作用[7]。然而,其在Graves病中的作用尚不清楚。本研究利用二代高通量測序技術對Graves病患者外周血單個核細胞(peripheral blood mononuclear cells,PBMCs)中circRNA的表達譜進行分析,探討差異表達的circRNA的生物學功能及其潛在診斷價值,為進一步研究circRNA在Graves病中的作用提供新的視角。
1 對象與方法
1.1 研究對象
選取2020年7月至11月江蘇大學附屬人民醫院內分泌科診治的5例Graves病患者(GD組)和體檢中心5例健康對照者用于二代高通量測序;另選取40例Graves病患者(GD組)和40例健康對照者用于驗證差異表達的circRNA。Graves病納入標準:① 臨床甲亢癥狀和體征;② 甲狀腺彌漫性腫大(通過觸診和B超證實),少數病例可以無甲狀腺腫大;③ 血清TSH濃度降低,甲狀腺激素濃度升高;④ 血清TRAb或甲狀腺刺激性抗體(thyroid stimulating antibody, TSAb)陽性;⑤ 甲狀腺攝碘率增加(排除一過性甲亢);⑥ 眼球突出和其他浸潤性眼征;⑦ 脛前黏液性水腫。其中,①②③④⑤項為診斷必備條件。健康對照組需滿足年齡和性別匹配、甲狀腺功能正常。所有納入病例需同時滿足血常規結果正常,無嚴重感染、腫瘤、其他自身免疫性疾病,近期未服用可能影響甲狀腺功能的藥物,年齡在20~60歲,GD組40例患者和40例對照組受試者信息統計見表1。本研究經江蘇大學附屬人民醫院倫理委員會批準,所有研究對象均簽署知情同意書。
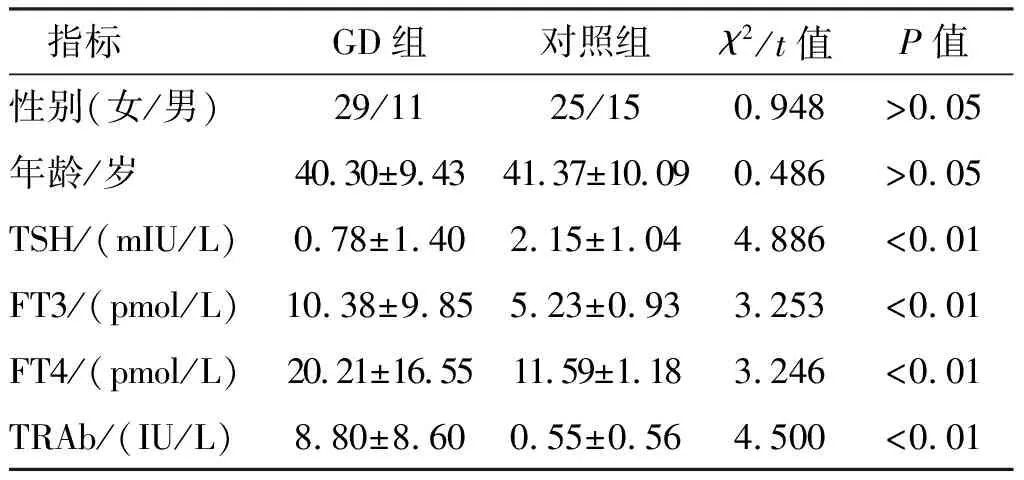
表1 GD組40例和對照組40例主要臨床資料統計
1.2 高通量測序分析Graves病患者PBMCs中circRNA表達譜
1.2.1 PBMCs分離與總RNA提取 使用EDTA-K2管采集5例Graves病患者和5例健康對照者外周血樣品,離心后將上層血漿收集到1.5 mL EP管中,并放入-80℃冰箱中保存備用,剩余抗凝血用Ficoll-Hypaque人淋巴細胞分離液分離PBMCs,按照ES Science?RNA快速提取試劑盒說明書抽提RNA,采用NanoDrop?ND-1000 紫外分光光度計檢測RNA濃度和純度。利用1%瓊脂糖凝膠電泳檢測RNA的完整性。
1.2.2 高通量測序 將上述RNA樣本進行高通量測序,測序由上海云序生物技術有限公司完成。文庫質量控制和定量使用BioAnalyzer 2100儀器(美國Agilent Technologies公司)進行。總RNA中的rRNA通過核糖體RNA去除試劑盒(美國Illumina公司)完成。根據Illumina測序說明,將10 pmol文庫變性為單鏈DNA分子,將其捕獲到Illumina Flowcell上并原位擴增為簇。使用雙端PE模式在Illumina Hiseq測序儀上進行150個循環測序。circRNA的對比鑒定通過STAR軟件(v2.5.1b)完成,并經DCC軟件(v0.4.4)對circRNA進行檢測和鑒定。差異表達的circRNA篩選通過edgeR軟件(v3.16.5)進行,火山圖、散點圖分析差異表達的circRNA。
1.3 qRT-PCR驗證差異表達的circRNA
根據差異倍數(≥2)、P值(≤0.05)、在測序樣本中平均分布的程度以及circRNA潛在靶基因與Graves病可能的關聯等條件,篩選出6個circRNA,驗證是否與高通量測序結果一致。選取40例Graves病患者和40例健康對照者并分離PBMCs,按照ES Science?RNA快速提取試劑盒提取RNA后,使用RNA逆轉錄試劑盒(日本TaKaRa公司)合成cDNA。采用TB GreenTMPremix EXTaqTM(日本TaKaRa公司)試劑盒制備qRT-PCR反應混合物。qRT-PCR擴增條件:95 ℃初始變性30 s;95 ℃ 5 s,60 ℃ 34 s;進行40個循環。qRT-PCR的引物序列見表2,使用β-肌動蛋白作為內參。結果由Applied Biosystems 7500儀器分析,采用2-△CT值計算circRNA的相對表達量。
1.4 預測circRNA可能靶向的miRNA及分析生物學功能
根據context+分數、與circRNA結合的緊密程度以及文獻報道可能與Graves病發病相關的miRNA等條件,結合CircInteractome數據庫,每個差異表達的circRNA篩選10個最可能與之結合的miRNA,最后對差異表達的circRNA進行GO富集分析和KEGG信號通路分析,分析潛在的生物學功能。
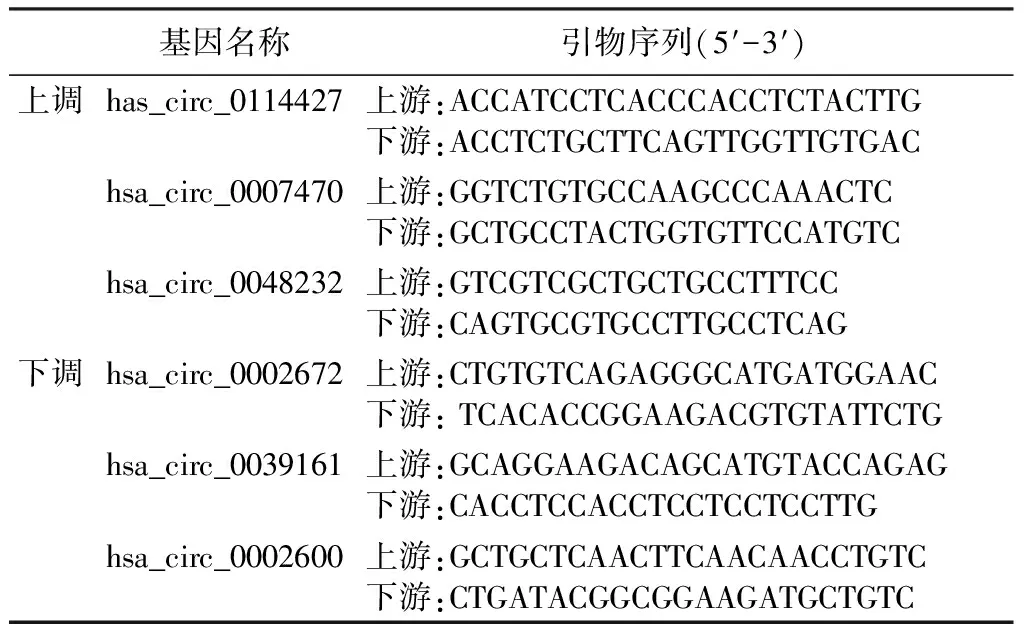
表2 qRT-PCR引物序列
1.5 統計學分析
2 結果
2.1 Graves病患者PBMCs中circRNA表達譜
高通量測序檢測Graves病中的circRNA表達譜,分層聚類分析結果顯示,GD組患者和健康對照者PBMCs中circRNA表達譜具有明顯差異(圖1A)。根據差異倍數變化和P值繪制火山圖(圖1B)和散點圖(圖1C)結果顯示,與健康對照者相比,Graves病患者PBMCs中共有36 910個circRNA差異表達,包含23 215個上調和13 695個下調,其中顯著差異表達(差異倍數≥2,P≤0.05)的有669個,包括360個上調的circRNA和309個下調的circRNA。根據circRNA在基因組中的位置,將circRNA分為5類(圖1D):① 外顯子circRNA,占63.49%(23 433/36 910);② 內含子circRNA,占16.70%(6 165/36 910);③ 外顯子-內含子circRNA,占18.06%(6 665/36 910);④ 反義circRNA,占0.71%(263/36 910);⑤ 基因間circRNA,占1.04%(384/36 910)。
2.2 差異表達的circRNA驗證結果
選取差異倍數改變最明顯的3個上調circRNA(has_circ_0114427、hsa_circ_0007470、hsa_circ_004 8232)和3個下調circRNA(hsa_circ_0002672、hsa_circ_0039161、hsa_circ_0002600)進行qRT-PCR驗證。結果見圖2,GD組has_circ_0114427、hsa_circ_0007470、hsa_circ_0048232表達較對照組明顯上調,hsa_circ_0002672表達明顯下調,與高通量測序結果一致;兩組間hsa_circ_0039161和hsa_circ_0002600表達無明顯差異。
2.3 miRNA結合位點預測
根據CircInteractome數據庫預測可能與差異表達circRNA相結合的miRNA,列出與差異表達circRNA最有可能結合的前10位miRNA,見圖3。
2.4 差異表達circRNA 的GO分析和KEGG分析
由于篩選驗證的6個circRNA中,3個上調的has_circ_0114427、hsa_circ_0007470、hsa_circ_0048232和1個下調的hsa_circ_0002672符合高通量測序結果。因此,我們著重分析了上調circRNA 前10位GO富集條目和KEGG信號通路。GO分析發現,生物學過程、細胞成分和分子功能中最豐富的GO條目分別是高分子代謝、細胞內膜結合細胞器和轉移酶激活。KEGG分析顯示,差異表達的circRNA可能參與甲狀腺激素信號、磷脂酰肌醇信號系統、非小細胞肺癌等相關信號通路。見圖4。
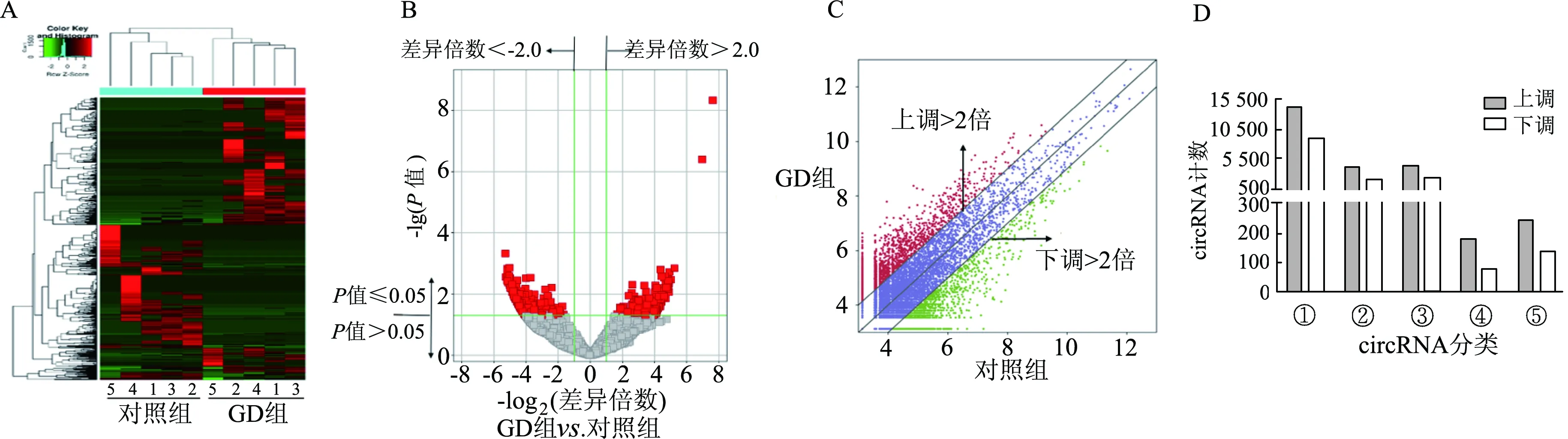
(A) circRNA分層聚類圖:每行代表circRNA,每列代表GD組或對照組標本;紅色代表上調circRNA,綠色代表下調circRNA。(B) circRNA火山圖:紅色方塊代表差異顯著表達的circRNA,灰色方塊代表無統計學意義的circRNA。(C) 差異表達circRNA散點圖:紅色代表上調circRNA,綠色代表下調circRNA,中間藍色代表無統計學意義的circRNA。(D) circRNA分類統計圖:①:外顯子circRNA;②:內含子circRNA;③:外顯子-內含子circRNA;④:反義circRNA;⑤:基因間circRNA
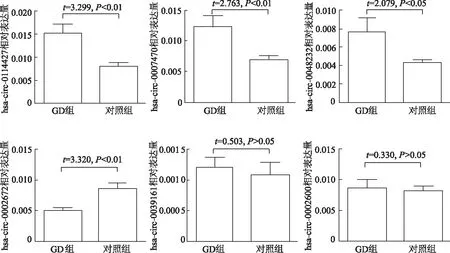
圖2 qRT-PCR驗證差異表達的circRNA
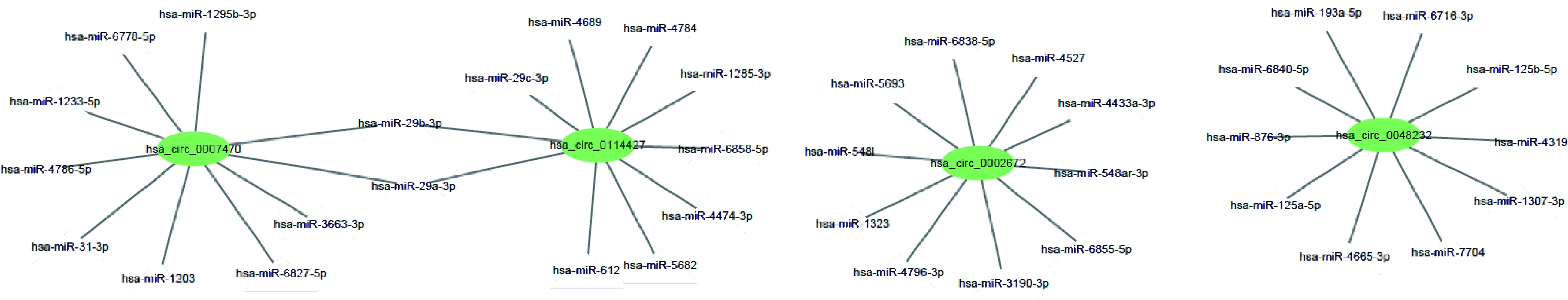
圖3 差異表達circRNA的潛在結合miRNA預測

圖4 差異表達circRNA的GO富集分析和KEGG信號通路分析
2.5 ROC曲線分析
對驗證具有統計學意義的has_circ_0114427、hsa_circ_0007470、hsa_circ_0048232和hsa_circ_0002672進行ROC 曲線分析(圖5),結果顯示has_circ_0114427曲線下面積最大(0.775 6), 故hsa_circ_0114427具有作為Graves病診斷分子標志物的潛能。
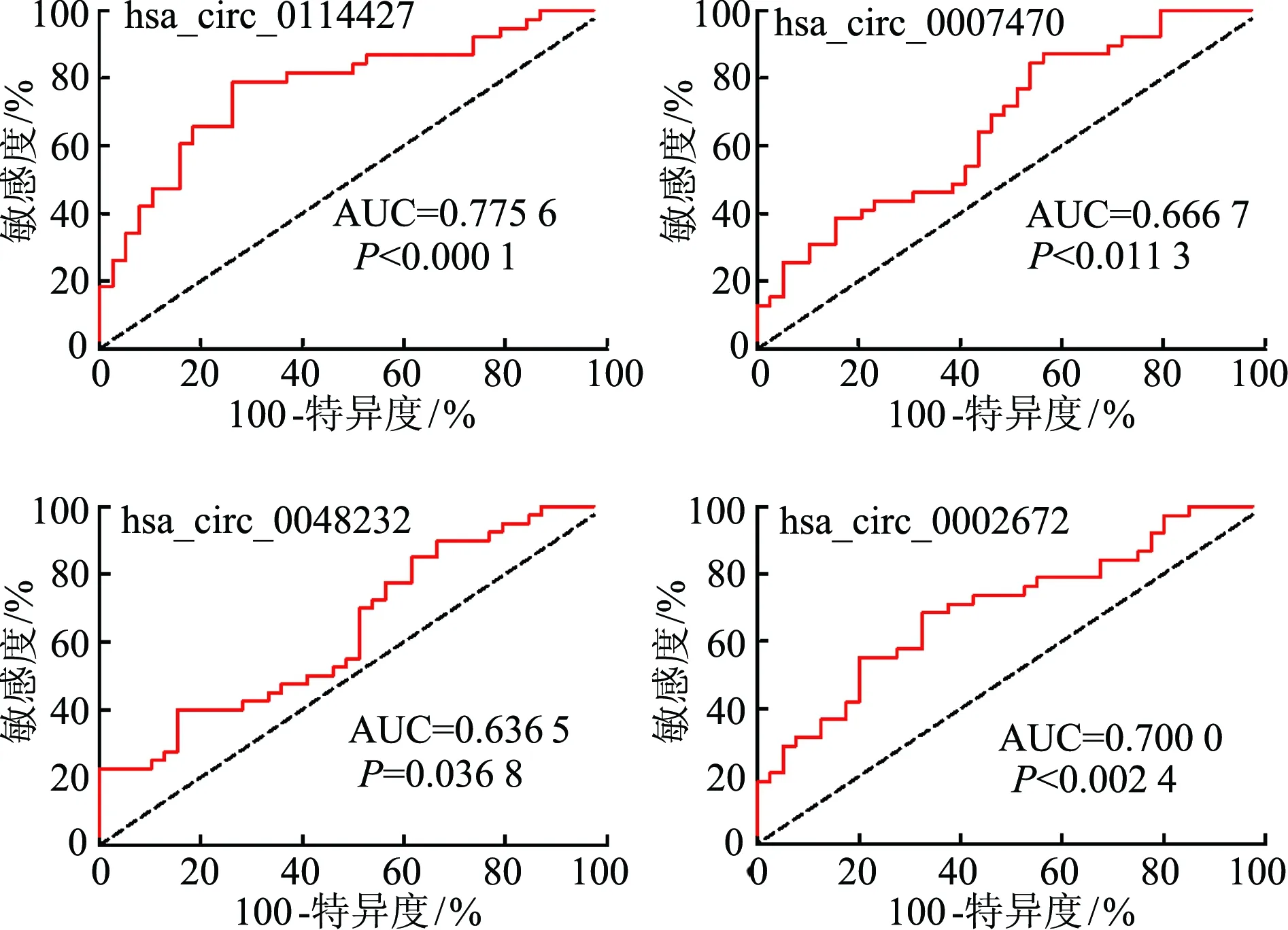
圖5 篩選驗證的circRNA ROC曲線分析
3 討論
Graves病的發病率逐年增加,女性發病率達3%左右,為男性的4~6倍,其臨床表現涉及多個系統,主要癥狀有易激動、心悸、失眠、食欲亢進等,嚴重者發生甲亢危象、甲狀腺毒癥性心臟病等并發癥[8]。其免疫學機制可能涉及CD4+/CD8+T細胞失衡。據報道,Th1細胞的相關細胞因子IFN-γ可影響甲狀腺細胞分泌趨化因子配體10(CXCL-10),CXCL-10具有將CD8+和CD4+效應T細胞吸引到炎癥部位,誘導T細胞極化并增強T細胞依賴性炎癥反應的能力[9-10]。Th17/Treg細胞比例的失衡可能刺激TSAb的產生并導致Graves病的發生,有研究發現經過他巴唑治療后Th17/Treg細胞比例下降[11-13]。因此,探究Graves病發病的分子機制,可為尋找Graves病的早期生物標志物提供幫助。
從基因組學的角度來看,編碼RNA僅占人體的2%,而大多數基因都屬于非編碼RNA[14],因此,越來越多的研究人員致力于非編碼RNA的研究。作為非編碼RNA,circRNA在細胞內、血清、血漿、外泌體中穩定存在,具有廣泛性、保守性和穩定性等特征,不易被核酸外切酶降解。circRNA在胰腺癌[15]及自身免疫性疾病中[16-18]已有相關報道。 Su等[19]研究發現circRNA-Cdr1as可以作為競爭性內源RNA通過過表達促進肝癌細胞的增殖和遷移。Liu等[20]在系統性紅斑狼瘡的研究中發現,在聚肌苷酸胞苷酸刺激或病毒感染時,PBMCs或者T細胞中含雙鏈RNA的circRNA過表達可以緩解異常的蛋白激酶激活級聯反應。組織、血液和外泌體中的circRNA表達失調對疾病的早期診斷、治療效果評估和預后監測等方面具備較好的研究價值[21]。但是,circRNA與Graves病相關報道較少,仍有待深入研究。
本研究利用高通量測序技術對Graves病患者PBMC中circRNA表達譜進行測序并分析。共檢出36 910個差異表達的circRNA,絕大部分來源于外顯子,其中有360個上調和309個下調circRNA表達具有顯著差異性。另外,在所有檢測出的circRNA中,有18 519個circRNA是新發現的,說明circRNA在Graves病中有更大的研究空間。因為高通量測序可能存在假陽性結果,本研究選擇其中6個circRNA進行驗證,結果表明Graves病患者中hsa_circ_0114427、hsa_circ_0007470、hsa_circ_0048232表達明顯升高,hsa_circ_0002672表達明顯降低,該結果與高通量測序結果一致,而兩組間的hsa_circ_0039161和hsa_circ_0002600表達無明顯差異。circRNA-miRNA結合位點預測結果中, miR-29a-3p、miR-29b-3p、miR-29c-3p有可能通過調控可誘導共刺激分子(inducible costimulator,ICOS)影響濾泡輔助性T細胞(follicular helper T cell, Tfh)的變化,miR-125a-5p、miR-125b-5p有可能通過調控靶基因CXCR5影響Tfh細胞的變化,Tfh細胞可能參與Graves病的發病過程[22]。GO分析和KEGG分析顯示,差異表達的circRNA可能涉及甲狀腺激素信號、磷脂酰肌醇信號系統、非小細胞肺癌等相關信號通路,其中甲狀腺激素信號通路中PI3K/AKT通路已被證實參與Graves病的發病過程[23]。ROC曲線分析顯示,hsa_circ_0114427具有較大曲線下面積,表明其具有作為Graves病生物標志物的潛在價值。
綜上所述,本研究通過高通量測序技術探究了Graves病患者PBMCs中circRNA的表達譜,并擴大樣本量驗證了差異表達的circRNA;對差異表達的circRNA進行GO分析和KEGG分析結果表明,Graves中差異表達的circRNA可能參與甲狀腺信號通路;has_circ_0114427可能與Graves病的發生發展有關。但是,本研究納入的樣本量較少,結果可能存在偶然性,需要擴大樣本量進一步驗證。

