Fe3+抑制醋酸棉酚對腦膠質瘤細胞的殺傷作用
黃雪陽,楊夢婷,房文靜,龔愛華
(江蘇大學醫學院,江蘇 鎮江 212013)
腦膠質瘤呈浸潤性生長,侵襲性強,極易復發,預后差,嚴重影響患者生存期及生存質量[1]。當前對于腦膠質瘤的治療手段以手術結合術后放療和化療為主,但效果有限[2]。前期研究表明,醋酸棉酚(gossypol, GAA)能誘導細胞自噬性死亡及促進腫瘤細胞凋亡[3]。然而臨床研究表明,GAA在復發性膠質瘤患者中顯示出低但可測量的緩解率[4],療效不及預期,其具體原因尚未闡明。
低氧、高滲是腫瘤微環境的重要特征,其中Fe3+在腦膠質瘤微環境中處于較高水平。相較于正常細胞,癌細胞對Fe3+需求量更高[5-6]。有報道稱GAA具有較好的螯合Fe3+的能力[7],由此推測腫瘤微環境中的Fe3+可能通過與GAA結合發揮作用,但Fe3+是否能夠抑制GAA對腦膠質瘤的殺傷作用尚不清楚。因此,本研究擬探討Fe3+對GAA殺傷人腦膠質瘤細胞作用的影響。
1 材料與方法
1.1 生物信息學分析
通過Cancer Brower下載TCGA數據庫中膠質瘤患者mRNA表達及臨床相關數據,分析轉鐵蛋白受體c(transferrin receptor c, TFRC) mRNA在健康者與腦膠質瘤患者中的表達水平。以平均值為界,將高于和低于平均值分別定義為高表達組和低表達組。
利用基因表達譜在線分析平臺GEPIA(http://gepia.cancer-pku.cn/)分析TFRC與腦膠質瘤患者生存的相關性。數據篩選條件:“Gene:TFRC”;“Analysis Type:Survival”;“Datesets Selection:GBM and LGG”。
1.2 細胞及試劑
人腦膠質瘤LN229、SW1783、U87MG、U251MG細胞株購于中國科學院上海生命科學研究院;GAA(上海生工生物公司);FeCl3·6H2O(上海Aladdin公司);高糖DMEM(美國Hyclone公司);澳洲胎牛血清(美國Gibco公司);Transwell小室(美國Coming Incorporated公司);CCK-8試劑盒(南京諾唯贊公司);Annexin V-FITC細胞凋亡檢測試劑盒(上海碧云天公司)。
1.3 細胞培養
配制含有10%胎牛血清的高糖DMEM;各膠質瘤細胞株均使用上述培養基且放置于37 ℃,5% CO2及飽和濕度的恒溫細胞培養箱中常規培養;生長密度達70%~90%時,用0.25%含EDTA的胰蛋白酶進行消化處理。
1.4 計算GAA在不同人腦膠質瘤細胞中的半數作用濃度(IC50)
將人腦膠質瘤LN229、SW1783、U87MG、U251MG細胞按每孔2×103個細胞接種于96孔板,將高濃度GAA儲存液用高糖DMEM逐步稀釋為0、5、10、15、20、25 μmol/L,每孔分別加入100 μL GAA,于培養箱中孵育72 h;棄上清液,加入CCK-8工作液檢測各孔450 nm波長處光密度(D)值,計算細胞活性。重復實驗3次。利用GraphPad 6.0軟件計算在不同腦膠質瘤細胞中GAA的IC50作為后續實驗濃度。
1.5 細胞實驗及相關指標檢測
1.5.1 細胞分組及處理 將4種人腦膠質瘤細胞各分為對照組,Fe3+組,GAA組,Fe3++GAA組,分別予以培養基,FeCl3·6H2O,GAA,FeCl3·6H2O+ GAA處理。GAA濃度以各膠質瘤細胞IC50為準,FeCl3·6H2O濃度與GAA濃度相同。
1.5.2 CCK-8法檢測細胞增殖率 取2×103個人腦膠質瘤細胞接種于96孔板,每組設立3個復孔,每孔中加入100 μL培養基,于細胞培養箱中培養過夜。次日細胞貼壁,按上述分組處理細胞,于培養箱孵育72 h,避光條件下按照無血清DMEM ∶CCK-8試劑為9 ∶1的比例配制CCK-8工作溶液,每孔加入100 μL工作溶液,并設立 3個空白復孔(無細胞)加入配置好的CCK-8工作液行D值校正;繼續孵育1~2 h,用酶標儀檢測450 nm波長處各孔D值。檢測細胞每日增殖情況,連續6 d在同一時間點檢測。細胞活性(%)=(D實驗組-D空白組)/(D對照組-D空白組)×100%。
1.5.3 Transwell實驗檢測細胞遷移能力 取對數生長期膠質瘤細胞均勻接種于6孔板,次日細胞貼壁按上述分組處理細胞48 h。取24孔板,將Transwell小室放置于24孔板中,小室底部24孔板內加入500 μL含10%胎牛血清的高糖培養基,用無血清DMEM將6×104個細胞重懸稀釋至200 μL加入小室上層。培養箱中培養14~16 h;棄培養基,PBS清洗1次,加入4%多聚甲醛,室溫固定30 min;PBS洗滌,加入0.1%結晶紫染色30 min;PBS洗滌2~3次,將剩余染液甩干,用棉簽輕輕抹去小室內側未穿透的細胞及多余液體;于顯微鏡10倍鏡下拍照,運用Image J軟件進行細胞計數。實驗重復3次。
1.5.4 流式細胞術分析細胞凋亡水平 選取LN229、U251MG細胞,按上述分組處理細胞48 h,收集各組細胞上清液,PBS洗滌剩余貼壁細胞,用不含EDTA的胰酶消化液消化細胞,于培養箱中溫育1~2 min;加入已收集的細胞上清液終止消化,收集細胞,1 000×g,離心5 min;棄上清液,PBS重懸計數1×105膠質瘤細胞,重復上述離心,棄上清液,加入195 μL Annexin V-FITC結合液,吹散細胞團塊,再加入5 μL Annexin V-FITC,吹打混勻;加入10 μL碘化丙啶染色液,吹打混勻;避光室溫孵育10~20 min;流式細胞儀檢測各組細胞凋亡水平,用FlowJo V10軟件對流式數據進行分析。
1.6 統計學分析
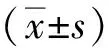
2 結果
2.1 TFRC在膠質瘤中的表達與生存分析
在TCGA腦膠質瘤數據庫中記錄有腦組織樣本370例,其中腦膠質瘤患者163例,健康對照者207例。與健康對照者相比,腦膠質瘤患者組織中TFRCmRNA表達水平顯著增高(P<0.05),提示腦膠質瘤中Fe3+富集。另通過GEPIA數據庫分析可知,TFRC高表達組膠質瘤患者總體生存率明顯低于低表達組(P<0.05)。見圖1。

圖1 TFRC在腦膠質瘤中表達情況與患者生存分析
2.2 GAA抑制腦膠質瘤細胞增殖
CCK-8結果顯示,與0 μmol/L相比,10、15、20、25 μmol/L GAA組LN229、SW1783、U251MG細胞存活率明顯降低(P均<0.05);15、20、25 μmol/L GAA組U87MG細胞存活率明顯降低(P均<0.05)。通過GraphPad Prism計算得出LN229、SW1783、U87MG、U251MG細胞的IC50分別為9.38 μmol/L、9.56 μmol/L、14.53 μmol/L和10.39 μmol/L。見圖2。

*:P<0.05,與0 μmol/L GAA組相比
2.3 Fe3+促進GAA處理條件下膠質瘤細胞增殖
結果顯示,在LN229、SW1783、U87MG、U251MG 4種腦膠質瘤細胞中,與對照組相比,GAA組細胞相對增殖率均顯著降低(t分別為72.28、193.03、114.35、290.04,P均<0.05);而與GAA組相比,Fe3++GAA組腦膠質瘤細胞增殖率明顯升高(t分別為51.57、46.17、40.60、9.14,P均<0.05)。見圖3。由此表明,Fe3+可逆轉GAA引起的腦膠質瘤細胞死亡。
CCK-8結果表明,與對照組相比,GAA組SW1783和U87MG膠質瘤細胞在3~6 d時,另外兩種細胞在4~6 d時細胞相對增殖率顯著降低(P均<0.05);而與GAA組相比,Fe3++GAA組細胞相對增殖率顯著升高(P<0.05),Fe3+對于GAA殺傷膠質瘤細胞的逆轉效果并未隨著時間的延長而有所降低(P均<0.05)。由此可見,Fe3+可使腦膠質瘤細胞持續抵抗GAA的殺傷。見圖4。

*:P<0.05,與對照組相比;#:P<0.05,與GAA組相比

*:P<0.05,與對照組相比;#:P<0.05,與GAA組相比
2.4 Fe3+促進GAA處理條件下膠質瘤細胞遷移
Transwell結果顯示,在LN229、SW1783、U87MG、U251MG 4種腦膠質瘤細胞中,與對照組相比,GAA組細胞遷移數量顯著降低(P均<0.05);但與GAA組相比,Fe3++GAA組的腦膠質瘤細胞遷移數量則顯著增多(P均<0.05)。見圖5。

*:P<0.05,與對照組相比;#:P<0.05,與GAA組相比
2.5 Fe3+抑制GAA引起的膠質瘤細胞凋亡
流式細胞術結果顯示,與對照組相比,GAA組腦膠質瘤細胞凋亡率明顯增加(LN229:t=15.73,U251MG:t=42.69;P均<0.05);與GAA組相比,Fe3++GAA組腦膠質瘤細胞凋亡率明顯降低(LN229:t=13.29,U251MG:t=45.16;P均<0.05)。見圖6。

*:P<0.05,與對照組相比;#:P<0.05,與GAA組相比
3 討論
研究揭示,68Ga-citrate(一種Fe3+仿生藥)可以以遠高于正常組織的倍數在U87MG皮下瘤中蓄積[8]。在高級別腦膠質瘤中,更易因為病理血管的小出血導致腫瘤內或腫瘤周圍的Fe3+水平升高[9]。本研究生物信息學研究結果與其相一致,腦膠質瘤組織中TFRCmRNA表達水平顯著高于正常腦組織,且TFRC高表達組膠質瘤患者總體生存率明顯低于低表達組。Fe3+在血清中與轉鐵蛋白結合,經細胞膜TFRC識別。在核內體的酸性環境條件下,Fe3+經前列腺六次跨膜蛋白(STEAP)還原酶還原成 Fe2+,通過二價金屬轉運體1從核內體轉出,釋放至不穩定鐵池中[10]。TFRC作為Fe3+轉運過程中所必需的受體蛋白,其高表達提示腦膠質瘤微環境中Fe3+的高含量,由此表明Fe3+過載可能與腦膠質瘤的不良預后相關。
體外實驗研究發現,GAA可以有效殺傷對于一線化療藥物替莫唑胺耐藥的腦膠質瘤細胞[11]。本研究結果表明,GAA對于4種腦膠質瘤細胞均能發揮殺傷作用且呈濃度依賴性。然而GAA在二期臨床試驗中療效卻不如預期[4],造成體內外結果差異的具體原因尚未得以闡釋。本研究結果證實,在4種腦膠質瘤細胞中加入外源性Fe3+處理72 h明顯促進GAA處理的細胞增殖、遷移能力。進一步將實驗時間延長至6 d,Fe3+對腦膠質瘤細胞對于GAA耐藥具有持續且顯著的促進作用。這或許可以從一定程度上解釋腦膠質瘤細胞對于GAA耐藥的原因,但其具體機制還有待于進一步闡明。
早期研究證明,GAA作為BH3類似物能夠與BCL2上的BH3結合域結合,降低BCL2的表達,誘導細胞凋亡[12-13]。本研究選用前神經型腦膠質瘤U251MG細胞及間質型腦膠質瘤LN229細胞驗證了GAA可以通過誘導腦膠質瘤細胞凋亡來發揮其殺傷作用,GAA與Fe3+聯用后細胞凋亡水平降低,因此初步推測Fe3+通過與GAA 結合,從而阻止GAA與 BCL2結合,保證BCL2抗凋亡功能,促進腫瘤細胞抗凋亡。
綜上所述,腦膠質瘤微環境中的Fe3+可能通過結合GAA介導腦膠質瘤細胞的化療耐藥,但具體機制還需要進一步探究。本研究或許可以為腦膠質瘤的臨床治療提供潛在的治療方案,如將GAA與鐵離子螯合劑聯用以消除Fe3+對于GAA藥物敏感性的影響等。

