非諾貝特聯合雙環醇治療非酒精性脂肪性肝病患者肝組織PPARγ2 mRNA水平變化*
李 釗,黃贊松,李 繁
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)為飲酒以外的多種原因所致的肝臟脂肪堆積,表現為慢性肝組織脂肪沉積和慢性炎癥等脂質代謝紊亂的一系列臨床和病理學綜合征[1]。目前,針對NAFLD尚無特效的療法。雙環醇為聯苯雙酯結構類似物,既往研究[2]顯示其可清除自由基、避免肝細胞核DNA受損、維持肝細胞膜穩定性,進而避免肝細胞凋亡,為臨床常用的護肝藥物,但其對NAFLD患者肝細胞內脂質蓄積的改善作用不強。非諾貝特為第三代苯氧乙酸類調血脂藥物,可抑制膽固醇吸收及其體內合成,并促進其轉運,廣泛應用于處理高血脂和高血糖,發現其能調節機體的血脂代謝紊亂[3,4]。非諾貝特能誘導脂肪酸氧化、維持胰島素敏感性,其作用與核受體轉錄因子過氧化物酶體增殖物激活受體(peroxisome proliferators-activated receptors, PPARs)有關[5]。PPARs gamma 2(PPAR-γ2)是PPARs的亞型之一,可調節脂肪細胞增殖分化和脂肪代謝。本研究應用非諾貝特聯合雙環醇治療NAFLD患者,觀察了療效及肝組織PPARγ2水平的變化,現報道如下。
1 資料與方法
1.1 一般資料 2018年2月~2019年12月我院收治的NAFLD患者66例,男34例,女32例;年齡32~71歲,平均年齡為(53.4±5.7)歲;病程0.5~11年,平均為(6.2±1.8)年;體質指數(body mass index,BMI)為20.2~31.5 kg/m2,平均為(26.3±2.2)kg/m2。符合《非酒精性脂肪性肝病診療指南》[6]的診斷標準,合并腹型肥胖50例。排除標準:女性飲酒乙醇攝入量>70 g/周,男性乙醇攝入量>140 g/周,排除病毒性肝炎、藥物性肝損傷、肝豆狀核變性、自身免疫性疾病、伴有嚴重的感染、合并貧血、存在肝臟手術史、濫用藥物或毒品史、入組前2月內接受過益生菌或調脂降糖藥物治療、對雙環醇或非諾貝特過敏。采用隨機數字表法將患者分成兩組,每組33例,兩組性別、年齡、病程、BMI和合并腹型肥胖等一般資料比較無統計學差異(P>0.05),具有可比性。本研究方案已經獲得我院醫學倫理委員會審核批準,患者簽署知情同意書。
1.2 治療方法 兩組均控制飲食,避免高熱量高蛋白食物攝入,禁煙酒,進行適當體育鍛煉,保持血糖和血壓平穩。在對照組,給予雙環醇片(北京協和藥廠,國藥準字H20051712)50 mg口服,3次/d;觀察組在對照組治療的基礎上給予非諾貝特片(迪沙藥業集團有限公司,國藥準字H37022898)0.1口服,1次/d。兩組均持續用藥3個月。
1.3 肝組織PPARγ2mRNA檢測 常規肝穿刺,取得肝組織。采用Trizol試劑(Invitrogen公司)提取肝組織總RNA,使用M-MLV逆轉錄酶(美國Promega公司)合成cDNA,采用熒光定量聚合酶鏈式反應檢測PPARγ2mRNA,經內參基因進行校正后獲得其相對水平(PPAR-γ2總拷貝/GAPDH總拷貝)。采用熒光定量聚合酶鏈式反應檢測PPARγ2mRNA,上游引物序列為5′-ATTTTCTGGAGAGCT-TGGC-3′,下游引物序列為5′-GT-GAGGGTCTCTCTCTTCCT-3′,經內參基因進行校正后獲得其相對水平(PPAR-γ2總拷貝/GAPDH總拷貝)。
1.4 血清檢測 使用全自動生化分析儀檢測血生化指標(寧波醫杰生物科技有限公司);采用化學發光免疫分析法檢測血清腫瘤壞死因子-α(TNF-α)水平(蘇州長光華醫生物試劑有限公司)和白介素-6(interleukin-6, IL-6)水平(北京普恩光德生物科技開發有限公司);采用免疫比濁法檢測血清超敏C反應蛋白(high-sensitivity C-reactive protein, hs-CRP)水平(武漢明德生物科技股份有限公司);使用FC500型流式細胞儀(美國貝克曼庫爾特)檢測外周血CD3、CD4和CD8細胞百分比。
1.5 療效判斷 顯效:癥狀及體征消失或明顯改善,肝功能和血脂指標復常,B超檢查顯示肝臟形態學復常或脂肪肝程度緩解,CT表現為肝/脾比值>1.0;有效:癥狀及體征消失或明顯好轉,肝功能和血脂指標較治療前下降1/2以上,B超檢查顯示脂肪肝程度緩解,CT檢查表現為脂肪變程度緩解;無效:癥狀及體征無明顯好轉,肝功能和血脂各項指標未下降,B超和CT檢查表現未達到有效標準[7]。

2 結果
2.1 兩組療效比較 在治療結束時,觀察組顯效17例(51.5%),有效15例(45.5%),無效1例(3.0%);對照組顯效8例(24.2%),有效14例(42.4%),無效11例(33.3%)。觀察組總有效率為97.0%,顯著高于對照組的66.7%,差異具有統計學意義(P<0.05)。
2.2 兩組肝組織PPARγ2mRNA水平比較 治療后,觀察組肝組織PPARγ2mRNA水平為(1.5±0.1),顯著高于對照組【(1.1±0.2),P<0.05】。
2.3 兩組血清炎性因子水平比較 在治療后,觀察組血清炎性因子水平顯著低于對照組(P<0.05,表1)。
2.4 兩組外周血淋巴細胞亞群水平比較 在治療后,觀察組外周血CD3、CD4細胞百分比和CD4/ CD8細胞比值顯著高于對照組(P<0.05,表2)。
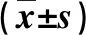
表1 兩組血清炎性因子水平比較
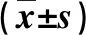
表2 兩組外周血淋巴細胞亞群比較
3 討論
隨著經濟生活和飲食結構的改變,肥胖及代謝性疾病發病率呈上升趨勢。研究顯示NAFLD作為獲得性代謝應激性肝損傷,發病群體具有低齡化發展趨勢,已經成為國內第一大慢性肝病[8]。成年人NAFLD發病率為6%~45%。NAFLD患者并發肝細胞癌風險顯著增加,嚴重威脅公共健康[9]。如何科學有效地處理NAFLD患者成為臨床亟待解決的問題。目前,NAFLD 尚無公認的特效治療藥物,治療的首要目標為降低體脂和肝臟脂肪沉積,避免因“二次打擊”而導致肝纖維化病情進展,降低二型糖尿病和代謝綜合征等合并癥的發生。雙環醇為我國自主研發的護肝藥物。研究[10]顯示雙環醇可調控藥物代謝酶活性、促進化學毒物和致癌物代謝,起到護肝的效果。非諾貝特則可通過調節膽固醇代謝、改善胰島素抵抗,發揮綜合調節機體代謝的作用。本研究將非諾貝特和雙環醇聯合應用于治療NAFLD患者,發現能短期改善患者各項指標。
目前,NAFLD發病機制尚未明確,但學者普遍認為脂代謝紊亂(肥胖)和胰島素抵抗為疾病的初次打擊,可導致肝臟發生脂肪變性,并降低肝細胞活力,使得肝臟發生氧化應激損傷及炎癥損傷,進而產生二次打擊,最終導致壞死,甚至肝纖維化[11,12]。雙環醇可顯著提高線粒體膜流動性,改善線粒體腺嘌呤核苷三磷酸酶活性,從而緩解肝臟能量代謝紊亂,避免肝臟氧化應激損傷,并抑制細胞核內核因子κB結合活性,進一步降低炎癥因子的釋放[13]。研究[14]顯示非諾貝特可通過上調胰腺胰島素合成轉錄因子基因表達,促進胰島素的生物合成,降低機體胰島素抵抗,從而減少肝臟脂質累積,避免初次打擊,從而減少肝細胞脂肪變性損傷導致的炎癥級聯反應,降低多種炎癥因子血清水平,控制NAFLD患者肝臟慢性炎癥反應進程。因此,本研究觀察組血清TNF-α、IL-6和hs-CRP水平顯著低于對照組。免疫功能異常被認為是導致NASH患者肝纖維化和炎癥的基礎,研究[15]顯示肝臟局部微環境中高水平的脂肪酸可降低組織CD4+細胞聚集。本研究在治療后,觀察組外周血CD3、CD4細胞和CD4/ CD8細胞比值顯著高于對照組,說明治療后觀察組免疫功能得到了明顯的改善。分析其原因可能為雙環醇降低了肝臟損傷,觀察組聯用非諾貝特,效果更好。研究[16]顯示非諾貝特一方面可改善血脂代謝,避免高水平脂肪酸對機體免疫功能的抑制作用;另一方面,非諾貝特可抑制炎性細胞因子、趨化因子和促纖維化基因的表達,減少肝星狀細胞的活化,抑制肝纖維化的發生[17],避免了免疫細胞的耗竭,幫助機體免疫功能的恢復。
既往研究[18]顯示,非諾貝特為PPAR-α的配體,動物實驗證實其可通過激活PPAR-α信號通路,抑制機體炎癥反應及肝纖維化進程,但臨床實驗中尚無確切的證據表明PPAR-α激動劑能改善NAFLD病情。PPARs屬于細胞核激素受體超家族,PPAR-α和PPARγ2均為其亞型之一,PPARγ2主要在機體脂肪組織中表達,是調節三酰甘油穩態的主要角色,也可調控脂肪細胞增殖,還可調節機體炎癥反應,抑制氧化應激損傷[19]。本研究對NAFLD患者肝組織PPARγ2mRNA進行了研究,發現治療后,觀察組肝組織PPARγ2mRNA水平顯著高于對照組,說明非諾貝特可能通過提高肝組織PPARγ2表達,促進脂肪重新分布,使脂肪從肝臟等內臟組織轉移并消耗,進而抑制肝細胞脂肪變性,減輕肝臟巨噬細胞浸潤,而非諾貝特影響PPARγ2表達的具體機制則有待進一步研究。在雙環醇基礎上應用非諾貝特可進一步調節機體血脂代謝紊亂,減輕肝細胞損傷,進而促進肝功能恢復。因此,以癥狀、體征、肝功能以及血脂各項指標的改善作為療效判斷的標準,發現觀察組總有效率顯著高于對照組。

