Rab蛋白家族在神經類疾病中的作用
吳安平,慶宏,全貞貞
Rab蛋白家族在神經類疾病中的作用
吳安平,慶宏,全貞貞
北京理工大學生命學院分子醫學和生物診療工信部重點實驗室,北京 100081
細胞內膜囊泡運輸是一個復雜的通路網絡,Rab GTPases是膜囊泡運輸的主要調節劑,通常被認為是細胞內吞和分泌系統中各種細胞器和囊泡的特異性標記和識別物。與Rab蛋白相關的軸突運輸、內體運輸發生障礙是造成神經退行性疾病的重要原因之一。本文主要介紹了Rab蛋白在多種神經退行性疾病病理機制中的作用機理與調控機制,同時討論了線粒體和膠質細胞功能異常與Rab蛋白之間的關聯。深入探究Rab蛋白的作用機制對人類神經性疾病的早期診斷和治療具有潛在的指導意義。
Rab蛋白;神經退行性疾病;膜囊泡運輸;線粒體;星型膠質細胞
中國是世界上癡呆癥患者最多的國家,給公共和衛生保健系統帶來了沉重負擔。研究表明,2016年我國老年人口患癡呆癥的概率是5.6%[1],目前我國的癡呆癥患者大約有3100萬,給患者及其家人帶來沉重負擔,將會引發越來越嚴重的公共衛生問題和社會問題[2]。
癡呆等認知障礙的形成是由于神經元結構和功能逐漸喪失,以及神經元死亡和膠質細胞失衡所導致的,主要包括阿爾茲海默病(Alzheimer’s disease, AD)、帕金森病(Parkinson’s disease, PD)、亨廷頓病(Huntington’s disease, HD)、肌萎縮性側索硬化癥(amyotrophic lateral sclerosis, ALS)、不同類型脊髓小腦共濟失調病等神經類疾病。研究表明Rab蛋白能夠調節神經元細胞的內吞和軸突運輸,參與多種神經類疾病的病理進程。本文就Rab蛋白如何調控各類神經類疾病進行了歸納和分析,進一步闡述了Rab蛋白在的作用機制,為今后探究Rab蛋白在神經類疾病中的作用提供了思路和參考。
1 Rab蛋白結構
Rab蛋白是存在于細胞質膜和細胞器膜中的一類調節型小分子GTP結合蛋白,是Ras超家族中最大的亞家族。Rab蛋白在進化上高度保守,幾乎存在于所有的真核生物中。Rab蛋白平均分子量大小為25 kDa,約由200個氨基酸組成。Rab蛋白含G結構域、N端與C端,其中,G結構域高度保守,N端與C端高度可變[3]。G結構域包含6個β折疊、5個α螺旋及5個多肽環,多肽環的氨基酸序列高度保守,是Mg2+和鳥嘌呤的結合位點,同時催化GTP水解。Rab蛋白的羧基末端包含-XXXCC-、-XXCCX-、-XCCXX-、-CCXXX-或-XXCXC-基本序列,其中兩個半胱氨酸是異戊二烯化的底物。這種修飾對于膜結合至關重要。羧基末端高變區是必需的,但不足以將Rab蛋白正確靶向到細胞中的特定位置[3]。大多數Rab蛋白通過翻譯后在羧基端附近的兩個半胱氨酸上將兩個香葉基(20碳聚異戊二烯基)基團與膜或膜蛋白復合物緊密結合,少數Rab蛋白只有一個香葉基[4]。N端的作用可能是參與指導C端半胱氨酸進行異戊二烯化修飾。G結構域的“開關”區域(稱為開關1和2)通過與GTP結合產生穩定的構象,是Rab蛋白特異性識別其細胞效應子關鍵區域。不同的Rab蛋白在進行開“ON”和關“OFF”狀態切換時,可能會發生比較靈活的構象變化[5]。對Rab蛋白突變體及嵌合體的研究表明,分子開關I和分子開關II、高度可變的N端和C端是Rab蛋白重要功能的決定因素。
Rab蛋白的主要功能是調節細胞信號的傳導、細胞的生長和分化[6]。Rab GTPases作為分子開關,在GTP結合的活性形式和GDP結合的非活性形式之間轉換,控制細胞內囊泡運輸的各個方面。Rab-GTP結合型和Rab-GDP結合型之間的循環受蛋白質調節劑嚴格控制:GDP解離抑制劑(GDP disso-ciation inhibitors, GDI)調控Rab蛋白與膜的連接及Rab蛋白從膜上解離,GDI作為循環因子起作用,只與異戊二烯化修飾的無活性的Rab蛋白結合,將Rab-GDP保持在胞液中。伴隨著Rab蛋白與供體囊泡的膜或膜蛋白復合物結合,鳥嘌呤交換因子(guanine nucleotide exchange factor, GEF)催化Rab- GDP形式轉化成Rab-GTP形式,Rab蛋白被激活,Rab-GTP與下游效應子相互作用,使效應子功能發生變化;GTPase活化蛋白(GTPase accelerating protein, GAP)催化GTP水解,Rab蛋白失活,不再與效應子相互作用;GDI從膜上抽出Rab-GDP,與其形成復合物,又循環到胞液中。通過激活/失活循環,Rab蛋白作為分子開關將上游信號傳遞給下游效應子(圖1)。Rab蛋白在其活性形式時與許多不同的蛋白質相互作用,這些蛋白質被稱為Rab蛋白的效應子。Rab蛋白的效應子在囊泡的形成、囊泡沿細胞骨架的轉運及囊泡與靶膜的拴系錨定等階段中發揮作用[7]。
2 Rab蛋白在細胞中的調控途徑
Rab蛋白最主要的功能是調控細胞內吞,內吞運輸系統主要由內吞、循環、降解等子系統組成。其中,內吞循環運輸負責將膜上大分子送回質膜回收再利用,在細胞極性形成和維持、細胞分裂及遷移、神經突觸可塑性、免疫應答、生長因子受體調控等過程中不可或缺[8]。降解途徑導向晚期內含體和溶酶體,貨物在其中發生降解[9]。沿內吞途徑的每個運輸步驟均由不同的Rab蛋白介導:Rab5介導貨物從質膜到早期內含體的運輸并充當早期內含體的標記物[10];而Rab7則調節貨物從早期到晚期內含體的運輸并充當晚期內含體的標記物[11];Rab4,Rab11和Rab35介導回收途徑;Rab4和Rab35調控貨物從早期內含體、循環內含體直接返回質膜的快速回收[12,13];Rab11控制循環內含體的回收[14](圖2)。研究表明,晚期內含體和溶酶體功能異常,在細胞衰老和神經退行性疾病(如帕金森病和阿爾茨海默病)中起著關鍵作用。
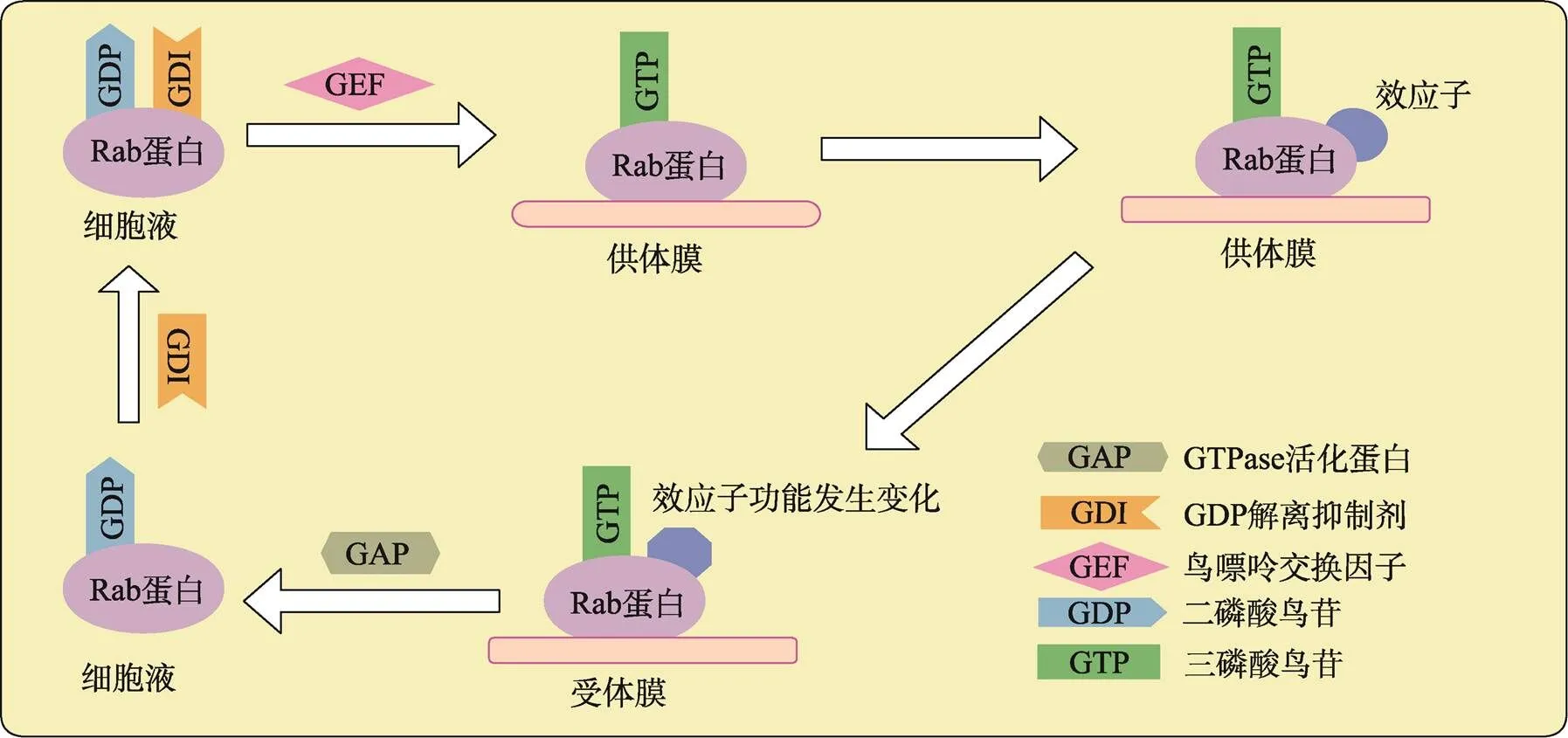
圖1 Rab蛋白的功能循環示意圖
Rab蛋白與GDI、GDP結合保存在胞液中,由GEF激活轉移到供體膜上轉化成Rab-GTP形式,使下游效應子發揮作用,激活態的Rab-GTP蛋白被GAP催化水解,隨后GDI與Rab-GDP又形成復合物,循環到胞液中,形成循環。
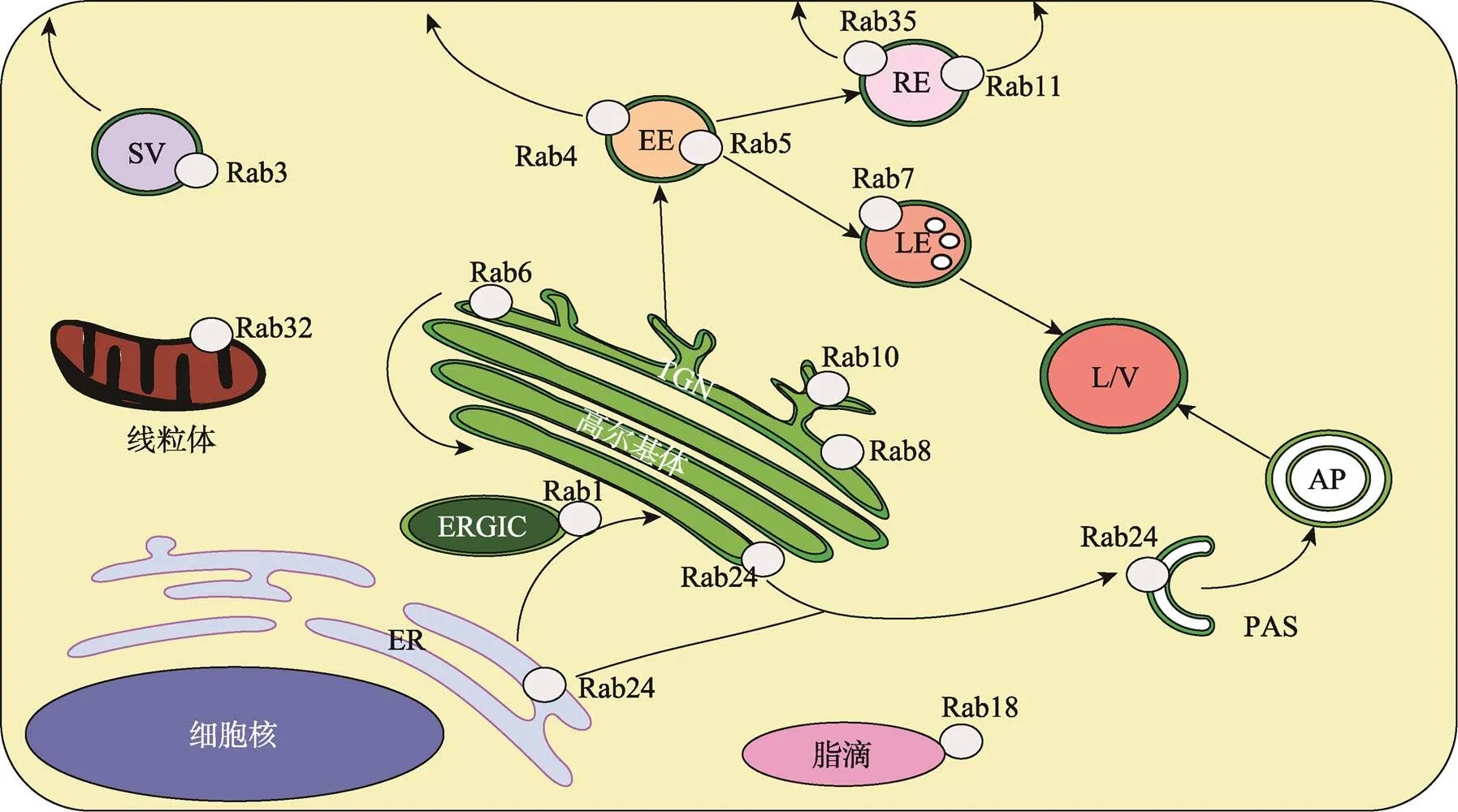
圖2 Rab蛋白在細胞中的分布
ER:內質網;TGN: 反高爾基網絡;EE:早期內含體;LE:晚期內含體;RE:循環內含體;AP:自噬體;ERGIC:內質網一高爾基體中介組分;L/V:溶酶體/液泡;PAS:前自噬體;SV:分泌囊泡/顆粒。
3 Rab蛋白在神經元中的相關功能
神經元的特殊形態和功能高度依賴于膜運輸的嚴格調節。內吞功能障礙破壞了雙向軸突運輸和突觸小泡與靶膜的對接,從而導致神經運輸和神經營養信號發生異常。軸突運輸的改變,特別是神經營養蛋白受體在軸突運輸的改變與幾種人類神經退行性疾病都有關聯[15,16]。Rab3A是突觸活性區的結構成分,與其他核心活性區蛋白RIM1和MUNC13一起形成三元復合物,調節突觸小泡與膜的結合過程,以釋放神經遞質[17]。Rab3蛋白還參與淀粉樣前體蛋白(amyloid protein precursor, APP)的快速軸突運輸[18]。Rab7控制神經營養蛋白受體的逆行軸突運輸[19],Rab7損傷可誘導神經營養因子TrkA在內含體中的積累,進而阻滯神經營養蛋白逆行轉運[20]。Rab26位于突觸小泡表面,自噬蛋白Atg16L1、LC3和Rab33B被募集到這些突觸小泡中,從而連接了突觸小泡與自噬機制[21]。與其他細胞類型相比,神經元可能對蛋白質水平的輕微升高或降低更敏感,特定蛋白質水平的微小變化也可能導致神經元功能障礙和死亡。
4 Rab蛋白在神經退行性疾病中的作用
4.1 阿爾茨海默病
阿爾茨海默病是神經變性和癡呆癥的最常見形式。超過90%~95%的AD病例是散發性(sporadic AD,SAD)且與已知的疾病突變無關。大約5%~10%的病例被歸類為家族性AD (familial AD, FAD),與早老素1、早老素2和APP的突變有關。這些突變導致β-淀粉樣蛋白(β-amyloid, Aβ)的產生發生異常。在Aβ形成途徑中,APP首先被β-分泌酶切割,其中主要發揮作用的是β-分泌酶1 (β-site APP cleaving enzyme 1, BACE1),使APP 596~597位氨基酸之間發生裂解,釋放一個可溶性的約100 kDa的N端片段sAPPβ,在膜上留下一個12 kDa的C端片段C99,C99片段被γ-分泌酶切割,從而產生Aβ。AD患者中Aβ產生過量,作為細胞外沉積物積聚在腦中,是形成老年斑的主要成分,其與由tau蛋白異常磷酸化導致的神經原纖維纏結是AD最主要的兩大病理特征[22]。
Rab11b位于早期和晚期內體,高爾基復合體和內質網中。通常與再循環內含體有關,調控著反面高爾基體管網狀結構與內吞、在循環內含體或質膜之間的物質運輸。通過共聚焦分析和免疫熒光染色顯示,在Rab11B陽性循環內含體中觀察到BACE1沿樹突和軸突定位并運輸。沉默導致內在的BACE1在體細胞中積累,伴隨著軸突中BACE1的水平降低[23]。這些結果表明,Rab11是神經元中BACE1的分選調節劑,對于BACE1的軸突分選至關重要。另外,siRNA敲低的表達顯著降低了sAPPβ和Aβ的水平,這提示Rab11功能障礙可能是部分散發性阿爾茨海默病病例的發病機制之一[24]。Rab21在蛋白從早期內含體向晚期內含體轉運過程中發揮作用,研究發現過表達可以通過促進γ-分泌酶的內吞及向晚期內含體的遷移來影響其活性,進而促進Aβ的產生[25]。沉默會降低Aβ水平,而不影響sAPPβ。這意味著這些Rab GTPases會影響γ-分泌酶對APP的水解或Aβ的運輸[25,26]。同濟大學生命科學與技術學院的裴剛院士課題組通過采用雙分子熒光互補技術結合熒光共振能量轉移技術發現ADAM10/BACE1二元復合物主要位于早期內含體,進一步觀察到γ-分泌酶與α-/β-分泌酶二元復合物相互作用,表明α-、β-和γ-分泌酶可能形成三元復合物[27],這提示影響γ-分泌酶的Rab21蛋白可能同時調控α-分泌酶和β-分泌酶。Rab8A/Rab8是極化運輸的重要調節劑,并參與反高爾基網絡至基底外側質膜的運輸,突起形成和纖毛發生[28,29]。與對照相比,來自AD腦組織質膜部分的Rab8水平顯著增加[30]。另有研究發現,沉默也可增加tau蛋白分泌。Rab1A與高爾基體膜相關,沉默會誘導高爾基體碎裂,這表明Rab介導的高爾基體動力學可能參與調節tau蛋白分泌[31]。Rab3蛋白參與調控APP在軸突的快速運輸。沉默和能夠降低總體APP蛋白水平,這表明Rab3在APP的運輸和維持中發揮了作用[26]。
Ras and Rab Interactor 3 (RIN3)是Rab5 GTPase家族的鳥嘌呤核苷酸交換因子(GEF),美國加州大學圣地亞哥分校醫學院的吳承標課題組發現,在AD發病早期,的mRNA水平在皮質和海馬中均顯著增加,這一現象先于β-淀粉樣蛋白沉積產生[32]。在APP/PS1小鼠的基底前腦膽堿能神經元中選擇性上調。由于RIN3是Rab5的GEF,因此增加的表達可能有助于APP/PS1小鼠基底前腦膽堿能神經元中Rab5早期內含體的增大。通過質譜分析發現,RIN3向Rab5早期內含體募集了另外兩個AD危險因素BIN1和CD2AP,進而損害APP的運輸和加工,導致具有神經元毒性的APP-CTF的產生增加。RIN3/BIN1復合物的增加還可以促進Tau蛋白過度磷酸化。Rab5在內含體運輸、突觸和突觸功能中起重要作用[32]。它還參與了興奮性突觸傳遞的長期增強和抑制過程,這對于學習和記憶功能非常重要[33,34]。Rab5的激活可能會削弱突觸功能和細胞之間的通信,導致信號傳遞到內含體的軸突運輸減少和神經元萎縮。
在AD模型鼠中觀察到明顯增大的溶酶體聚集在一起,顯示出溶酶體功能障礙。溶酶體呈現較低的pH值時,Aβ42可能被錯誤折疊成穩定的聚集體,該聚集體能夠在細胞內繁殖并隨后成核,并在胞外形成淀粉樣斑塊[35]。最近發現,參與內含體,自噬體和溶酶體運輸的Rab7A可以調節tau蛋白分泌。抑制的表達后,tau蛋白在Thr181和Ser422位點的磷酸化完全被消除,Ser202和Ser404處的磷酸化也顯著降低,tau蛋白磷酸化的減少可能有助于其分泌減少。與此一致的是的顯性負突變和組成型活性形式的過表達分別減少和增加了tau蛋白分泌[36]。AD患者的人腦和AD小鼠模型腦中可以檢測到Rab7A水平升高,且 Rab7A和tau蛋白之間存在共定位現象,這進一步表明Rab7A可能促進tau蛋白在AD中的積累[36]。
4.2 帕金森病
帕金森病也是一種常見的神經退行性疾病,其臨床表現為運動缺陷,包括靜息性震顫和肌肉僵硬[37]。其病理特征主要是在黑質致密部中積累了由α-突觸核蛋白(α-synuclein, α-syn)組成的路易小體和多巴胺能神經元的選擇性變性。約95%的PD病例為散發性,其余為家族性。突觸核蛋白和的基因突變是引起家族性和散發性帕金森病的主要原因。人類遺傳學的最新進展指出,膜運輸缺陷是PD致病的關鍵途徑[38]。α-Syn是神經元中高度豐富的蛋白質,溶酶體過程的破壞會影響其代謝[39]。
在PD動物模型中已經證明,過量的α-syn會損害Rab蛋白依賴的細胞內運輸,研究發現的過表達可能逆轉細胞內毒性,從而阻止神經元的丟失[40]。α-syn的內吞與再循環可能由Rab11A和Rab13介導,同時Rab11A,Rab13和Rab8B可能也參與α-syn在包涵體中的清除[41]。Dinter等[42]發現在HEK293細胞中,的過表達能夠增加α-syn的清除率,其效應子FYCO1需要活性Rab7才能發揮作用,繼而刺激α-突觸核蛋白的降解。在飛行模型中,Rab7和FYCO1可以挽救突變體α-syn誘導的運動功能障礙,因此Rab7可以作為治療PD的潛在靶點[42]。
LRRK2位于高爾基體、高爾基相關囊泡、內質網、線粒體和溶酶體中,是囊泡運輸的一般調節器。LRRK2可能通過調節與內含體分選相關的Rab GTPases (即Rab29、Rab8A、Rab10)在開關II區的保守蘇氨酸殘基處的磷酸化,進而調節貨物的囊泡運輸。反過來,LRRK2激酶的活性主要受高爾基復合體內Rab29和內含體中與逆轉錄子相關的VPS35的調控[43]。磷酸蛋白質組學的結果表明,包括Rab3A、Rab29、Rab8A、Rab10、Rab12和Rab43在內的幾種Rab蛋白均是LRRK2的底物[44~46]。通過LRRK2激酶的體外活性測定還發現,Rab GTPase蛋白的一個子集,包括Rab1A、Rab3C、Rab35可以與LRRK2相互作用并被其磷酸化[47]。
越來越多的證據表明,沉默內源性表達導致自噬缺陷,從而使α-syn的異常積累,進而導致PD的發生[39]。Rab29在溶酶體應激條件下,將LRRK2募集到較大的溶酶體中,易位至異常的溶酶體后,LRRK2募集其底物Rab8和Rab10,并通過介導其功能性下游調節子,EH結構域結合蛋白1 (EHBP1)和EHBP1樣蛋白1 (EHBP1L1)來促進溶酶體分泌[48]。鑒于EHBP1和EHBP1L1參與內含體和制管膜曲率的形成[49,50],可以推測LRRK2-Rab途徑調節溶酶體的形態。
研究證明Rab35是LRRK2的下游效應子。Rab GTPases上的磷酸化位點突變會引起原代皮層神經元中的神經毒性和多巴胺能神經元的變性,這在Rab35磷酸突變體中尤為嚴重[47]。韓國首爾國立大學醫學院李勝在課題組在α-syn轉基因小鼠中發現,LRRK2激酶的抑制降低了α-syn的病理特征并增強了α-syn向溶酶體的運輸[51]。考慮到Rab35可以通過調節多囊泡體向質膜的運輸和對接來調控外泌體的分泌[52],猜測LRRK2-RAB35途徑的激活使α-syn避開了溶酶體降解途徑,而是導致其進入分泌途徑,從而促進了該蛋白的積累[53]。
4.3 肌萎縮性側索硬化癥
肌萎縮性側索硬化癥是一種進行性神經系統變性疾病,主要影響大腦和脊髓中的運動神經元[54]。
與AD和PD相似,所有ALS病例中有90%是散發型的;有10%來自家族,是由編碼多種蛋白質的基因突變引起的,這些基因包括(Rab5的鳥嘌呤核苷酸交換因子),(染色體9上的開放讀碼框72),(超氧化物歧化酶1),(交易反應性DNA結合蛋白43),(肉瘤融合蛋白)和(VAMP (小突觸泡蛋白)相關的蛋白B)等[55~57]。
ALS在兒童期發作是由于基因功能喪失的突變所致,ALS2通過激活Rab5在早期內含體中的成熟發揮關鍵作用。ALS2和Rab5相互作用可以調節神經營養蛋白的信號傳導[58]。
在ALS患者的運動神經元中,C9orf72主要定位于Rab5陽性的早期內含體。在神經元細胞系和原代皮層神經元中,C9orf72與Rab1、Rab5、Rab7和Rab11共定位[57]。沉默后,TrkB的內吞作用被抑制,這表明這些患者的內含體運輸受到損害[59]。已有報道顯示C9orf72與Rab蛋白的相互作用能夠調節運動神經元中內含體的運輸,該過程是溶酶體發生所必需。C9orf72的耗竭會損害自噬,并導致聚集體的異常聚集,而聚集體是ALS發病的主要特征。沉默后,LC3II:LC3I比例顯著增加,表明自噬體形成失調。
Rab1與突變型TDP-43,FUS和SOD1廣泛共定位于神經元細胞中,并且Rab1在散發性ALS患者的脊髓運動神經元中參與形成包涵體。SOD1、TDP-43或FUS的突變會導致Rab1的定位出現錯誤,進而導致內質網–高爾基體網絡中的蛋白質運輸受損。而這些缺失可以通過的過表達來挽救[60]。的過表達對mSOD1、mTDP-43和mFUS誘導的內質網應激具有保護作用[55]。Rab1介導的內質網–高爾基體運輸途徑可能是ALS中的新型治療靶點。
4.4 亨廷頓病
亨廷頓病是一種致命的神經退行性疾病,每100,000名居民中有5~10例患病,典型發病年齡為30~40歲。患者會遭受一系列復雜的精神、認知和運動障礙,直至死亡。亨廷頓病是由亨廷頓基因()中的聚谷氨酰胺()重復擴增引起的常染色體顯性遺傳病。重復序列的長度與發病年齡成正比,但是遺傳變異和環境因素改變了這種相關性[61]。它是由三核苷酸CAG在亨廷頓基因()基因5?末端附近的多態性區域發生異常擴增引起的。這種顯性突變不僅耗盡了編碼的亨廷頓蛋白,破壞了其生理功能,而且還產生了折疊錯誤的蛋白,即突變體Htt,并導致紋狀體中的中棘神經元死亡[62]。
Rab8 GTPase調節反面高爾基體網管狀結構向質膜的運輸,optineurin是其效應子,二者形成的復合物在高爾基復合體到基底外側質膜的極化膜運輸過程中以及神經元的樹突中起重要作用[63]。的突變與optineurin-Rab8復合物的相互作用減少,從而導致網格蛋白依賴性高爾基體到溶酶體區室的運輸發生改變[64]。此外,Htt和HAP40(Htt相關蛋白40)形成的復合物是Rab5的效應子,可控制早期內含體的運動活性[65]。的過表達降低了Htt突變蛋白的聚集,而沉默會抑制內吞作用并阻斷自噬,從而增加了polyQ的聚集[66]。Rab11是參與內含體再循環的Rab蛋白,內循環是細胞維持質膜成分的主要途徑。突變體Htt抑制Rab11-GDP到Rab11-GTP的核苷酸交換,從而抑制Rab11的活性并導致細胞中轉鐵蛋白受體的再循環減慢。HD患者中Rab11活性和內體循環功能的異常可能與除轉鐵蛋白外的許多關鍵蛋白的轉運有關,并對神經元的樹突和軸突產生影響[67]。
在HD轉基因小鼠中,觀察到靠近Htt聚集體的神經元樹突棘較少,提示樹突棘損失可能是Htt聚集體清除率下降的早期結果。通過在海馬神經元中過表達可消除表達Htt的原代鼠神經元中樹突棘的喪失,這表明突觸功能障礙與Rab11受損可能有早期HD的發病相關[68]。
HD與軸突運輸的改變有關。在紋狀體神經元中,的表達破壞了軸突的快速運輸[69]。在果蠅HD模型中,的過表達能夠恢復早期的突觸功能障礙,包括突觸前囊泡大小的減少,數量振幅的減少和誘發的突觸傳遞以及幼蟲爬行的改變等[70]。
4.5 夏科特–瑪麗–牙齒2B型
夏科特–瑪麗–牙齒(Charcot–Marie-tooth, CMT)病是最常見的遺傳性神經肌肉疾病,該病是由于幾種不同基因的突變導致相似的表型。CMT主要分為1類(CMT1)和2類(CMT2)形式。CMT1是特征為神經傳導速度降低的顯性遺傳性脫髓鞘神經病,而CMT2是特征為神經傳導速度正常或略有降低的顯性遺傳性軸突神經病。除了這些主要類別外,CMT中還包括其他稀有形式[71]。在此著重介紹直接與Rab相關的CMT疾病,即CMT2B型,其表現包括嚴重的感覺喪失,遠端肌肉無力以及由于反復感染引起的足部潰瘍,感染甚至截肢的頻繁發生。
Rab7中高度保守的氨基酸殘基的5個錯義突變與CMT2B型表型相關。點突變引起Rab7蛋白水平升高或降低,進而影響Rab7控制的神經營養蛋白的轉運和信號傳導、神經突向外生長以及神經元遷移[20,72]。由于神經營養蛋白受體的內吞作用和逆行軸突運輸對于神經營養蛋白信號的傳導和控制神經元的分化、可塑性和存活至關重要,因此神經營養蛋白運輸障礙可能會導致嚴重的神經變性[73,74]。
在一名CMT2B患者腓腸神經活檢中,發現Rab7效應子-Rab相互作用溶酶體蛋白(Rab interacting lysosomal protein, RILP)被下調,導致受體降解和信號衰減。RILP不僅是晚期內體/溶酶體的正常分布所必需的,而且是晚期內體中腔內囊泡的形成所必需的[75,76]。但是,GTP水解不足可能會導致Rab7突變體隔離RILP,從而降低RILP作用于其他方面(如內含體)的能力。由于Rab7是普遍存在的RabGTPase,因此這種罕見疾病也顯示了其神經元對膜運輸的變化具有敏感性的特點。
5 Rab GTPases介導線粒體和星形膠質細胞的功能
Rab GTPas介導的膜運輸與神經退行性疾病的關聯是多種多樣的。在神經退行性疾病中,在受損線粒體吞噬過程中Rab蛋白同樣發揮重要的調控作用。線粒體的狀態直接影響神經元的發育、功能和存活。神經元是長壽細胞,在整個生命周期中都存在,因此更容易受到線粒體功能障礙引起的累積損傷的影響。在AD患者神經元內的異常溶酶體中,發現了未消化的受損線粒體[77]。在PD的發病機理中LRRK2、α-Syn會損害線粒體和線粒體功能,因此造成的線粒體受損是必然的。ALS的致病基因涉及線粒體和線粒體調控基因(如、Ser/Thr蛋白激酶()、和超氧化物歧化酶1 ())[78]。功能障礙線粒體的積累已成為患者和動物模型中受累神經元的共同特征,可能出現在明顯的認知缺陷之前。
Rab7的活性受兩個Rab7 GAPs (TBC1D15和TBC1D17)的調控,同時Rab7也被募集到線粒體外膜,在那里動員囊泡以建立自噬體。TBC1D15和TBC1D17的耗盡會導致Rab7在線粒體上積累,并導致自噬體樣結構異常積累,從而延遲并阻礙受損線粒體的清除[79,80]。這些GAPs在空間上控制Rab7活性,Rab7活性本身控制了囊泡向自噬體膜的募集。處于其GTP結合活性狀態的Rab32參與線粒體的分裂[81]。Rab35促進自噬受體NDP52的募集以及與泛素的結合,從而促進異種吞噬、線粒體吞噬和自噬體的成熟[82]。
許多研究表明AD、PD和HD等神經退行性疾病的發病機制中存在星形膠質細胞的功能異常,并伴有Rab蛋白水平的變化。神經炎癥是所有神經退行性疾病的重要組成部分,其中小膠質細胞和星形膠質細胞通過釋放多種促炎和抗炎細胞因子來發揮雙向作用[83,84]。小膠質細胞可以通過介導神經炎癥調節大腦免疫,并參與突觸的連接和重塑;然而在AD早期小膠質細胞可以介導突觸的異常喪失進而促進病理進程[85]。星形膠質細胞是大腦中存在較為豐富的細胞,可維持神經遞質的穩態,引導突觸的形成和成熟,調節活性氧和血腦屏障[86~88]。神經炎癥和缺血可誘導出兩種不同類型的反應性星形膠質細胞,稱為A1和A2反應性星形膠質細胞。A1反應性星形膠質細胞的上調可能是有害的,而A2反應性星形膠質細胞的上調可能是有益的[89]。此外,衰老的星形膠質細胞具有神經炎性A1樣反應性星形膠質細胞的反應性表型。除了釋放有效的神經毒素外,A1星形膠質細胞還能促進新突觸的形成,并導致中樞神經系統神經元的興奮功能降低。除了星形膠質細胞反應性狀態的改變外,星形膠質細胞中可能還會發生其他轉錄和功能性變化,這可以解釋正常衰老過程中認知能力下降這一現象[90],而在PD模型中抑制A1星形膠質細胞的活性具有保護神經作用[91]。
研究發現,在AD中,星形膠質細胞是大腦在生理條件下表達的主要細胞,星形膠質細胞參與Aβ攝取和降解[92,93]。在AD早期階段,BACE1活性增加伴隨著BACE2活性的相應增加,BACE2主要定位于星形膠質細胞中[94]。在PD中,從神經元釋放的α-Syn被星形膠質細胞吸收,進而影響其線粒體的完整性并導致神經毒性的產生[95~97]。研究發現星型膠質細胞在神經退行性疾病的病理性擴散中具有潛在的協同作用[98]。在HD中,隨著疾病進展會增加相關星形細胞的活性,進而導致Htt的聚集[99,100]。在ALS中,星形膠質細胞顯示出毒性表型,引起運動神經元變性。Rab31在表皮生長因子受體轉運至晚期內含體的運輸中發揮作用[101],沉默研究引起的EGFR信號轉導增加可能會阻礙培養物中星形膠質細胞的完全發育,從而導致存活的星形膠質細胞百分比降低[102]。
在促炎條件下,智利大學Quest等[103]通過生物信息學發現,反應性星形膠質細胞中Rab的內吞途徑發生了改變,其有利于蛋白水解的回收。特別是,Rab4、Rab5和Rab7的蛋白表達水平發生變化。另一方面,這種促炎環境增加了和的表達,并降低了Rab7-GTP的負荷。在促炎環境中,從早期(Rab5)到晚期內含體(Rab7)的貨物運輸也發生了變化。通過分析晚期和早期內體組分中的低密度脂蛋白LDL (注定要降解的貨物)的分布,研究人員觀察到LDL保留在TNFα刺激的細胞的外圍,這表明由Rab7所介導的溶酶體降解能力下調[103]。在神經退行性疾病和腦損傷中,星形膠質細胞活化涉及Rab依賴性途徑的分子機制尚待研究。
6 結語與展望
本文主要分析了一些Rab蛋白在神經類疾病中的運輸和信號傳導中的變化,Rab蛋白的異常表達、活性改變或定位錯誤可能與多種神經類疾病如(AD、PD和HD)的致病機制有關(表1)。參與內吞降解途徑的Rab7A可以調節tau蛋白的分泌。Rab11和Rab21可以通過影響BACE1或PS1的定位進而影響Aβ的產生。Rab35可以促進α-syn的分泌。沉默加htt突變蛋白的聚集。在ALS和CMT2B中,Rab7參與調節軸突運輸以及內吞途徑,神經營養蛋白的信號傳導。Rab蛋白主要通過調節內吞途徑來影響蛋白聚集體的產生。另一方面,神經退行性疾病的致病機制,即線粒體和星形膠質細胞的功能異常也與Rab蛋白水平的改變密切相關。線粒體功能障礙發生在神經退行性疾病的早期階段,是造成神經元死亡的重要原因。線粒體功能障礙的出現和加重可能是由病理過程發展中涉及的許多因素造成的。研究與受損線粒體自噬調節的相關Rab蛋白并分析Rab蛋白在其中的調節途徑對神經退行性疾病的早期診斷將會有很大幫助。
星形膠質細胞在神經退行性疾病中的作用機制是目前的研究熱點,Rab蛋白在其中的作用尚不清楚。星形膠質細胞對于維持腦穩態和保護神經元至關重要。星形膠質細胞中的溶酶體降解能力不足,與包括PD在內的各種神經退行性疾病的發病機理有關。阻止或者減少A1反應性星形膠質細胞的形成可以減緩神經退行性疾病的病理進程。在成年嚙齒動物的大腦中,僅在神經膠質纖維酸性蛋白陽性星形膠質細胞中表達[101]。Rab蛋白作為星型膠質細胞的生物標志物,具有作為神經退行性疾病診斷工具的巨大潛力。

表1 神經退行性疾病中的Rab蛋白及其功能
盡管已經非常深入地研究了幾種Rab蛋白,但是Rab蛋白家族仍有巨大的研究潛力,Rab蛋白在中樞神經系統不同組織中的特殊作用至關重要。神經退行性疾病是一些常見功能障礙導致的具有不同病理特征的疾病。Rab蛋白在不同的神經退行性疾病中顯示出不同的調節作用,但是目前尚不清楚是Rab蛋白的變化引起功能障礙還是功能障礙導致Rab蛋白水平發生變化。發現和研究這些潛在的常見機制可以使我們更加了解神經元存活的基本要求,為深入探究這幾種神經類疾病的病理學機制奠定基礎,同時為開發有效的治療策略開辟新的道路。
[1] GBD 2016 Dementia Collaborators. Global, regional, and national burden of Alzheimer’s disease and other dementias, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016., 2019, 18(1): 88–106.
[2] Jia L, Quan M, Fu Y, Zhao T, Li Y, Wei C, Tang Y, Qin Q, Wang F, Qiao Y, Shi S, Wang YJ, Du Y, Zhang J, Zhang J, Luo B, Qu Q, Zhou C, Gauthier S, Jia J. Group for the Project of Dementia Situation in China Dementia in China: epidemiology, clinical management, and research advances., 2020. 19(1): 81–92.
[3] Brennwald P, Novick P. Interactions of three domains distinguishing the Ras-related GTP-binding proteins Ypt1 and Sec4., 1993, 362(6420): 560–563.
[4] Iakovenko A, Rostkova E, Merzlyak E, Hillebrand AM, Thom? NH, Goody RS, Alexandrov K. Semi-synthetic Rab proteins as tools for studying intermolecular interactions., 2000, 468(2): 155–158.
[5] Milburn MV, Tong L, deVos AM, Brünger A, Yamaizumi Z, Nishimura S, Kim SH. Molecular switch for signal transduction: structural differences between active and inactive forms of protooncogenic ras proteins., 1990, 247(4945): 939–945.
[6] Guadagno NA, Progida C. Rab GTPases: switching to human diseases., 2019, 8(8): 909.
[7] Seabra MC, Wasmeier C. Controlling the location and activation of Rab GTPases., 2004, 16(4): 451–457.
[8] Lin L, Shi AB. Endocytic recycling pathways and the regulatory mechanisms., 2019, 41(6): 451–468.林瓏, 史岸冰. 細胞內吞循環運輸通路及其分子調控機制. 遺傳, 2019, 41(6): 451–468.
[9] Stoorvogel W, Strous GJ, Geuze HJ, Oorschot V, Schwartz AL. Late endosomes derive from early endosomes by maturation, 1991, 65(3): 417–427.
[10] Bucci C, Parton RG, Mather I H, Stunnenberg H, Simons K, Hoflack B, Zerial M. The small GTPase rab5 functions as a regulatory factor in the early endocytic pathway, 1992, 70(5): 715–728.
[11] Feng Y, Press B, Wandinger-Ness A. Rab 7: an important regulator of late endocytic membrane traffic, 1995, 131(6 Pt 1): 1435–1452.
[12] Kouranti I, Sachse M, Arouche N, Goud B, Echard A. Rab35regulates an endocytic recycling pathway essential for the terminal steps of cytokinesis., 2006, 16(17): 1719–1725.
[13] Daro E, van der Sluijs P, Galli T, Mellman I. Rab4and cellubrevin define different early endosome populations on the pathway of transferrin receptor recycling., 1996, 93(18): 9559–9564.
[14] Ullrich O, Reinsch S, UrbéS, Zerial M, Parton RG. Rab11 regulates recycling through the pericentriolar recycling endosome, 1996, 135(4): 913– 924.
[15] Gunawardena S, Her LS, Brusch RG, Laymon RA, Niesman IR, Gordesky-Gold B, Sintasath L, Bonini NM, Goldstein LSB. Disruption of axonal transport by loss of huntingtin or expression of pathogenic polyQ proteins in, 2003, 40(1): 25–40.
[16] Stokin GB, Lillo C, Falzone TL, Brusch RG, Roc-kenstein E, Mount SL, Raman R, Davies P, Masliah E, Williams DS, Goldstein LSB. Axonopathy and transport deficits early in the pathogenesis of Alzheimer's disease, 2005, 307(5713): 1282–1288.
[17] Dulubova I, Lou Xl, Lu J, Huryeva I, Alam A, Schneggenburger R, Südhof TC, Rizo J. A Munc13/ RIM/Rab3 tripartite complex: from priming to plasticity?, 2005, 24(16): 2839–2850.
[18] Szodorai A, Kuan YH, Hunzelmann S, Engel U, Sakane A, Sasaki T, Takai Y, Kirsch J, Müller U, Beyreuther K, Brady S, Morfini G, Kins S. APP anterograde transport requires Rab3A GTPase activity for assembly of the transport vesicle, 2009, 29(46): 14534– 14544.
[19] Zhang K, Kenan RFB, Osakada Y, Xu W, Sinit RS, Chen L, Zhao XB, Chen JY, Cui BX, Wu CB. Defective axonal transport of Rab7 GTPase results in dysregulated trophic signaling., 2013, 33(17): 7451–7462.
[20] Deinhardt K, Salinas S, Verastegui C, Watson R, Worth D, Hanrahan S, Bucci C, Schiavo G. Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway., 2006, 52(2): 293–305.
[21] Binotti B, Pavlos NJ, Riedel D, Wenzel D, Vorbrüggen G, Schalk AM, Kühnel K, Boyken J, Erck C, Martens H, Chua JJE, Jahn R. The GTPase Rab26 links synaptic vesicles to the autophagy pathway., 2015, 4: e05597.
[22] Flament S, Delacourte A, Verny M, Hauw JJ, Javoy- Agid F. Abnormal Tau proteins in progressive supranuclearpalsy. Similarities and differences with the neurofibrillary degeneration of the Alzheimer type, 1991, 81(6): 591–596.
[23] Buggia-Prevot V, Fernandez CG, Riordan S, Vetrivel KS, Roseman J, Waters J, Bindokas VP, Vassar R, Thinakaran G. Axonal BACE1 dynamics and targeting in hippocampal neurons: A role for Rab11 GTPase., 2014, 9: 1.
[24] Udayar V, Buggia-Prévot V, Guerreiro RL, Siegel G, Rambabu N, Soohoo AL, Ponnusamy M, Siegenthaler B, Bali J, Simons M, Ries J, Puthenveedu MA, Hardy J, Thinakaran G, Rajendran L. A paired RNAi and RabGAP overexpression screen identifies Rab11 as a regulator of β-amyloid production, 2013, 5(6): 1536–1551.
[25] Sun ZZ, Xie YJ, Chen YT, Yang QH, Quan ZZ, Dai RJ, Qing H. Rab21, a novel PS1 interactor, regulates γ-secretase activityPS1 subcellular distribution, 2018, 55(5): 3841–3855.
[26] Udayar, V, Buggia-Prévot V, Guerreiro RL, Siegel G, Rambabu N, Soohoo AL, Ponnusamy M, Siegenthaler B, Bali J, Simons M, Ries J, Puthenveedu MA, Hardy J, Thinakaran G, Rajendran L. A paired RNAi and RabGAP overexpression screen identifies Rab11 as a regulator of β-amyloid production, 2013, 5(6): 1536–1551.
[27] Wang X. Pei G. Visualization of alzheimer’s disease related α-/β-/γ-secretase ternary complex by bimolecular fluorescence complementation based fluorescence resonance energy transfer., 2018, 11: 431.
[28] Huber LA, Pimplikar S, Parton RG, Virta H, Zerial M, Simons K. Rab8, a small GTPase involved in vesicular traffic between the TGN and the basolateral plasma membrane, 1993, 123(1): 35–45.
[29] Nachury MV, Loktev AV, Zhang QH, Westlake CJ, Per?nen J, Merdes A, Slusarski DC, Scheller RH, Bazan JF, Sheffield VC, Jackson PK. A core complex of BBS proteins cooperates with the GTPase Rab8 to promote ciliary membrane biogenesis,2007, 129(6): 1201– 1213.
[30] Shimohama S, Kamiya S, Taniguchi T, Sumida Y, Fujimoto S. Differential involvement of small G proteins in Alzheimer’s disease, 1999, 3(6): 597–600.
[31] Mohamed NV, Desjardins A, Leclerc N. Tau secretion is correlated to an increase of Golgi dynamics, 2017, 12(5): e0178288.
[32] Shen R, Zhao XB, He L, Ding YB, Xu W, Lin SZ, Fang S, Yang WL, Sung KJ, Spencer B, Rissman RA, Lei M, Ding JQ, Wu CB. Upregulation of RIN3 induces endosomal dysfunction in Alzheimer's disease., 2020, 9(1): 26.
[33] Brown TC, Tran IC, Backos DS, Esteban JA. NMDA receptor-dependent activation of the small GTPase Rab5 drives the removal of synaptic AMPA receptors during hippocampal LTD., 2005, 45(1): 81–94.
[34] Deininger K, Eder M, Kramer ER, Zieglg?nsberger W, Dodt HU, Dornmair K, Colicelli J, Klein R. The Rab5 guanylate exchange factor Rin1 regulates endocytosis of the EphA4 receptor in mature excitatory neurons, 2008, 105(34): 12539–12544.
[35] Hu XY, Crick SL, Bu GJ, Frieden C, Pappu RV, Lee JM. Amyloid seeds formed by cellular uptake, concentration, and aggregation of the amyloid-beta peptide., 2009, 106(48): 20324–20329.
[36] Rodriguez L, Mohamed NV, Desjardins A, Lippé R, Fon EA, Leclerc N. Rab7A regulates tau secretion, 2017, 141(4): 592–605.
[37] Wissel BD, Dwivedi AK, Merola A, Chin D, Jacob C, Duker AP, Vaughan JE, Lovera L, LaFaver K, Levy A, Lang AE, Morgante F, Nirenberg MJ, Stephen C, Sharma N, Romagnolo A, Lopiano L, Balint B, Yu XX, Bhatia KP, Espay AJ. Functional neurological disorders in Parkinson disease., 2018, 89(6): 566–571.
[38] Hur EM, Jang EH, Jeong GR, Lee BD. LRRK2 and membrane trafficking: nexus of Parkinson’s disease, 2019, 52(9): 533–539.
[39] Schapansky J, Khasnavis S, DeAndrade MP, Nardozzi JD, Falkson SR, Boyd JD, Sanderson JB, Bartels T, Melrose HL, LaVoie MJ. Familial knockin mutation of LRRK2 causes lysosomal dysfunction and accumulation of endogenous insoluble α-synuclein in neurons, 2018, 111: 26–35.
[40] Fleming J, Outeiro TF, Slack M, Lindquist SL, Bulawa CE. detection of compounds that rescue Rab1-synuclein toxicity,, 2008, 439: 339–351.
[41] Gon?alves SA, Macedo D, Raquel H, Sim?es PD, Giorgini F, Ramalho JS, Barral DC, Moita LF, Outeiro TF. ShRNA-based screen identifies endocytic recycling pathway components that act as genetic modifiers of alpha-synuclein aggregation, secretion and toxicity., 2016, 12(4): e1005995.
[42] Dinter E, Saridaki T, Nippold M, Plum S, Diederichs L, Komnig D, Fensky L, May C, Marcus K, Voigt A, Schulz JB, Falkenburger BH. Rab7 induces clearance of α-synuclein aggregates., 2016, 138(5): 758–774.
[43] Vilari?o-Güell C, Wider C, Ross OA, Dachsel JC, Kachergus JM, Lincoln SJ, Soto-Ortolaza AI, Cobb SA, Wilhoite GJ, Bacon JA, Behrouz B, Melrose HL, Hentati E, Puschmann A, Evans DM, Conibear E, Wasserman WW, Aasly JO, Burkhard PR, Djaldetti R, Ghika J, Hentati F, Krygowska-Wajs A, Lynch T, Melamed E, Rajput A, Rajput AH, Solida A, Wu RM, Uitti RJ, Wszolek ZK, Vingerhoets F, Farrer MJ. VPS35 mutations in Parkinson disease., 2011, 89(1): 162–167.
[44] Liu ZY, Bryant N, Kumaran R, Beilina A, Abeliovich A, Cookson MR, West AB. LRRK2 phosphorylates membrane-bound Rabs and is activated by GTP-bound Rab7L1 to promote recruitment to the trans-Golgi network, 2018, 27(2): 385–395.
[45] Steger M, Tonelli F, Ito G, Davies P, Trost M, Vetter M, Wachter S, Lorentzen E, Duddy G, Wilson S, Baptista MA, Fiske BK, Fell MJ, Morrow JA, Reith AD, Alessi DR, Mann M. Phosphoproteomics reveals that Parkinson's disease kinase LRRK2 regulates a subset of Rab GTPases., 2016, 5: e12813.
[46] Steger M, Diez F, Dhekne HS, Lis P, Nirujogi RS, Karayel O, Tonelli F, Martinez TN, Lorentzen E, Pfeffer SR, Alessi DR, Mann M. Systematic proteomic analysis of LRRK2-mediated Rab GTPase phosphorylation establishes a connection to ciliogenesis,2017, 6: e31012.
[47] Jeong GR, Jang EH, Bae JR, Jun S, Kang HC, Park CH, Shin JH, Yamamoto Y, Tanaka-Yamamoto K, Dawson VL, Dawson TM, Hur EM, Lee BD. Dysregulated phosphorylation of Rab GTPases by LRRK2 induces neurodegeneration., 2018, 13: 8.
[48] Eguchi T, Kuwahara T, Sakurai M, Komori T, Fujimoto T, Ito G, Yoshimura SI, Harada A, Fukuda M, Koike M, Iwatsubo T. LRRK2 and its substrate Rab GTPases are sequentially targeted onto stressed lysosomes and maintain their homeostasis., 2018, 115(39): E9115–E9124.
[49] Nakajo A, Yoshimura S, Togawa H, Kunii M, Iwano T, Izumi A, Noguchi Y, Watanabe A, Goto A, Sato T, Harada A. EHBP1L1 coordinates Rab8 and Bin1 to regulate apical-directed transport in polarized epithelial cells, 2016, 212(3): 297–306.
[50] Wang P, Liu H, Wang Y, Liu O, Zhang J, Gleason A, Yang ZR, Wang H, Shi AB, Grant BD. RAB-10 promotes EHBP-1 bridging of filamentous actin and tubular recycling endosomes., 2016, 12: e1006093.
[51] Bae EJ, Kim DK, Kim C, Mante M, Adame A, Rockenstein E, Ulusoy A, Klinkenberg M, Jeong GR, Bae JR, Lee C, Lee HeJ, Lee BD, Monte DAD, Masliah E, Lee SJ. LRRK2 kinase regulates α-synuclein propagationRAB35 phosphorylation., 2018, 9(1): 3465.
[52] Hsu C, Morohashi Y, Yoshimura S, Manrique-Hoyos N, Jung S, Lauterbach MA, Bakhti M, Gr?nborg M, M?bius W, Rhee J, Barr FA, Simons M. Regulation of exosome secretion by Rab35 and its GTPase-activating proteins TBC1D10A–C, 189, 223–232 (2010), 2010.
[53] Bae EJ, Lee SJ. The LRRK2-RAB axis in regulation of vesicle trafficking and α-synuclein propagation, 2020, 1866(3): 165632.
[54] Zarei S, Carr K, Reiley L, Diaz K, Guerra O, Altamirano PF, Pagani W, Lodin D, Orozco G, Chinea A. A comprehensive review of amyotrophic lateral sclerosis, 2015, 6: 171.
[55] Soo KY, Halloran M, Sundaramoorthy V, Parakh S, Toth RP, Southam KA, McLean CA, Lock P, King A, Farg MA, Atkin JD. Rab1-dependent ER-Golgi transport dysfunction is a common pathogenic mechanism in SOD1, TDP-43 and FUS-associated ALS., 2015, 130(5): 679–697.
[56] Tsuda H, Han SM, Yang YF, Tong C, Lin YQ, Mohan K, Haueter C, Zoghbi A, Harati Y, Kwan J, Miller MA, Bellen HJ. The amyotrophic lateral sclerosis 8 protein VAPB is cleaved, secreted, and acts as a ligand for Eph receptors, 2008, 133(6): 963–977.
[57] Farg MA, Sundaramoorthy V, Sultana JM, Yang S, Atkinson RA, Levina V, Halloran MA, Gleeson PA, Blair IP, Soo KY, King AE, Atkin JD. C9ORF72, implicated in amytrophic lateral sclerosis and fronto-temporal dementia, regulates endosomal trafficking, 2014, 23(13): 3579–3595.
[58] Topp JD, Gray NW, Gerard RD, Horazdovsky BF. Alsin is a Rab5 and Rac1 guanine nucleotide exchange factor, 2004, 279(23): 24612–24623.
[59] Farg MA, Sundaramoorthy V, Sultana JM, Yang S, Atkinson RA, Levina V, Halloran MA, Gleeson PA, Blair IP, Soo KY, King AE, Atkin JD. C9ORF72, implicated in amytrophic lateral sclerosis and fronto-temporal dementia, regulates endosomal trafficking, 2014, 23(13): 3579–3595.
[60] Deshpande M, Feiger Z, Shilton AK, Luo CC, Silverman E, Rodal AA. Role of BMP receptor traffic in synaptic growth defects in an ALS model., 2016, 27(19): 2898–2910.
[61] Djoussé L, Knowlton B, Hayden M, Almqvist EW, Brinkman R, Ross C, Margolis R, Rosenblatt A, Durr A, Dode C, Morrison PJ, Novelletto A, Frontali M, Trent RJA, McCusker E, Gómez-Tortosa E, Mayo D, Jones R, Zanko A, Nance M, Abramson R, Suchowersky O, Paulsen J, Harrison M, Yang Q, Cupples LA, Gusella JF, MacDonald ME, Myers RH. Interaction of normal and expanded CAG repeat sizes influences age at onset of Huntington disease, 2003, 119A(3): 279–282.
[62] Graham SF, Kumar PK, Bjorndahl T, Han B, Yilmaz A, Sherman E, Bahado-Singh RO, Wishart D, Mann D, Green BD. Metabolic signatures of Huntington's disease (HD):1H NMR analysis of the polar metabolome in post-mortem human brain, 2016, 1862(9): 1675–1684.
[63] Sahlender DA, Roberts RC, Arden SD, Spudich G, Taylor MJ, Luzio JP, Kendrick-Jones J, Buss F. Optineurin links myosin VI to the Golgi complex and is involved in Golgi organization and exocytosis, 2005, 169(2): 285–295.
[64] del Toro D, del Toro D, Alberch J, Lázaro-Diéguez F, Martín-Ibá?ez R, Xifró X, Egea G, Canals JM. Mutant huntingtin impairs post-Golgi trafficking to lysosomes by delocalizing optineurin/Rab8 complex from the Golgi apparatus, 2009, 20(5): 1478– 1492.
[65] Pal A, Severin F, Lommer B, Shevchenko A, Zerial M. Huntingtin-HAP40 complex is a novel Rab5 effector that regulates early endosome motility and is up- regulated in Huntington's disease, 2006, 172(4): 605–618.
[66] Ravikumar B, Imarisio S, Sarkar S, O'Kane CJ, Rubinsztein DC. Rab5 modulates aggregation and toxicity of mutant huntingtin through macroautophagy in cell and fly models of Huntington disease., 2008, 121(Pt 10): 1649–1660.
[67] Li XY, Standley C, Sapp E, Valencia A, Qin ZH, Kegel KB, Yoder J, Comer-Tierney LA, Esteves M, Chase K, Alexander J, Masso N, Sobin L, Bellve K, Tuft R, Lifshitz L, Fogarty K, Aronin N, DiFiglia M. Mutant huntingtin impairs vesicle formation from recycling endosomes by interfering with Rab11 activity., 2009, 29(22): 6106–6116.
[68] Richards P, Didszun C, Campesan S, Simpson A, Horley B, Young KW, Glynn P, Cain K, Kyriacou CP, Giorgini F, Nicotera P. Dendritic spine loss and neurodegeneration is rescued by Rab11 in models of Huntington’s disease., 2011, 18(2): 191–200.
[69] Her LS, Goldstein LSB. Enhanced sensitivity of striatal neurons to axonal transport defects induced by mutant huntingtin., 2008, 28(50): 13662–13672.
[70] Richards P, Didszun C, Campesan S, Simpson A, Horley B, Young KW, Glynn P, Cain K, Kyriacou CP, Giorgini F, Nicotera P. Dendritic spine loss and neurodege-neration is rescued by Rab11 in models of Huntington's disease., 2011, 18(2): 191–200.
[71] De Luca A, Progida C, Spinosa MR, Alifano P, Bucci C. Characterization of the Rab7K157N mutant protein associated with Charcot–Marie-Tooth type 2B., 2008, 372(2): 283–287.
[72] Saxena S, Bucci C, Weis J, Kruttgen A. The small GTPase Rab7 controls the endosomal trafficking and neuritogenic signaling of the nerve growth factor receptor TrkA., 2005, 25(47): 10930–10940.
[73] Bronfman, FC, Escudero CA, Weis J, Kruttgen A. Endosomal transport of neurotrophins: roles in signaling and neurodegenerative diseases., 2007, 67(9): 1183–1203.
[74] Moises T, Dreier A, Flohr S, Esser M, Brauers E, Reiss K, Merken D, Weis J, Krüttgen A. Tracking TrkA’s trafficking: NGF receptor trafficking controls NGF receptor signaling., 2007, 35(2): 151– 159.
[75] Progida C, Cogli L, Piro F, De Luca A, Bakke O, Bucci C. Rab7b controls trafficking from endosomes to the TGN, 2010. 123(9): 1480.
[76] Progida C, Maler?d L, Stuffers S, Brech A, Bucci C, Stenmark H. RILP is required for the proper morphology and function of late endosomes, 2007, 120(21): 3729–3737.
[77] Ye X, Sun XQ, Starovoytov V, Cai Q. Parkin-mediated mitophagy in mutant hAPP neurons and Alzheimer's disease patient brains, 2015, 24(10): 2938–2951.
[78] Moore AS, Holzbaur ELF. Dynamic recruitment and activation of ALS-associated TBK1 with its target optineurin are required for efficient mitophagy, 2016, 113(24): E3349–E3358.
[79] Yamano K, Fogel AI, Wang CX, van der Bliek AM, Youle RJ. Mitochondrial Rab GAPs govern autopha-gosome biogenesis during mitophagy., 2014, 3: e01612.
[80] Yamano K, Wang CX, Sarraf SA, Münch C, Kikuchi R, Noda NN, Hizukuri Y, Kanemaki MT, Harper W, Tanaka K, Matsuda N, Youle RJ. Endosomal Rab cycles regulate Parkin-mediated mitophagy, 2018, 7: e31326.
[81] Alto NM, Soderling J, Scott JD. Rab32 is an A-kinase anchoring protein and participates in mitochondrial dynamics., 2002, 158(4): 659–668.
[82] Minowa-Nozawa A, Nozawa T, Okamoto-Furuta K, Kohda H, Nakagawa I. Rab35 GTPase recruits NDP52 to autophagy targets, 2017, 36(18): 2790–2807.
[83] Minkiewicz J, de Rivero Vaccari JP, Keane RW. Human astrocytes express a novel NLRP2 inflammasome., 2013, 61(7): 1113–1121.
[84] Koenigsknecht J, Landreth G. Microglial phagocytosis of fibrillar beta-amyloid through a beta1 integrin- dependent mechanism., 2004, 24(44): 9838– 9846.
[85] Hong S, Beja-Glasser VF, Nfonoyim BM, Frouin A, Li SM, Ramakrishnan S, Merry KM, Shi QQ, Rosenthal A, Barres BA, Lemere CA, Selkoe DJ, Stevens B. Complement and microglia mediate early synapse loss in Alzheimer mouse models.,, 2016, 352(6286): 712–716.
[86] Diniz LP, Almeida JC, Tortelli V, Vargas Lopes C, Setti-Perdig?o P, Stipursky J, Kahn SA, Rom?o LF, de Miranda J, Alves-Leon SV, de Souza JM, Castro NG, Panizzutti R, Gomes FC. Astrocyte-induced synapto-genesis is mediated by transforming growth factor β signaling through modulation of D-serine levels in cerebral cortex neurons, 2012, 287(49): 41432–41445.
[87] Drukarch B, Schepens E, Stoof JC, Langeveld CH, Van Muiswinkel FL. Astrocyte-enhanced neuronal survival is mediated by scavenging of extracellular reactive oxygen species., 1998, 25(2): 217–220.
[88] Mulligan SJ, MacVicar BA. Calcium transients in astrocyte endfeet cause cerebrovascular constrictions, 2004, 431(7005): 195–199.
[89] Liddelow SA, Barres BA. Reactive astrocytes: production, function, and therapeutic potential., 2017, 46(6): 957–967.
[90] Clarke LE, Liddelow SA, Chakraborty C, Münch AE, Heiman M, Barres BA. Normal aging induces A1-like astrocyte reactivity, 2018, 115(8): E1896–E1905.
[91] Yun SP, Kam T, Panicker N, Kim S, Oh Y, Park J, Kwon S, Park YJ, Karuppagounder SS, Park H, Kim S, Oh N, Kim NA, Lee S, Brahmachari S, Mao XB, Lee JH, Kumar M, An D, Kang S, Lee Y, Lee KC, Na DH, Kim D, Lee SH, Roschke VV, Liddelow SA, Mari Z, Barres BA, Dawson VL, Lee S, Dawson TM, Ko HS. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson’s disease., 2018, 24(7): 931–938.
[92] Koistinaho M, Lin SZ, Wu X, Esterman M, Koger D, Hanson J, Higgs R, Liu F, Malkani S, Bales KR, Paul SM. Apolipoprotein E promotes astrocyte colocalization and degradation of deposited amyloid-beta peptides, 2004, 10(7): 719–726.
[93] Lin YT, Seo J, Gao F, Feldman HM, Wen HL, Penney J, Cam HP, Gjoneska E, Raja WK, Cheng J, Rueda R, Kritskiy O, Abdurrob F, Peng ZY, Milo B, Yu CJ, Elmsaouri S, Dey D, Ko T, Yankner BA, Tsai LH. APOE4 causes widespread molecular and cellular alterations associated with alzheimer’s disease phenotypes in human iPSC-derived brain cell types., 2018, 98(6): 1141–1154.e7.
[94] Holler CJ, Webb RL, Laux AL, Beckett TL, Niedowicz DM, Ahmed RR, Liu YX, Simmons CR, Dowling ALS, Spinelli A, Khurgel M, Estus S, Head E, Hersh LB, Murphy MP. BACE2 expression increases in human neurodegenerative disease, 2012, 180(1): 337–350.
[95] Lindstr?m V, Gustafsson G, Sanders LH, Howlett EH, Sigvardson J, Kasrayan A, Ingelsson M, Bergstr?m J, Erlandsson A. Extensive uptake of α-synuclein oligomers in astrocytes results in sustained intracellular deposits and mitochondrial damage, 2017, 82: 143–156.
[96] Braidy N, Gai WP, Xu YH, Sachdev P, Guillemin GJ, Jiang XM, Ballard JWO, Horan MP, Fang ZM, Chong BH, Chan DKY. Uptake and mitochondrial dysfunction of alpha-synuclein in human astrocytes, cortical neurons and fibroblasts, 2013, 2(1): 20.
[97] Lee HJ, Suk JE, Patrick C, Bae EJ, Cho JH, Rho S, Hwang D, Masliah E, Lee SJ. Direct transfer of α-synuclein from neuron to astroglia causes inflamma-tory responses in synucleinopathies, 2010, 285(12): 9262–9272.
[98] Iliff JJ, Chen MJ, Plog BA, Zeppenfeld DM, Soltero M, Yang L, Singh I, Deane R, Nedergaard M. Impairment of glymphatic pathway function promotes tau pathology after traumatic brain injury, 2014, 34(49): 16180–16193.
[99] Singhrao SK, Thomas P, Wood JD, MacMillan JC, Neal JW, Harper PS, Jones AL. Huntingtin protein colocalizes with lesions of neurodegenerative diseases: An investigation in Huntington's, Alzheimer's, and Pick's diseases, 1998, 150(2): 213–222.
[100] Shin JY, Fang ZH, Yu ZX, Wang CE, Li SH, Li XJ. Expression of mutant huntingtin in glial cells contributes to neuronal excitotoxicity, 2005, 171(6): 1001–1012.
[101] Ng EL, Ng JJ, Liang F, Tang BL. Rab22B is expressed in the CNS astroglia lineage and plays a role in epidermal growth factor receptor trafficking in A431 cells., 2009, 221(3): 716–728.
[102] Chua CEL, Goh ELK, Tang BL. Rab31 is expressed in neural progenitor cells and plays a role in their differentiation., 2014, 588(17): 3186-3194.
[103] Díaz J, Quest A, Leyton L. Increased expression of αvβ3 integrin in reactive astrocytes is controlled by the Rab endocytic pathway., 2019, 29: S462–S463.
The roles of Rab protein family in neurological diseases
Anping Wu, Hong Qing, Zhenzhen Quan
,,,
The intracellular membrane trafficking is a complicated pathway network. Rab GTPases are key regulators of membrane trafficking that are generally considered as specific markers and indicators of various organelles and membrane trafficking in endocytic and secretory pathways. Dysfunction in axonal and endosomal transport related to Rab proteins is one of the most important causes of neurodegenerative diseases. In this review, we mainly introduce how the Rab proteins change in different neurodegenerative diseases and their regulatory roles in the pathological mechanisms of related diseases. We also discuss the relationships between mitochondrial and glial cell dysfunctions and Rab proteins. Further exploration of the regulatory roles of Rab proteins will shed lights on revealing the pathogenic mechanisms of neurological diseases and providing potential targets for the early diagnosis and treatment of neurological diseases.
Rab proteins; neurological diseases; membrane trafficking; mitochondria; astrocytes
2020-11-17;
2021-01-06
國家自然科學基金項目(編號:81701260)資助[Supported by the National Natural Science Foundation of China (No. 81701260)]
吳安平,在讀碩士研究生,專業方向:生物工程。E-mail: 18801361945@163.com
全貞貞,博士,副研究員,研究方向:阿爾茨海默病的分子機制。E-mail: qzzbit2015@bit.edu.cn
10.16288/j.yczz.20-318
2021/1/13 13:37:12
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20210112.1032.001.html
(責任編委: 史岸冰)

