兩種銅卟啉金屬有機框架對小鼠乳腺癌細胞的光動力作用
江倩倩, 邵福平, 張孟孟, 楊 曄,2,3, 尹登科,2,3
(1. 安徽中醫藥大學 藥學院,安徽 合肥 230012; 2. 安徽省中醫藥科學院 藥物制劑研究所,安徽 合肥 230012;3. 安徽省教育廳 現代藥物制劑工程技術研究中心,安徽 合肥 230012)
光動力療法(Photodynamic Therapy, PDT)是一種新興的癌癥治療技術[1-3],它是指在特定波長的光照射下,光敏劑將光能轉移給組織氧,產生以單線態氧為主的活性氧物質(Reactive Oxygen Species, ROS)進而誘導腫瘤細胞凋亡的過程[4-7]。其治療效果主要受腫瘤部位氧氣濃度的影響,然而,大多數腫瘤組織的乏氧性質極大地限制了PDT的效率[8-10],并且腫瘤在缺氧過程中,會產生H2O2等不良代謝物,這些代謝物會促進腫瘤細胞的轉移[11]。近年來,有研究發現[12-14],過氧化氫酶及部分金屬化合物可通過催化腫瘤微環境中的H2O2,實現催化產氧,改善光動力治療效果。另外,由于以5,10,15,20-四(4-吡啶基)卟啉為配體制備的金屬-有機框架(Metal-Organic Frameworks,MOFs)具有光敏性好,熱穩定,不易淬滅等特點,也常被用于光動力治療中[15-17]。
因此,本文以5,10,15,20-四(4-吡啶基)卟啉為原料,采用分層法與溶劑熱法分別制備MOF1和MOF2,對其結構和形貌進行表征。并將其應用于腫瘤光動力治療中,考察兩種材料對內源性H2O2的催化產氧作用,及在光動力作用下對4T1細胞的抑制作用。
1 實驗部分
1.1 儀器與試劑
SPECORD S600型紫外可見分光度計;Thermo Fisher Nicolet 6700型紅外光譜儀(KBr壓片);PHILIPS PANalytical X’Pert 型X-射線衍射儀;Hitachi HT-7700型透射電子顯微鏡;Sirion 200型掃描電子顯微鏡。
5,10,15,20-四(4-吡啶基)卟啉,鄭州艾克姆化工有限公司;其余所用試劑均為分析純。
1.2 合成制備
(1) 分層法制備MOF1[18]
稱取氯化銅85.24 mg(0.5 mmol)加至50 mL甲醇中,再稱取H2TPyP 70 mg(0.1 mmol)加至50 mL氯仿中溶解后,各取10 mL混合均勻,室溫下避光反應24 h。離心15 min,真空干燥得紫紅色粉末狀MOF1 12.13 mg,收率89.2%;UVλmax: 424, 555, 594 nm; IRν: 3090(C—H), 2920(C—H), 1610(C=C), 1350(C=N), 972(Cu—N), 815(C—H), 715(C—H) cm-1; 晶胞參數a=13.636(3) ?,b=13.636(3) ?,c=19.467(4) ?,α=90°,β=90°,γ=90°。
(2) 溶劑熱法制備MOF2[19]
稱取H2TPyP 618 mg(0.1 mmol)與乙酸銅一水合物1.0 g(0.5 mmol)溶于50 mL乙酸中,125 ℃恒溫回流6 h。蒸發除溶劑后,將所得混合物加入50 mL水中,室溫攪拌30 min并加入0.5 mL吡啶。經三氯甲烷多次萃取,水浴蒸干即得紫紅色粉末狀MOF2 65.07 mg,收率95.7%;UVλmax: 420, 540, 587.5; IRν: 3320(—CH3), 3020(C—H), 2923(C—H), 1590(C=C), 1350(C=N), 970(Cu—N), 810(C—H), 725(C—H) cm-1; 晶胞參數a=b=96.3568 ?,c=12.9808 ?,α=90°,β=90°,γ=120°。
1.3 催化過氧化氫
37℃下在含H2O2(20 mmol·L-1)的Tris-HCl緩沖液(pH=7.4, 10 mmol·L-1)中加入MOF1和MOF2粉末(300 μg·mL-1)。分別在0、 10、 20、 30、 60和90 min時,將混合物離心,取上清液置于石英比色皿中,使用紫外全波長進行檢測。
1.4 1O2的制備
精密稱取DPBF 0.15 mg,溶解于0.5 mL DMSO中。用脫氣處理后的19.5 mL Tris-HCl(pH=7.4, 10 mmol·L-1)將DPBF溶液稀釋至7.5 μg·mL-1。再將10 mg MOF1和MOF2粉末分別加入含DPBF的Tris-HCl緩沖液中,超聲分散。以同等體積的DMSO與Tris-HCl緩沖液混合制備參比溶液進行校零。
經532 nm的激光照射0、 30、 60、 90、 120和150 s后取樣,使用紫外分光光度計檢測350 ~ 500 nm處DPBF的吸光度。
1.5 細胞毒性
采用MTT法測試了材料在523 nm的激光照射(200 mW·cm-2, 10 min)下對小鼠乳腺癌細胞(4T1)的光動力作用[20]。
1.6 ROS生成
采用2′,7′-二氯熒光黃雙乙酸鹽作為熒光探針對銅卟啉金屬有機框架細胞內ROS產生能力的考察。以 2×105個細胞/孔的密度將4T1細胞接種于鋪有無菌細胞爬片的24孔板中,分別設置對照組、MOF1組、MOF2組、MOF1+H2O2(1 mM)組、MOF2+H2O2(1 mM)組。培養24 h后,移去原培養基,加入相應制劑繼續孵育24 h。棄去原培養基, 每孔再加入 DCFH-DA 溶液(1 mL, 10 μM)孵育30 min,經532 nm激光照射(200 mW·cm-2, 2 min)后,PBS清洗3遍,用多聚甲醛固定細胞30 min后,DAPI染核5 min ,甘油封片,熒光顯微鏡下觀察拍照,并用ImageJ軟件分析細胞內熒光強度。
2 結果與討論
2.1 銅卟啉金屬有機框架物
由銅卟啉金屬有機框架的紅外光譜可見,H2TPyP在3347 cm-1有卟吩環上的N—H伸縮振動吸收峰,MOF1與MOF2中無此吸收峰,這是由Cu2+與H2TPyP配位取代了卟吩內環上的兩個H所致。另外,由于金屬離子進入卟啉環內形成配合物后,卟啉環上的對稱性提高,MOF1、 MOF2相對于H2TPyP來說,其紫外光譜表現為Q帶吸收峰的個數減少,Soret帶發生紅移。

圖1(A~B)MOF1和MOF2的TEM圖;(C~D)MOF1和MOF2的SEM圖
從TEM和SEM的結果(見圖1和圖2)可看出,MOF1呈八面體狀,粒徑約為100 nm, MOF2呈厚片狀,尺寸約為1 μm。
2.2 銅卟啉金屬有機框架催化過氧化氫的能力
為考察MOF1和MOF2是否能夠催化過氧化氫產生氧氣。分別在H2O2中加入相同量的MOF1和MOF2,反應一段時間后,測定兩組剩余的H2O2紫外吸收。結果見圖2,加入銅卟啉金屬有機框架后,隨著時間的增加,H2O2紫外吸收峰強度逐漸降低,且MOF1的降低程度均大于MOF2。結果表明,銅卟啉金屬有機框架具有催化H2O2分解生成O2的能力,且MOF1催化H2O2的能力大于MOF2。

/nm
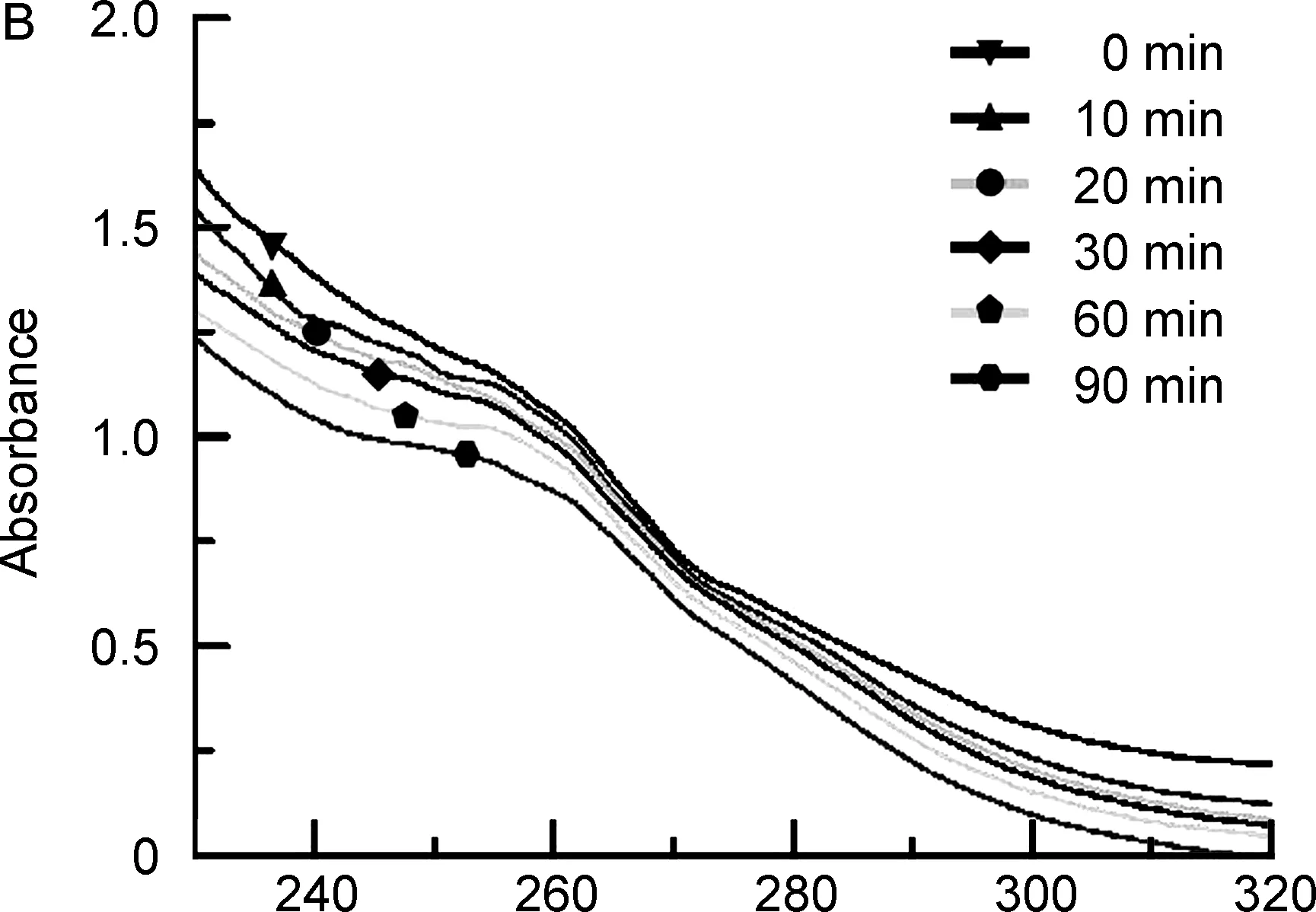
/nm
2.3 銅卟啉金屬有機框架在光照下產生1O2的能力
DPBF是一種1O2捕獲劑,當被1O2氧化后,其在426 nm左右的吸光度顯著降低,故目前被廣泛用于衡量產生1O2的能力(圖3), 150 s內MOF1組吸光度值降低了0.2950而MOF2組吸光度值降低了0.1689。結果表明:MOF1和MOF2均可通過催化H2O2產氧來增強1O2的生成能力,且MOF1的催化能力更強。
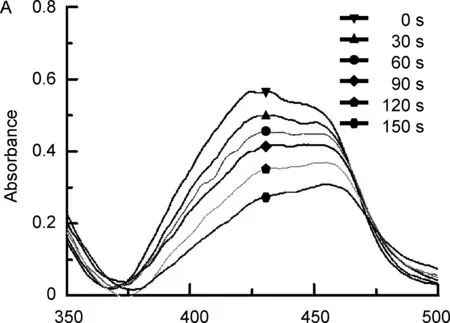
/nm
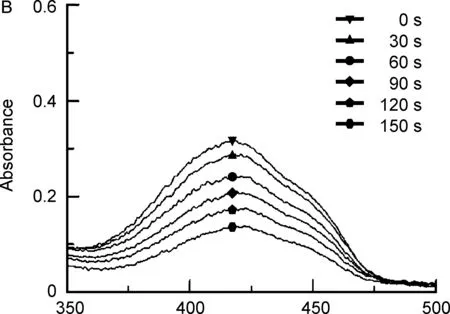
/nm
2.4 銅卟啉金屬有機框架對4T1的細胞毒性
MTT實驗結果見圖4,對材料組添加光照后,隨著其濃度的增加,MOF1或MOF2的細胞毒性均逐漸增強,且當濃度 ≥12.5 μg·mL-1,MOF1的細胞光毒性大于MOF2(P<0.001)。
2.5 銅卟啉金屬有機框架細胞內ROS產生能力
DCFH-DA是檢測細胞內ROS水平的熒光探針,其本身沒有熒光,可自由穿過細胞膜。進入細胞后,可被細胞內的酯酶水解成DCFH,而DCFH無法透過細胞膜,因此易積聚在細胞內,細胞內的ROS可將無熒光的DCFH 氧化生成有綠色熒光的DCF。由于細胞內H2O2濃度較低,為方便對比催化效果,實驗時添加了外源H2O2。如圖5所示,MOF1+H2O2組、MOF2+H2O2組有較強的綠色熒光,且前者熒光強度大于后者(P<0.001)。說明加入的銅卟啉金屬有機框架主要是通過催化H2O2來提高細胞內活性氧的產生水平,且MOF1催化H2O2能力大于MOF2。
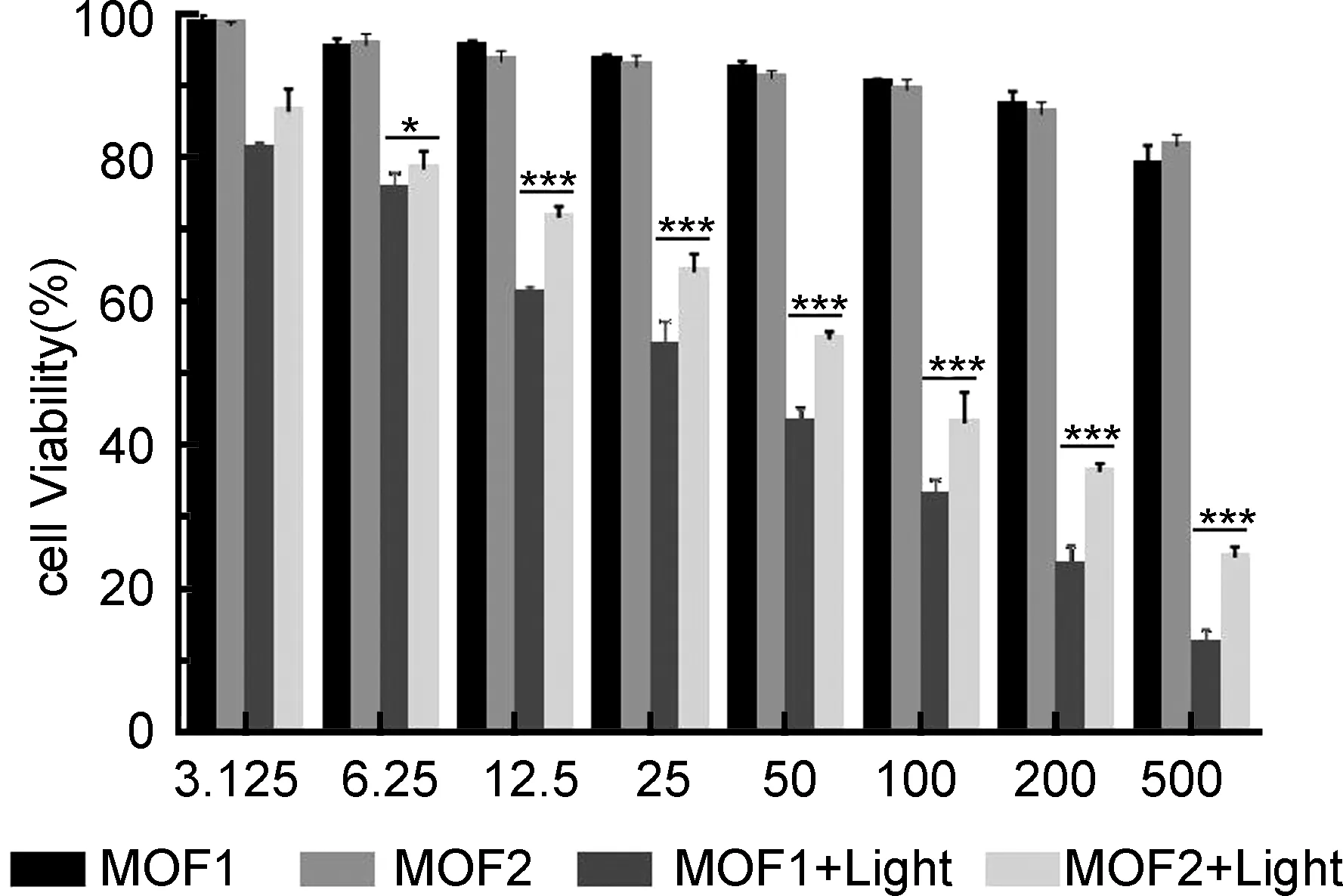
μg/mL圖4MOF1和MOF2在有無光照時對4T1細胞活力的影響作用。
以5,10,15,20-四(4-吡啶基)卟啉為原料,采用分層法與溶劑熱法制備了兩種銅卟啉金屬有機框架材料(MOF1和MOF2)。實驗結果顯示:兩種材料均具有過氧化氫催化能力,可有效改善4T1細胞的缺氧狀態,且在光動力作用下MOF1對4T1細胞的毒性作用強于MOF2(P<0.001)。

