干細胞治療阿爾茨海默病的現狀及展望
羅 靜,紀瓊瓊,王培軍
(同濟大學附屬同濟醫院醫學影像科,上海 200333)
阿爾茨海默病(Alzheimer’s disease,AD)是一種隱匿起病、進行性發展的神經退行性疾病,臨床上以記憶障礙、失語、失用、失認、視空間技能損害、執行功能障礙以及人格和行為改變等全面性癡呆表現為特征,病因迄今未明。由阿爾茨海默病導致的癡呆患者數量占所有癡呆患者數量的60%-80%。世界阿爾茨海默病2018年度報告指出全球每3秒鐘就有一例癡呆患者產生,2018年世界范圍的癡呆患者數量大約有5000萬,2050年這一數字有望達到1.52億。目前,我們仍不清楚AD的具體發病機制,臨床上尚無防治措施,常用藥多奈哌齊、加蘭他敏等僅用于疾病早期延緩AD進展。隨著干細胞技術及細胞移植治療的快速發展,干細胞的多向分化和增殖能力為阿爾茨海默病患者帶來了新的希望。本文就AD的干細胞治療展開綜述, 報告如下。
1 阿爾茨海默病的病理生理學
細胞外的β淀粉樣蛋白(β-amyloid,Aβ)沉積和細胞內的神經纖維纏結是AD的病理特征,此外還有突觸功能受損、神經炎癥等等。
Aβ蛋白生成與清除的失衡所導致的Aβ蛋白沉積是AD病理過程的中心環節[1]。Aβ蛋白由跨膜的淀粉樣前體蛋白(amyloid precursor protein,APP)經過β分泌酶和γ分泌酶的剪切形成并釋放到細胞外,而后經過結構修飾獲得β折疊結構和相應的π-π堆積,形成多種形式的聚合體,其中可溶性寡聚體具有神經毒性,影響突觸功能且降低突觸數量,并可逐步沉積為不可溶的大纖維。Aβ蛋白沉積引發其他因子參與完成AD的病理改變,其誘導細胞內的微管相關蛋白tau蛋白高度磷酸化,形成神經纖維纏結,導致微管失去正常結構,神經元細胞骨架瓦解,造成突觸和神經元丟失[2];此外,膠質細胞聚集在細胞外Aβ淀粉斑塊周圍,引發神經炎癥,致使吞噬功能失調;腦啡肽酶、胰島素降解酶和血管緊張素轉換酶I等降解Aβ蛋白的酶活性減低,都使Aβ蛋白清除減少,Aβ蛋白持續沉積,最終造成認知功能下降和記憶缺損[1-3]。
2 阿爾茨海默病的藥物治療
AD的發病機制目前仍不清楚,目前比較流行的有Aβ淀粉樣肽級聯假說、膽堿能神經元損傷假說、神經炎癥假說、基因異常假說。針對不同的假說,已經開發出很多藥物并應用于臨床。抗AD藥物的研發主要有以下三個目標:①抗氧化;②清除大腦中的Aβ沉積物,延遲認知損傷;③調節tau蛋白的磷酸化,減少錯誤折疊和異常聚集[4-6]。乙酰膽堿酯酶(Ach E)抑制劑目前仍是AD治療的一線藥物。美國FDA已經批準多奈哌齊、卡巴拉汀和加蘭他敏作為臨床一線用藥。其中多奈哌齊 (Donepezil) 用于治療輕-中度AD(Mild to Moderate AD), 對中樞神經系統的乙酰膽堿酯酶具有更高的選擇性, 抑制酶的活性,持續時間長且沒有外周作用, 能顯著提高中樞神經系統乙酰膽堿濃度,從而改善認知功能[7]。興奮性氨基酸(NMDA)受體抑制劑鹽酸美金剛于2003年被美國FDA批準用于治療中-重度AD,防止NMDA受體的細胞內鈣超載,調節谷氨酸等興奮性遞質,阻止谷氨酸濃度增加而導致的神經元損傷,從而提高患者生活質量。此外多種抗氧化劑、中藥、非甾體抗炎藥等也都有用于治療AD,但療效還有待進一步評估。
3 阿爾茨海默病的干細胞治療
干細胞是來自于胚胎、胎兒或成體內具有在一定條件下無限制自我更新與增殖分化能力的一類細胞,能夠產生表現型與基因型和自己完全相同的子細胞,也能產生組成機體組織、器官的已特化的細胞,同時還能分化為祖細胞。目前用于移植治療阿爾茨海默病的常見干細胞種類有神經干細胞,間充質干細胞,誘導性多能干細胞。
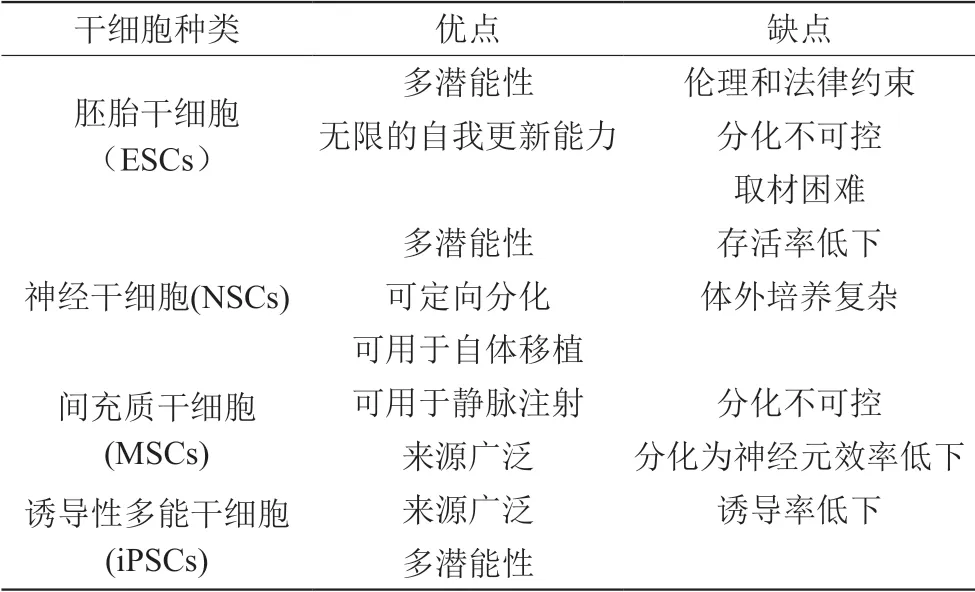
表1 不同種類干細胞治療AD的優缺點總結
大量的研究已經證實,移植的干細胞能夠在腦內存活,并與宿主腦神經融合,改善阿爾茨海默病模型小鼠的學習記憶能力。Zhang等人將成人外周血液中的單核細胞重編程為iNPCs,隨后將攜帶綠色熒光蛋白的iNPCs立體定位注射到免疫缺陷小鼠的雙側海馬區,隨后借助激光掃描共聚焦顯微鏡觀察移植細胞的形態分布,發現移植入海馬區的iNPCs會迅速停止增殖,并在宿主海馬中分化為神經元和星形膠質細胞,由iNPCs來源的神經元在宿主體內至少存活了12個月,且形成較長的軸突并與宿主海馬整合。通過電生理和光遺傳學檢測發現移植細胞和宿主神經元之間形成了功能性的突觸連接,Y迷宮和Barnes迷宮發現小鼠的學習和記憶能力明顯改善[8]。
3.1 胚胎干細胞(ESCs)
胚胎干細胞具有巨大的分化潛力,可以分化為體內幾乎所有細胞,加上它的無限的自我更新能力使得胚胎干細胞成為細胞移植治療的優選項,但胚胎干細胞只能從胚胎5-6天的囊胚中分離,使得胚胎干細胞的應用具有極大的爭議,倫理學和法律限制了其應用[9]。基底前腦膽堿能系統在信息處理和認知功能中發揮關鍵作用。Yue等人將ESCs來源的基底前腦膽堿能神經元祖細胞移植到轉基因AD小鼠的雙側海馬區,兩個月后發現移植的細胞已經分化為成熟的膽堿能神經元,并且在結構和功能上整合進入AD小鼠的內源膽堿能投射系統中,Morris水迷宮顯示細胞移植兩個月后小鼠的認知能力得到改善[10]。
3.2 神經干細胞(NSCs)
神經干細胞主要存在于海馬齒狀回(DG)及側腦室下層(SVZ),因其能夠分化為神經元、星形膠質細胞、少突膠質細胞等神經細胞,因此是治療神經退行性疾病的理想細胞。Lee等將人源的神經干細胞(hNSCs)移植入NSE/APP轉基因AD模型鼠雙側腦室,在移植后第5周、第6周、第12周利用水迷宮檢測小鼠穿越站臺次數以及在站臺停留時間,結果顯示,hNSCs移植改善了模型小鼠的空間記憶障礙,但不能預防轉基因小鼠的長期進行性認知缺陷。通過免疫組化、蛋白印跡實驗、ELISA等證實了移植神經干細胞能夠減少模型小鼠中Aβ斑塊和磷酸化的Tau。hNSCs能使小膠質細胞失活而減少炎癥介質表達,同時自身分泌抗炎因子減輕AD的神經炎癥。hNSCs還通過營養供給促進了突觸可塑性和抗凋亡功能[11]。
3.3 間充質干細胞(MSCs)
間充質干細胞是一類可以從多種器官中分離出來的多能干細胞,例如骨髓(BM-MSC),臍帶(UCB-MSC),脂肪組織(AD-MSC),外周血,羊水等等[12]。間充質干細胞易于獲取,具有高度增殖能力且可以穿過血腦屏障使得其在臨床和科研中應用非常廣泛。類似于其它干細胞類型,MSCs移植可以降低淀粉樣蛋白沉積和Tau的磷酸化,改善學習記憶能力,通過上調抗炎因子,下調促炎因子來調節神經炎癥。
3.4 誘導性多能干細胞(iPSCs)
誘導性多能干細胞最早由日本京都大學Shinya Yamanaka教授提出,他的團隊將攜帶Oct3/4、Sox2、c-Myc和Klf4四種轉錄因子的基因克隆入病毒載體,然后引入小鼠成纖維細胞(MEF),發現MEF可以轉分化為干細胞,產生的iPS細胞在形態、基因、和蛋白表達等方面與胚胎干細胞相似,我們將這類細胞稱為誘導性多能干細胞[13]。iPSCs成功避免了倫理問題,可以利用自體來源的細胞重編程來獲得干細胞,避免了移植后的免疫反應。但誘導性多能干細胞誘導率低下,轉分化周期長限制了其應用,目前僅停留在研究階段。
4 干細胞治療的機遇與挑戰
4.1 治療標準尚未建立
目前對于干細胞治療,行業內未形成統一的行業規范,對于AD模型鼠、移植干細胞種類,移植細胞數量,注射部位及相應腦區,注射方法,評價手段都未形成可靠的參考標準,這樣造成數據的推廣受限,臨床應用受限。
4.2 干細胞治療的具體機制仍有待研究
大量的研究已經表明干細胞移植后能夠明顯改善小鼠的學習記憶能力,移植后的干細胞能夠在腦內分化,形成新的神經元,并與宿主腦神經形成功能網絡,與宿主的神經元形成功能性的突觸連接,但對于AD病理標志物影響的報道并不多見,且通過何種機制改善宿主的學習記憶能力,目前僅有行為學測試Morris 水迷宮并不能很清晰地解釋這一機制。
4.3 干細胞治療具有廣闊的前景
目前造血干細胞在血液系統疾病已經取得了巨大的成功,干細胞移植后增加多巴胺釋放從而治療帕金森病也已經被證實,干細胞的成功應用說明了其巨大的應用前景,在探索的過程中我們需要不斷的細化深入研究,闡明干細胞移植具體機理,從而為干細胞的臨床應用打下理論基礎。

