FK506對大鼠施萬細胞GFAP、NF200及Nogo-A蛋白表達的影響
田勇,姚素艷,薛慕巍,鄭德宇
(1.錦州醫科大學基礎醫學院解剖學教研室,遼寧 錦州 121000;2.大連瓦房店中心醫院骨外科,遼寧 大連 116300;3.錦州醫科大學基礎醫學院病理生理教研室,遼寧 錦州 121000;4.大連瓦房店中心醫院檢驗科,遼寧 大連 116300)
施萬細胞(schwann cells,SCs)在周圍神經的修復和再生中起到至關重要的作用,但SCs作用的發揮需要依賴適宜的神經纖維微環境[1]。自從1994年Gold就提出了FK506具有促進神經再生作用[2]后,后續的研究發現FK506能保護SCs[3]并促進SCs增殖以及其相應的NGF、Slit2[4]的分泌;FK506能明顯減少神經損傷修復后神經內膠原纖維的含量和瘢痕的面積,顯著提高神經再生的速度和再生神經的質量,促進周圍神經再生使神經功能加速恢復[5]。體外的實驗結果表明隨著FK506劑量的加大,促進SCs的增殖作用越來越明顯,但當FK506劑量加大到400 mM后,施萬細胞出現活性下降甚至凋亡[6]。
神經膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)主要分布于中樞神經系統的星形膠質細胞中。有研究表明[7],抑制GFAP的表達具有促進神經修復的作用。
神經絲蛋白(neuro filament 200,NF200),是NF家族的一員,主要存在于神經元的軸突中。以往的研究表明[8],正常大鼠的神經元中并沒有NF200表達,但脊髓損傷后由神經元大量合成,并聚集于受損區域,參與神經的修復再生[9]。
跨膜糖蛋白Nogo-A是勿動蛋白(Nogo蛋白)的一種,由少突膠質細胞表達,具有很強的抑制軸突生長作用[10-11],并且能穩定和恢復神經元纖維骨架,來實現神經系統穩定[12]。
本文選用在神經修復過程中具有一定作用的GFAP、NF200和Nogo-A 3種施萬細胞相關蛋白,探討FK506誘導對大鼠施萬細胞的增殖分泌功能的促進作用,旨在為周圍神經損傷修復再生的研究提供新的思路,同時也為臨床上早日解除患者周圍神經損傷的病痛提供可行的想法。
1 材料與方法
1.1 施萬細胞RSC96細胞株的復蘇、傳代培養和分組
無菌條件下常規復蘇并傳代培養RSC96細胞株(中橋新舟),實驗分為空白對照組即RSC96細胞繼續正常培養,FK506誘導組即在RSC96細胞株培養基中加入FK506(終濃度100 μM)和溶劑對照組即RSC96細胞培養基中加入相同體積的FK506的溶劑—DMSO。分別于FK506誘導1 d和14 d后,收集細胞提取RNA或進行免疫組織化學檢測。
1.2 RT-PCR檢測施萬細胞GFAP、NF200及Nogo-A基因mRNA的表達
收集細胞,根據說明書利用高純總RNA快速提取試劑盒(BioTeke)提取細胞的總RNA,并調整RNA含量至3組一致,應用real time-PCR擴增目的基因,三個目的基因的引物如表1,反應體系為SYBR GREEN mastermix 10 μL,上、下游引物(10 μM) 各0.5 μL,cDNA模板1 μL,用ddH2O補足至20 μL。反應條件,預變性(95 ℃,10 min),循環為變性(95 ℃,10 s)、退火(60 ℃,20 s)、延長(72 ℃,30 s),共40個循環,使用熒光定量儀進行檢測析。

表1 引物序列表
1.3 免疫組化檢測施萬細胞GFAP、NF200及Nogo-A蛋白的表達
按試劑盒的要求常規進行免疫組織化學檢測,DAB顯色。一抗的稀釋比例為GFAP(1∶200)、NF200(1∶50)和Nogo-A(1∶40),二抗均為生物素化生物素化山羊抗兔IgG。使用顯微鏡觀察細胞的形態,染色效果,200倍時進行拍照彩圖。每組復染3次,每次隨機選取5個視野進行細胞計數,并進行統計學分析。
1.4 統計學處理
數據分析使用SPSS 18.0統計軟件包。采用χ2分析和q檢驗,P<0.05,差異有統計學意義。
2 結 果
2.1 施萬細胞倒置相差顯微鏡觀察
鏡下可見,復蘇傳代的施萬細胞形態為雙極長梭形,呈并排或尖對尖排列,可聚集成簇,細胞核卵圓形,在形態上未見異常。FK506誘導劑組中的細胞經過14 d的誘導培養,以相同密度接種后,傳代時間約為2.5 d,而其他兩個對照組大約需要3~3.5 d,見圖1。
2.2 FK506對施萬細胞GFAP表達的影響
應用實時熒光定量PCR檢測結果顯示,在空白對照組和溶劑對照組中RSCs的GFAP基因mRNA表達量在培養1 d和14 d時幾乎沒有變化,而在FK506誘導組,培養14 d的RSCs中GFAP基因的mRNA表達量明顯高于培養1 d。培養1 d后,FK506誘導組SCs 的GFAP基因mRNA表達比空白對照組和溶劑對照組只略有升高,見圖2A;而FK506誘導14 d后,FK506誘導組SCs 的GFAP的mRNA相對表達量升高超過3倍,高達3.73,明顯高于兩對照組(P<0.01),見圖2B。

A:空白對照組;B:FK506誘導劑組;C:溶劑對照組
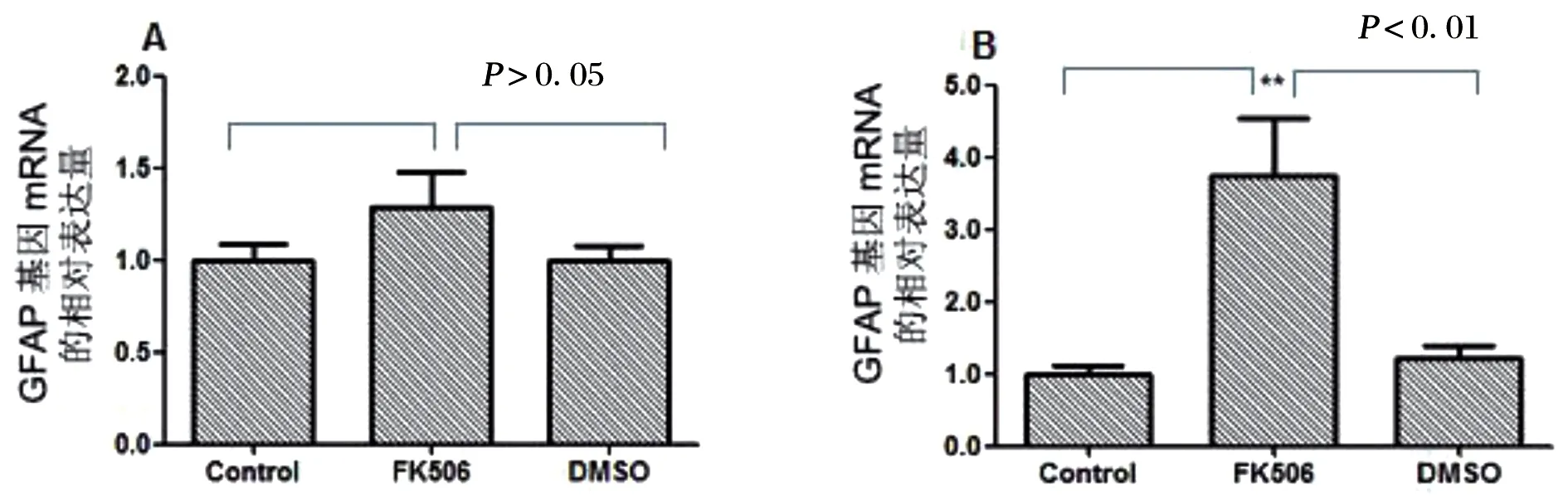
A:為誘導1 d;B:誘導14 d;數據為均數的比較,** P<0.01
在顯微鏡下,各組中均可見散在胞漿呈棕褐色的GFAP陽性細胞。在空白對照組和溶劑對照組中RSCs的GFAP陽性細胞數在培養1 d和14 d時幾乎沒有變化,而在FK506誘導組,培養14 d的RSCs中GFAP陽性細胞數明顯高于培養1 d(P<0.05)。培養1 d后,在FK506誘導組的SCs中GFAP陽性細胞數量與空白對照組或溶劑對照組比均無明顯差異,見圖3。而在培養14 d后,FK506誘導組的施萬細胞中GFAP蛋白的陽性細胞明顯多于空白對照組或溶劑對照組(P<0.05)。
2.3 FK506對施萬細胞NF200 基因mRNA表達的影響
應用實時熒光定量PCR檢測結果顯示,在空白對照組和溶劑對照組中RSCs的NF200基因mRNA表達量在培養1 d和14 d時幾乎沒有變化,而在FK506誘導組,培養14 d的RSCs中NF200基因的mRNA表達量明顯高于培養1 d。培養1 d后,在FK506誘導組的施萬細胞中 NF200基因的mRNA表達量與兩對照組相比幾乎沒有變化,而在溶劑對照組卻略有降低,見圖4A。培養14 d后,在FK506誘導組的RSCs中NF200基因的mRNA相對表達量達到2.31,明顯高于空白對照組或溶劑對照組(P<0.01),見圖4B。
在顯微鏡下,各組細胞爬片中均可見散在胞漿呈棕褐色的NF200蛋白陽性細胞。在空白對照組和溶劑對照組中RSCs的NF200陽性細胞數在培養1 d和14 d時幾乎沒有變化,而在FK506誘導組,培養14 d的RSCs中NF200陽性細胞數明顯高于培養1 d(P<0.05)。培養1 d后,SCs在FK506誘導組的NF200蛋白陽性細胞數量與空白對照組或溶劑對照組均無明顯差異,這一結果與NF200基因的mRNA表達趨勢一致。培養14 d后,在FK506誘導組中NF200的陽性細胞數量(達到161)明顯高于空白對照組或溶劑對照組的NF200陽性細胞數(P<0.05),這一檢測結果也與NF200基因的mRNA表達結果一致,見圖5,P>0.05。
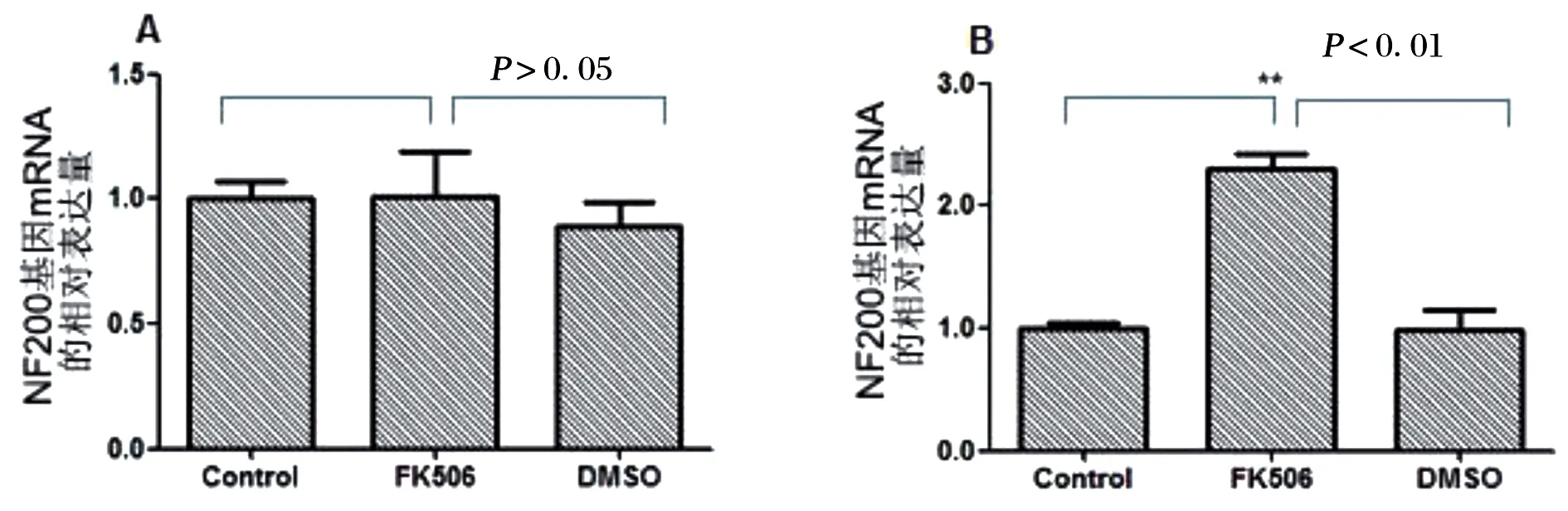
A:誘導1 d;B:誘導14 d;數據為均數的比較,** P<0.01
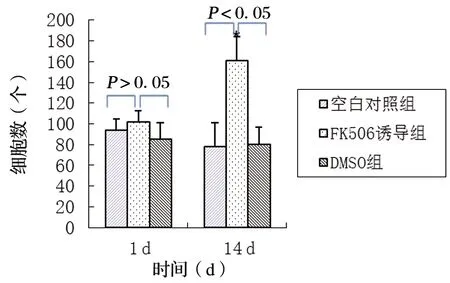
圖5 NF200蛋白表達陽性的細胞數量
2.4 FK506對施萬細胞Nogo-A 基因表達的影響
應用實時熒光定量PCR檢測結果顯示,在空白對照組和溶劑對照組中RSCs的NF200基因mRNA表達量在培養1 d和14 d時幾乎沒有變化,而在FK506誘導組,培養14 d的RSCs中NF200基因的mRNA表達量明顯低于培養1 d。培養1 d后,在FK506誘導組的RSCs中Nogo-A基因的mRNA表達較空白對照組相升高較明顯(P<0.01),在溶劑對照組中Nogo-A的mRNA的表達量卻較空白對照組稍稍降低,見圖6A。在14 d培養后,FK506誘導組的RSCs中Nogo-A基因的mRNA相對表達量降低到0.23,明顯低于空白對照組或溶劑對照組(P<0.01),見圖6B。
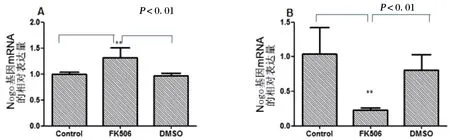
圖6 FK506誘導SCs的Nogo-A基因mRNA表達
在顯微鏡下,各組中均可見散在胞漿呈棕褐色的Nogo-A蛋白陽性細胞。在空白對照組和溶劑對照組中RSCs的Nogo-A陽性細胞數在培養14 d時明顯多于培養1 d,而在FK506誘導組,培養14 d和培養1 d的RSCs中Nogo-A陽性細胞數幾乎沒有變化(P<0.05)。培養1 d后,FK506誘導組的RSCs中Nogo-A蛋白的陽性細胞數明顯多于空白對照組或溶劑對照組(P<0.05)。在培養14 d后,FK506組的SCs中Nogo-A蛋白的陽性細胞數量略低于空白對照組,二者間無統計學差異(P>0.05),卻明顯少于溶劑對照組(P<0.05),見圖7。
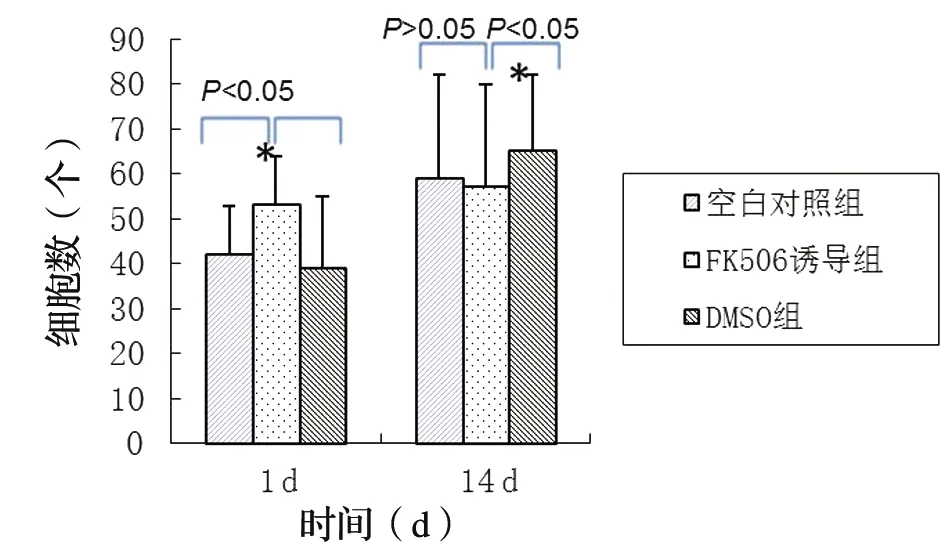
圖7 Nogo-A蛋白表達陽性的細胞數量
3 討 論
如何發揮施萬細胞的促進周圍神經修復的作用是研究者關注的課題。本實驗應用RSC96細胞株作為研究對象,應用FK506作為處理因素,在實驗觀察的14 d內,FK506能明顯的促進SCs的增殖,這也與以前的文獻報道相一致[5]。
有研究表明[13],GFAP參與細胞骨架的構成并維持其張力強度,是SCs的標志蛋白。而在本實驗中,FK506誘導培養14 d后,經FK506處理的RSC96細胞株中GFAP基因mRNA表達與兩對照組相比明顯升高(P<0.01),RSC96細胞株中GFAP陽性細胞數量也明顯多于兩對照組(P<0.05)。結合以往的研究可以推斷FK506能促進RSC96細胞株GFAP的表達,借此促進細胞骨架形成并維持其張力,加快損傷神經的再生修復。
NF200是組成神經胞體和軸突細胞骨架結構的重要物質,能反映神經元和突觸的功能[14]。當神經受損時,損傷范圍內神經元失去反應能力,而損傷范圍附近的神經元中NF200合成增加并積聚[15]。根據本實驗結果,經FK506處理14 d后,RSC96細胞株中NF200基因mRNA表達較兩個對照組明顯升高(P<0.01),免疫組織化學方法檢測RSC96細胞株中NF200陽性細胞數量也明顯多于對照組(P<0.05),而在誘導1 d時,各組RSC96細胞株中NF200的mRNA和蛋白水平升高均不明顯(P>0.05)。結合以往的研究結果,可以推斷FK506能促進在損傷區附近神經元和膠質細胞中NF200的大量合成并聚集,加快神經胞體和軸突骨架結構形成,進而達到促進損傷的神經再生長作用。
研究表明Nogo-A在中樞神經系統和周圍神經系統的發育和功能都具有重要影響[16]。當采用使用抗Nogo-A抗體或者更直接敲除Nogo-A基因,會導致背根神經節移植培養物生出比對照組更粗、更長的神經突,并且能顯著減少神經束的解束,而使其變粗[17]。在本實驗中,經FK506作用14 d后,RSC96細胞株中Nogo-A基因mRNA表達明顯較兩個對照組減少(P<0.01),免疫組化檢測結果顯示,在FK506誘導1 d時,FK506誘導劑組中表達Nogo-A蛋白的陽性細胞平均數量比空白對照組和溶劑組明顯增多(P<0.05);但經FK506誘導14 d后,FK506誘導組Nogo-A的陽性細胞數量與空白對照組幾乎相等(P>0.05),而且均明顯低于溶劑對照組(P<0.05)。FK506誘導組在處理前后Nogo-A的陽性細胞數幾乎沒有增加,而空白對照組和溶劑組明顯增多。結合以往的研究結果可推知,FK506對Nogo-A蛋白的表達發揮了抑制作用,能通過減弱Nogo-A的抑制神經突生長的功能,幫助神經骨架的再生,促進神經損傷的修復。
綜上所述,當應用FK506作用于RSC96細胞時,可能增加GFAP、NF200的表達,同時抑制Nogo-A的表達,加速神經細胞及軸突細胞骨架結構的形成;能使施萬細胞在數量上明顯優于未誘導組,促進其增殖及分泌功能,有助于受損的周圍神經加速進行再生修復。然而,FK506促進施萬細胞GFAP、NF200的表達,抑制Nogo-A蛋白的表達的機制本實驗未涉及,尚待進一步研究證實。施萬細胞是否還通過其他物質促進神經元生長,也有待于進一步的研究。由于可操作實驗的時間有限,FK506作用的時間點只選取了2個,今后的研究中會可以適當增加幾個時間點,適當延長觀察時間,以期待有更多的發現。

