基于基因多態性致藥物代謝差異的臨床個體化用藥劑量調整
石魯月 羅一夫 張治然 崔永超 王曉波
(中國人民解放軍聯勤保障部隊第967醫院藥物研究所,遼寧 大連 116011)
藥物基因組學(PGx)是一門將基因實驗室檢測結果轉化為針對受影響藥物的可行性處方,以實現用藥劑量個體化的學科。PGx通過檢測個體的遺傳信息來預測機體內的藥物反應,進而指導臨床醫生針對患者個體差異定制藥物治療方案,以實現對患者更安全、更有效和低成本、高效益的治療[1]。目前美國食品藥物監督管理局(FDA)、歐洲藥品管理局(EMA)等機構相繼為某些藥物標記了一定級別的PGx標簽信息,分別為需要測試、推薦測試、可行性PGx和信息性PGx 4個級別,為患者用藥之前是否需要進行基因檢測提供建議。截至2020年6月,共有381種藥物被標記PGx級別標簽。PGx級別標簽雖然給臨床精準用藥提供了重要的參考信息,但在臨床實踐中,因缺乏具體的臨床實施路徑,臨床醫生還是不能完全根據患者的基因檢測結果調整實際用藥劑量。
目前已經有包括美國臨床藥物遺傳學實施聯盟(CPIC)、荷蘭藥物遺傳學工作組(DPWG)、加拿大藥物遺傳學藥物安全網絡(CPNDS)等多家機構,編寫了可用于臨床的個體化藥物劑量調整指南,為臨床醫生提供了切實可行和便于實施的基于基因多態性的個體化用藥劑量調整方案。CPIC共發布了59種藥物劑量推薦指南,致力于解決藥物遺傳學檢測結果在臨床實施中的障礙問題。DPWG發布的94種根據基因指導用藥劑量調整的臨床指南中,只有54種藥物給出具體劑量調整建議,相比之下CPIC發布的臨床指南指導意見則更為系統和全面,值得借鑒。CPNDS是一個多中心的主動監測和PGx聯盟,成立于2004年,旨在揭示藥物反應與基因表型的遺傳學關系和機制,開發臨床藥物遺傳學實施工具,提高兒童和成人用藥的安全性和有效性。其他機構還包括美國風濕病學會及法國國家藥物遺傳學網絡(RNPGx),分別提供了別嘌呤醇及抗抑郁藥物等相關臨床用藥指南。本文在這些相關指南的基礎上,系統闡述了如何依據基因表型調整個體臨床用藥劑量,并進一步總結了需要進行基因檢測的人群,旨在為臨床提供基于基因多態性的個體化用藥治療方案。
1 影響藥物代謝的基因及其相關信息
基因的突變會引起體內酶的數量和活性的改變,從而改變藥物在體內的代謝和轉運,導致不同個體對同一藥物的代謝速率有明顯的差異,因而基因的多態性與藥物療效和毒副作用之間密切相關。下面主要從涉及個體化用藥劑量調整的基因、各種基因的相關信息及不同基因型對藥物代謝的影響等幾個方面進行介紹。
1.1 細胞色素P450(CYP450)系列基因
CYP450酶是藥物代謝的主要參與者,根據研究報道超過90%的已知藥物被CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1以及CYP3A4酶代謝[2]。CYP2D6是研究最廣泛的CYP系列基因之一,占總CYP的2%~4%,可參與臨床上約25%藥物的代謝[3-4],與可待因、他莫昔芬等藥物劑量的調整密切相關[5]。如果不考慮藥物劑量的個體化調整,有些藥物如可待因的使用可能會導致患者出現嚴重的副反應[6],因此強烈建議針對特殊人群考慮基于基因的藥物劑量調整方案。CYP2C19酶可代謝多達15%已知的治療窗口狹窄藥物,包括華法林、氯吡格雷和卡馬西平等[7]。其突變基因可分為兩種類型:降低酶活性的CYP2C19*2、CYP2C19*3,增加酶活性的CYP2C19*17[8],參與了至少10%臨床藥物代謝。CYP2B6參與大約7%的常用藥物的代謝[9]。其多態性對環磷酰胺代謝的影響,不同患者體內的代謝產物濃度差異超過10倍,具有明顯個體差異性[10]。CYP3A4酶主要在肝臟(95%)和小腸中表達,參與大約30%藥物的全身前代謝和全身代謝[11]。CYP4F2基因則與CYP2C9、VKORC1基因共同調節華法林的抗凝血作用。CYP系列基因對藥物代謝的影響及相關信息見表1。
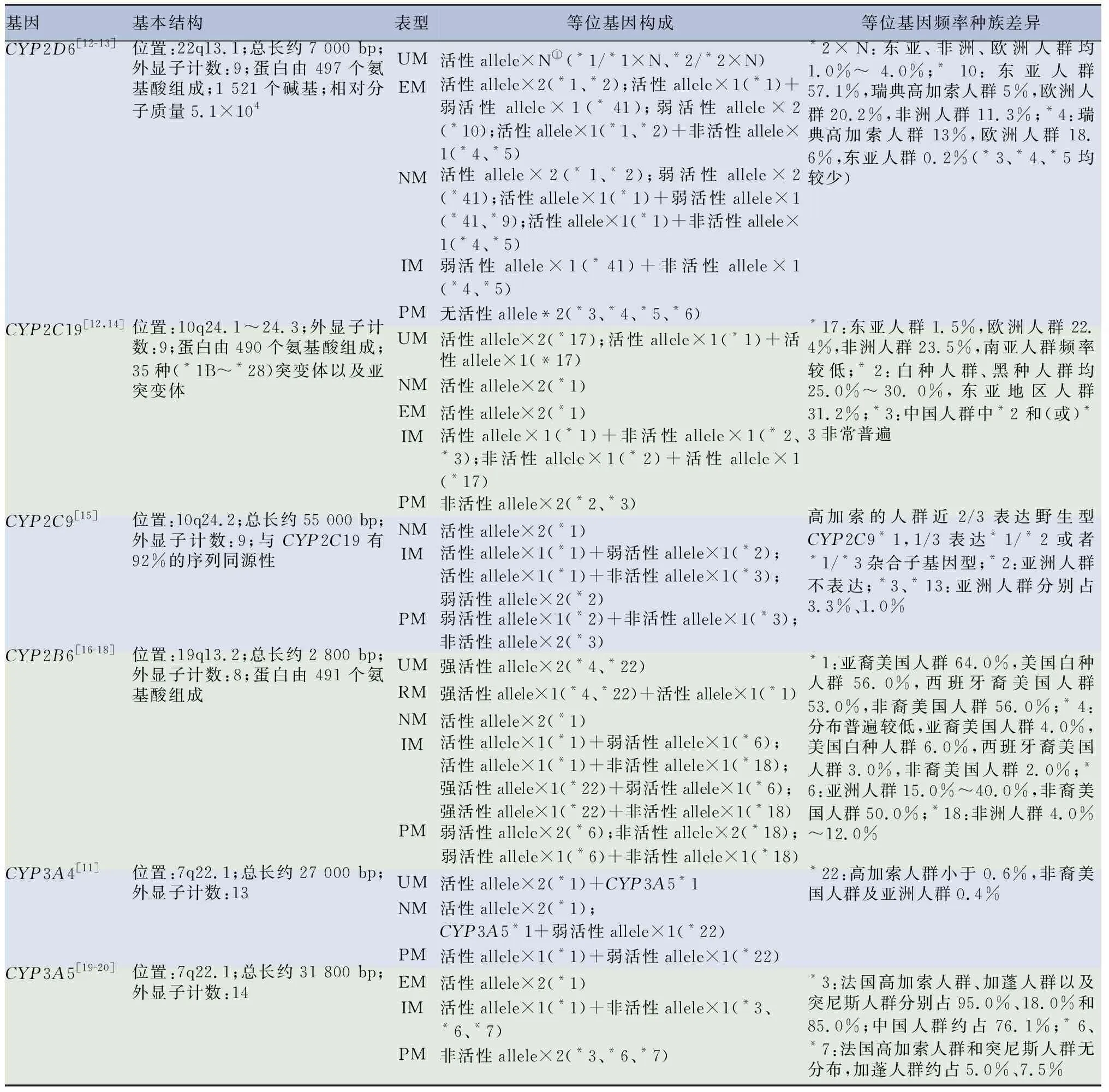
表1 CYP450系列基因對藥物代謝的影響及相關信息
1.2 生素K環氧化物還原酶復合體1(VKORC1)基因
VKORC1是體內維生素K依賴性凝血因子生成的限速酶,與CYP2C9、CYP4F2共同調控華法林在體內的代謝,華法林可競爭性抑制此酶而達到抗凝效果。VKORC1基因多態性導致的個體對華法林敏感性的差異及相關信息見表2。
1.3 其他影響藥物代謝的基因
目前個體化用藥劑量調整指南中涉及到的其他影響藥物代謝的基因有UGT1A1基因、NUDT15基因、TPMT基因以及DPYD基因。UGT1A1屬于UDP-葡萄糖醛酸轉移酶家族1成員A1,UGT1A1編碼UDP-葡萄糖醛酸糖基轉移酶,可將親脂性小分子如膽紅素、激素和藥物轉化為水溶性的可排泄代謝物,隨后通過腎臟、膽汁以及腸道排出,因此攜帶轉化能力低(即活性低)的基因型的個體對藥物清除能力降低,應相應減少用藥劑量[25]。NUDT15基因變異在亞洲人群中發生率較高,是該人群易發生硫嘌呤毒性的主要遺傳原因[26],因此臨床上在制定免疫系統疾病的用藥方案時,尤其需要注意。二氫嘧啶脫氫酶 (DPD)是由DPYD基因編碼的,廣泛分布于多種組織當中。目前已經確定的DPYD變體已超過200種,通過DPD酶活性的體外評估,證實有DPYD*2A、DPYD*13、DPYDc.2846A>T和DPYD單倍型-B3 4種變體,其中DPYD*2A可導致DPD酶活性完全喪失[27]。除UGT1A1基因外,其他影響藥物代謝的基因對藥物代謝的影響及相關信息見表3。

表2 VKORC1基因對華法林敏感性的影響及相關信息
1.4 對用藥個體產生其他影響的基因
CACNA1S是位于人類1號染色體的基因,該基因編碼的電壓門控鈣通道亞基α1S,為一種骨骼肌細胞L型電壓依賴性鈣通道緩慢失活的亞基。該基因突變與藥物所致的低鉀性周期性麻痹、甲狀腺毒性周期性麻痹和惡性高熱易感性(MHS)有關。同樣,RYR1基因突變引起的癥狀也與惡性高熱易感性相關[36]。
與肝纖維化有關的常見基因變異位于9號染色體上的IFNL-3和IFNL-4基因之間。IFNL-3基因編碼干擾素-λ,干擾素-λ作為一種生長因子,通常與用作治療的IFN制劑相似,無論是在抗病毒治療的急性發作期還是持續期,都有助于清除病毒[37]。
有機陰離子轉運體1B1(SLCO1B1)基因編碼的有機陰離子轉運因子2,是一種肝細胞基底膜上轉運膽紅素等物質的重要轉運體,編碼691個氨基酸蛋白。SLCO1B1基因突變會使辛伐他汀其引起肌病,亦可抑制有機陰離子轉運因子2轉運膽紅素入肝的能力,使膽紅素清除能力減慢,過多游離膽紅素可能會導致新生兒高膽紅素血癥[38]。
6-磷酸葡萄糖脫氫酶(G6PD)是一種存在于人體所有細胞的細胞質中的酶[39],在睪丸、骨髓和其他23種組織中廣泛表達。G6PD基因突變導致該酶活性降低,紅細胞不能抵抗氧化損傷而遭受破壞,引起溶血性貧血。不論是否患有慢性非球囊性溶血性貧血(CNSHA),G6PD基因缺陷型患者均禁用拉布立酶。由于G6PD基因位于X染色體,確定基因表型時,應結合性別和基因檢測結果共同判定。 對用藥的個體產生影響的其他基因以及相關的信息詳見表4。

表4 對用藥個體產生其他影響的基因及相關信息
2 根據基因多態性調控劑量的藥物
藥物在體內的代謝往往受多基因調控,基于基因多態性調整用藥劑量能夠提高藥物治療的有效性、安全性、成本效益和臨床治療效果[44]。受基因多態性調控代謝速率的藥物,需要根據某個基因或結合某幾個基因的基因型調整用藥劑量。
2.1 主要受單基因調控的藥物
截至2020年6月,經FDA批準藥物共1 739種,而已知的受具體基因操控且有個體化用藥劑量調整指南可循的藥物僅112種,僅占總量的6%。臨床指南中涉及的藥物包括主要受單基因調控的藥物和受2個或者2個以上基因調控的藥物。盡管藥物在體內的代謝常受多個基因的調控,但是在很多情況下,某個基因會對一種藥物的代謝發揮主要的調控作用。
2.1.1受單基因調控代謝的藥物 表5列出了現有臨床個體化用藥劑量調整指南指導的所有受單基因調控的藥物,及其基因對藥物代謝影響情況,并根據基因多態性給出了個體化用藥劑量調整的3種不同程度的建議等級,建議程度由高到低分別為強、中、可選。
2.1.2受單基因功能表達對用藥個體產生不良反應的藥物 有些基因在臨床指南中并未明確表示其各自基因型所對應的表型是否為PM、IM及EM等,只是以功能表達是否正常或以調控藥物代謝能力高低來表示。見表6。
2.1.3受人類白細胞抗原(HLA)系列基因影響的藥物 特異性HLA-A及HLA-B等位基因并不影響藥物在體內代謝,而是與藥物不良反應(ADR)風險密切相關,如HLA-A*31:01攜帶者被證明服用常見的抗癲癇藥物(如卡馬西平、苯妥英鈉等)以后可以導致伴嗜酸性粒細胞增多和全身癥狀藥物反應(DRESS)、斑丘疹性皮疹(MPE)、STEVENS-JOHNSON綜合征(SJS)、中毒性表皮壞死松解癥(TEN)及藥物性肝損傷產生的風險增加,HLA-B*58:01等位基因與別嘌呤醇誘導的嚴重皮膚不良反應(SCAR)密切相關等[55-56]。見表7。
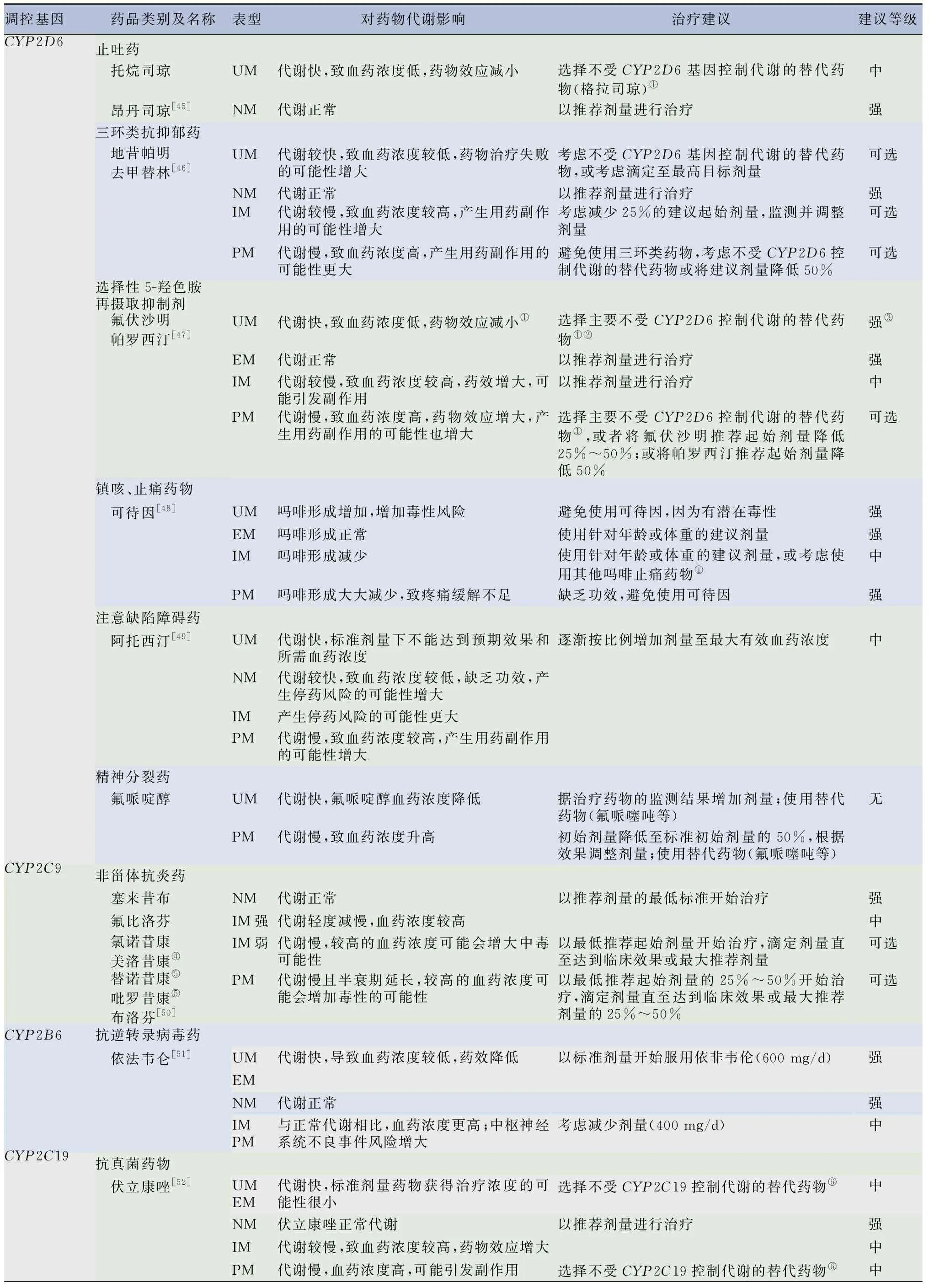
表5 臨床指南指導的受單基因調控代謝的藥物
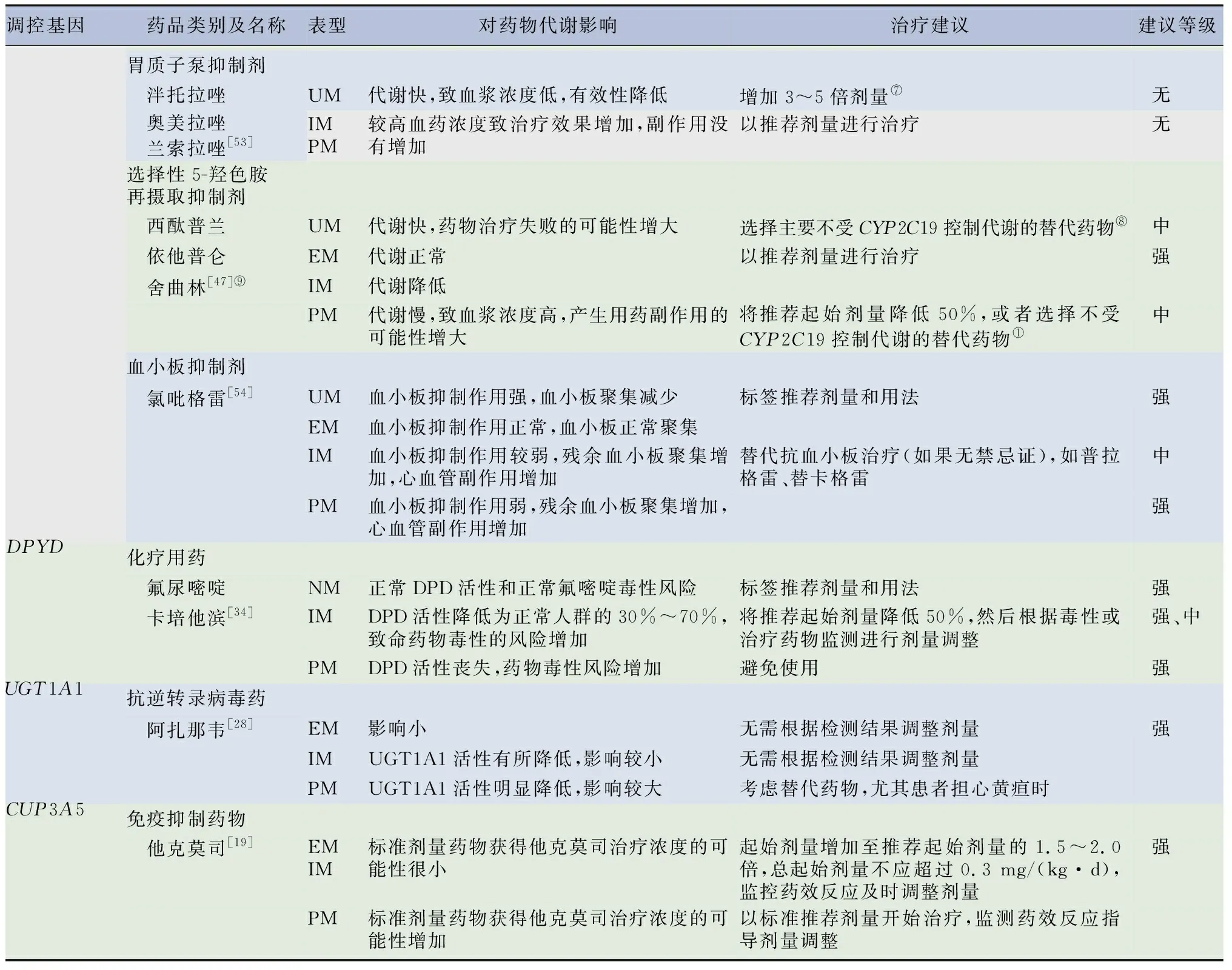
表5(續)
2.2 受多個基因調控的藥物及其治療建議
除了在體內轉化過程中受單基因調控的藥物外,許多種情況下,有些藥物會同時受2個或2個以上基因的調控,每個基因各自不同的表型又會對藥物的代謝產生不同影響。在此情況下,則需要檢測多個基因,以指導臨床用藥劑量。現對臨床個體化用藥劑量調整指南中受多個基因調控的藥物進行總結,并給出了相應的治療劑量調整建議。每個表格中,每個橫向基因及其表型和縱向基因及其表型交匯處的治療建議,就是指在這兩種基因各自為其表型的情況下,相應的藥物治療建議及建議等級。詳見表8~10。
3 基于臨床指南對用藥劑量調整的臨床實踐步驟
多數情況下,藥物在體內代謝受到多個基因調控,需同時考慮多個基因的表型對藥物代謝的調控,以指導臨床用藥。并且不同地區人群基因頻率也存在較大差異,應根據不同的種族來確定是否需要基因檢測,需要檢測哪些基因的表型。例如華法林受CYP2C9、CYP4F2及VKORC1基因的共同調控,在決定用藥劑量前需制定詳細計劃,應明確3種基因各自基因型及對藥物代謝產生的影響,結合種族分布,決定是否進行基因檢測或如何調整用藥。詳見圖1。
以華法林為例的臨床實施步驟,主要是結合基因檢測結果制定個體化用藥方案的核心步驟,在實際臨床實施過程中,還應有較完善的前序及后續工作[1]。如圖2所示,在研究實施前,應首先結合患者自身情況明確需要探究的基因或藥物,查找相應臨床個體化用藥劑量調整指南,確定需檢測基因的等位基因型后,進行基因檢測。再根據檢測結果,確認患者基因表型及藥物在患者體內的代謝情況,從而為醫生提供用藥建議。個體化用藥劑量調整建議形成后,根據其他受影響藥物的相互作用調整用藥方案,再與醫生、患者及家屬溝通用藥方案等相關信息,經機構批準后方可實施用藥。方案實施一段時間后,還需有臨床實施效果評價,這樣基于臨床指南對用藥劑量調整的臨床實踐才算完整。
4 需要進行基因檢測的人群
目前根據基因多態性指導患者用藥還需考慮到治療的成本和效益,因此在臨床實踐中非常有必要明確哪些患者需要進行基因檢測,以促進臨床合理用藥。
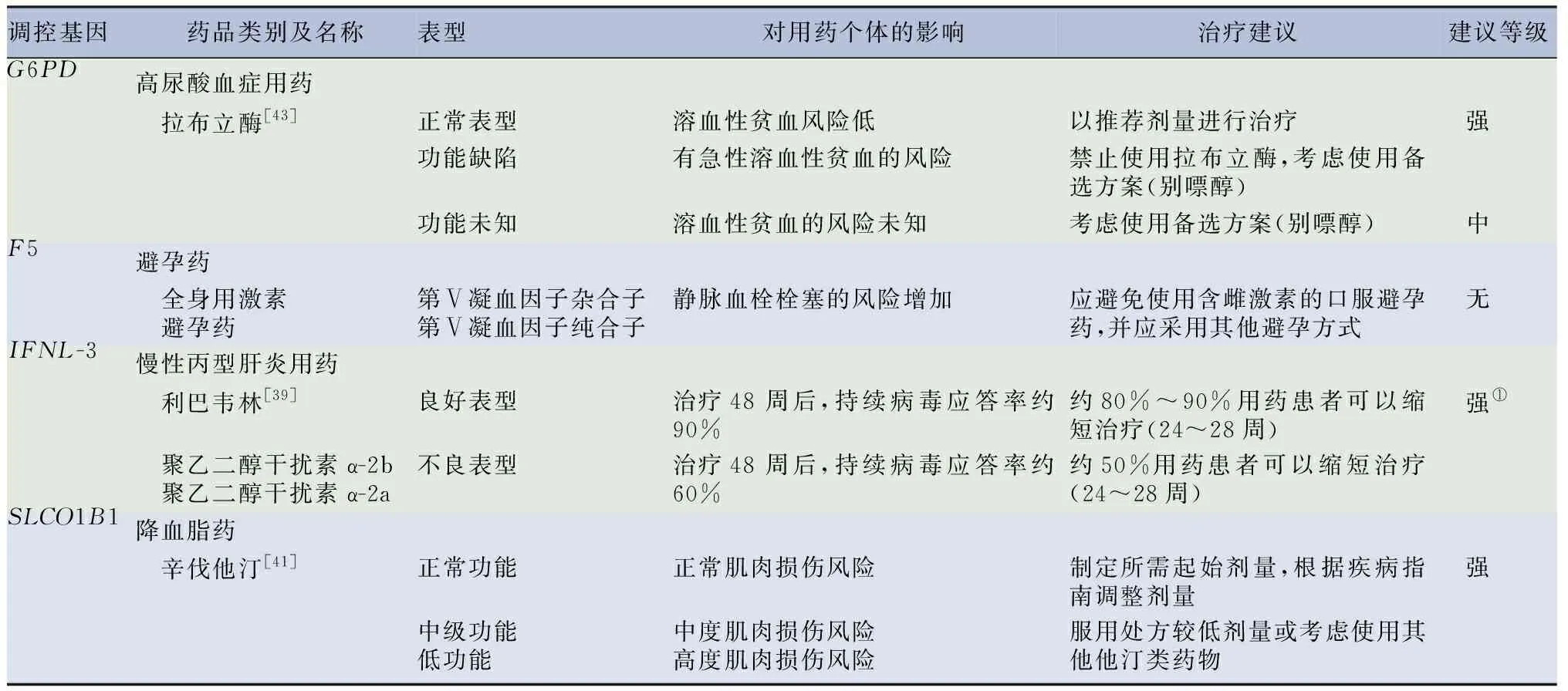
表6 受單基因功能表達對用藥個體產生不良反應的藥物
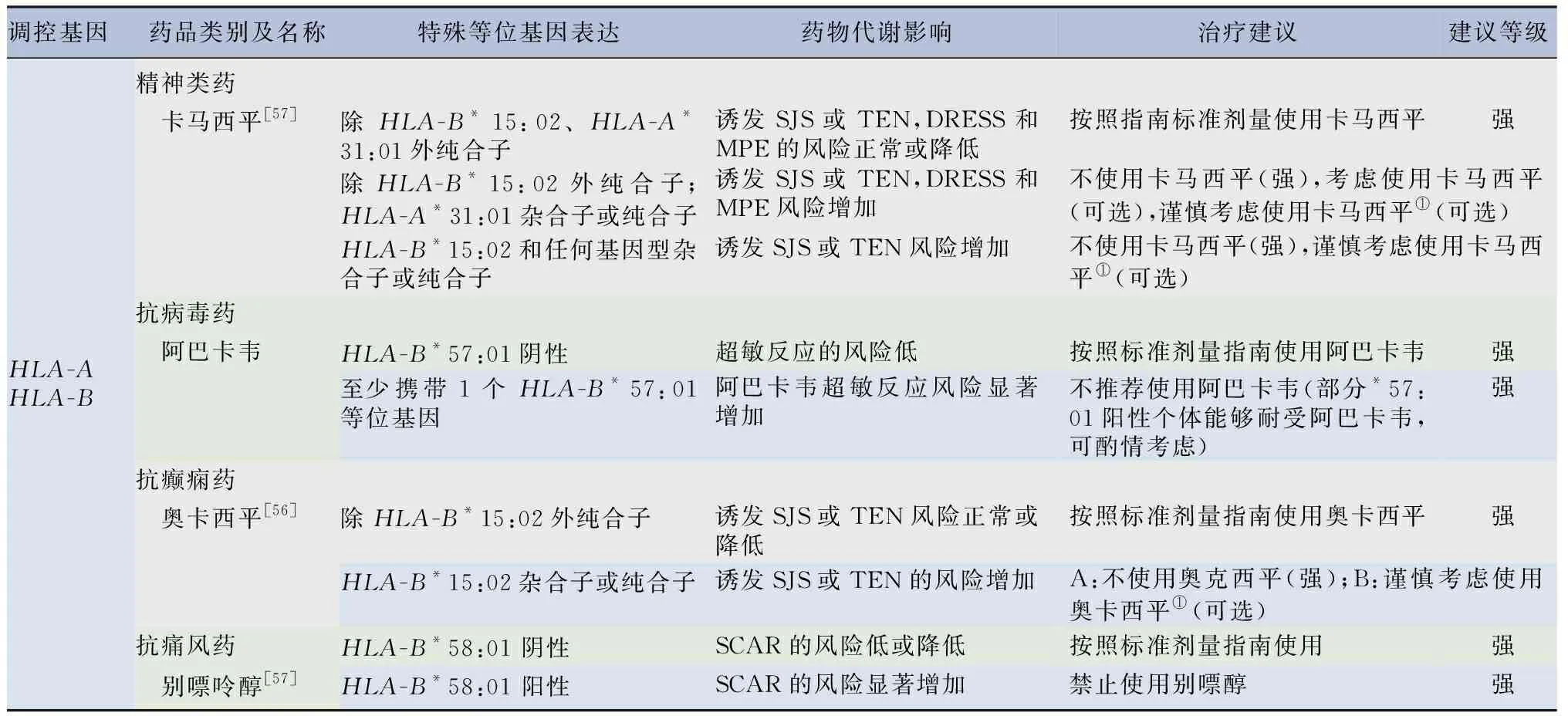
表7 受HLA特殊等位基因表達調控的藥物

表8 受CYP2C9和HLA-B基因調控的抗癲癇藥物的治療建議
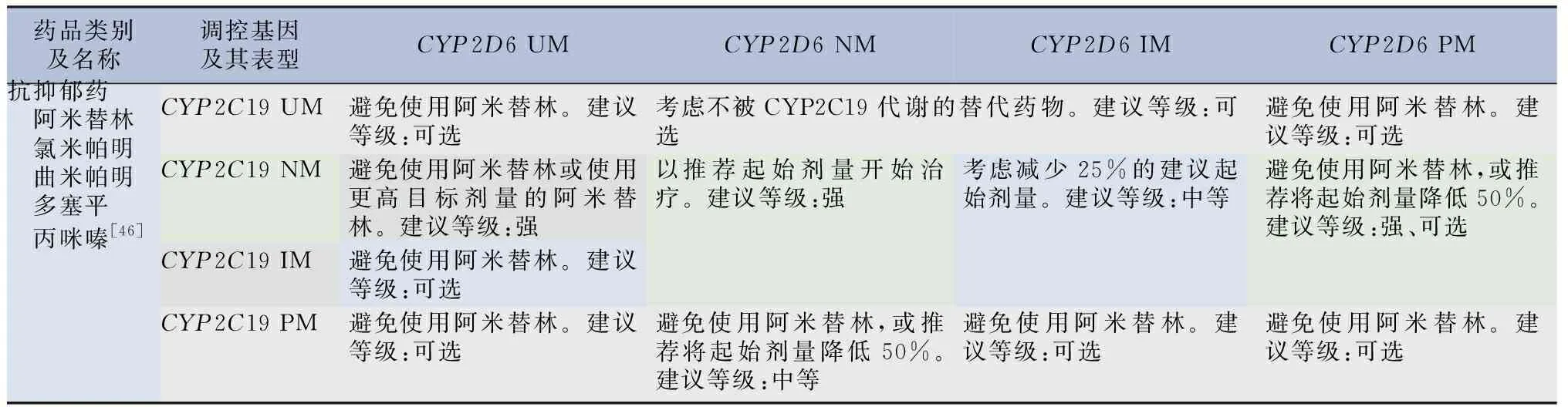
表9 受CYP2C19和CYP2D6基因調控的抗抑郁藥的治療建議
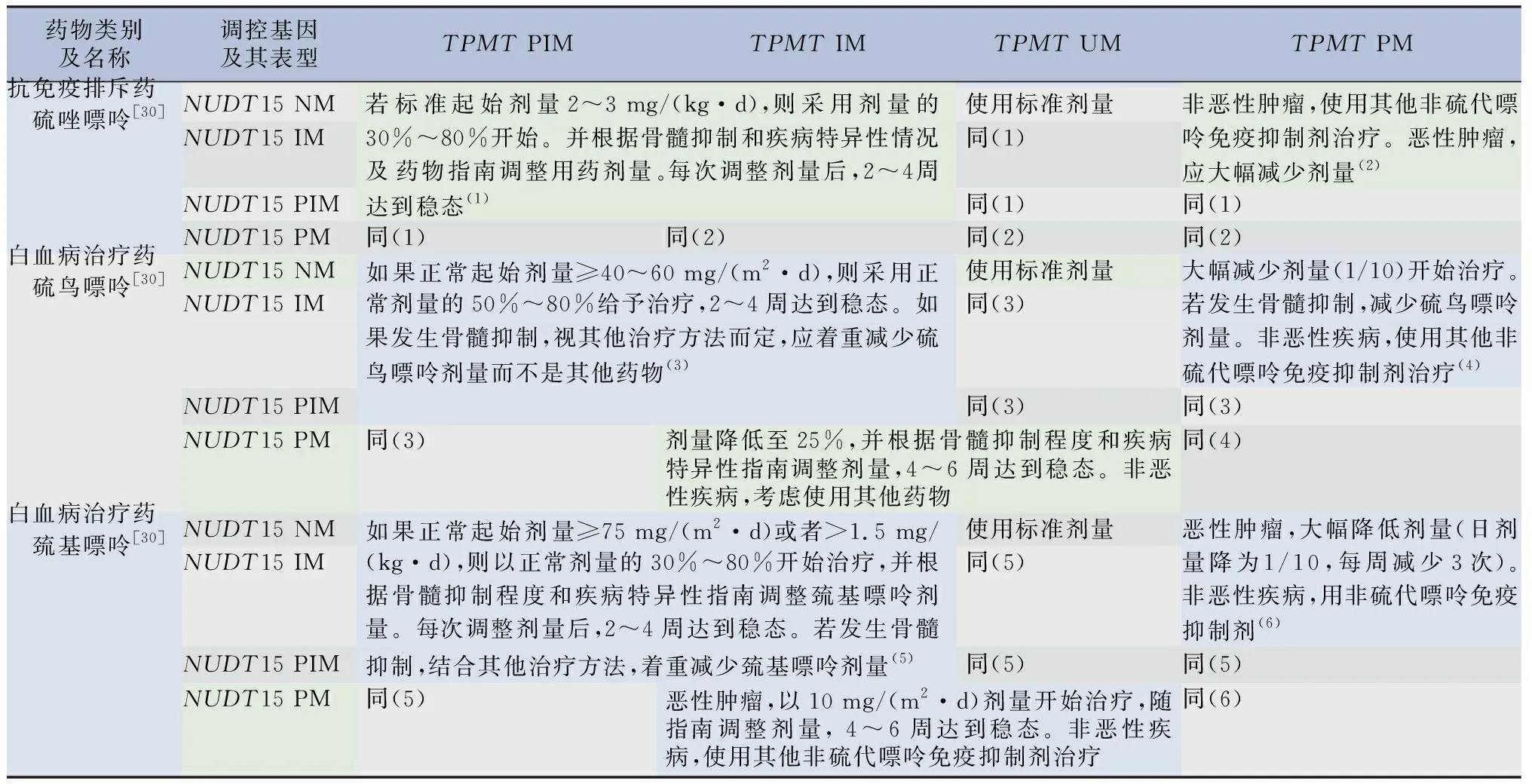
表10 受NUDT15和TPMT基因調控的3種藥物的治療建議
4.1 腫瘤患者
腫瘤是受基因驅動的疾病,如肺癌,但每個患者的驅動基因并不相同。所以腫瘤患者在治療時,應通過檢測驅動基因找準治療靶點,選擇相應的靶向藥物進行治療,從而獲得更好的治療效果,提高患者的生存時間和生存質量。此外由于基因多態性的差異, 相同的藥物治療方案也可能會對同種類型的腫瘤患者產生截然不同的療效和毒副反應[59]。因此腫瘤患者需要結合基因檢測結果調整用藥劑量,以期達到更好的治療效果。
4.2 藥效長期不明顯的患者
基因多態性對藥物代謝動力學和藥效特征均有一定的影響[60],患者使用某種藥物后效果不佳,病情控制不穩定,可能原因之一是某種基因型改變了藥物在患者體內的代謝方式,需選擇替代藥物或相應加大用藥劑量。
4.3 需長期服用某種藥物的患者
如罹患心血管疾病、精神疾病以及抑郁癥等的患者,需長期甚至終生服用某些藥物,從藥物經濟學角度來看,患者通過檢測明確自身基因表型,選擇更加合適的藥物和更恰當的用藥劑量,能夠花費更少資金獲得更好的治療效果。
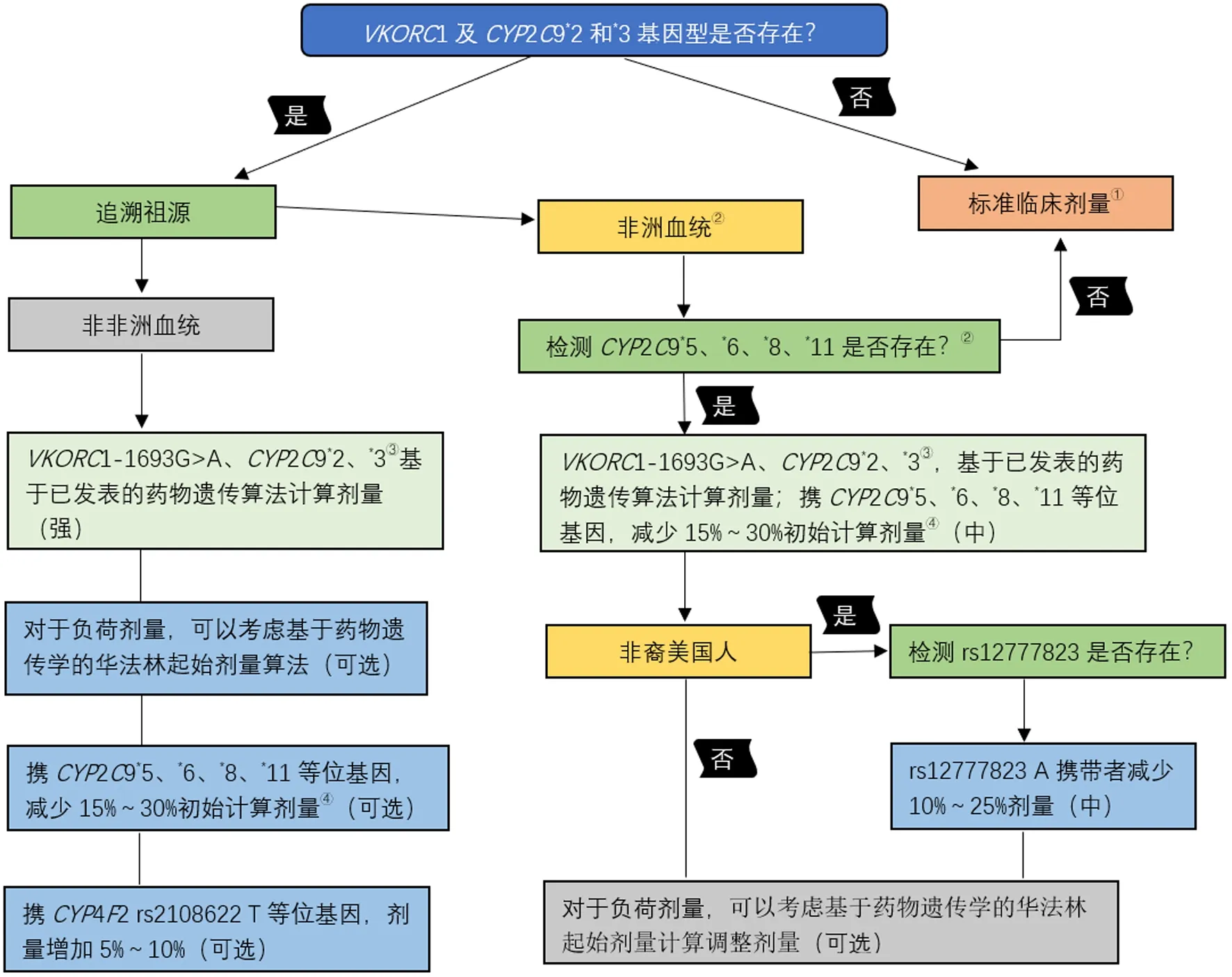
注:①“臨床劑量”是指在沒有獲取患者遺傳信息時,按藥物的正常劑量給藥,可能包括使用標準劑量或根據臨床劑量算法計算給藥量;②如果未檢測到CYP2C9*5、*6、*8和*11,則根據臨床劑量服用華法林;③攜帶CYP2C9基因代謝不良表型(如CYP2C9*3/*3、*2/*3、*2/*2)以及同時攜帶對藥物敏感性增加的基因表型(VKORC1 A/G或A/A),或攜帶CYP2C9基因其他代謝不良相關基因型的患者,考慮使用替代藥物;④變異純合子可能需要減少更多劑量(即20%~40%)
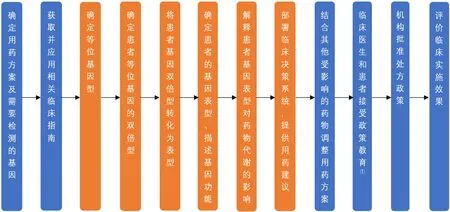
注:①政策教育包括臨床醫生和患者需了解:此方案結果意味著什么、需要什么信息及哪些藥物可能會受到影響
4.4 特殊人群
特殊人群指本人或家族成員中有嚴重藥物不良反應史的人群。同時接受多種藥物治療的患者、經常接觸有毒物質的患者以及兒童、老年人等適合進行藥物相關基因檢測。
5 總結和展望
將PGx應用到臨床用藥決策之中,參照臨床個體化用藥劑量調整指南對患者按照不同基因型分別治療,不僅能夠彌補單純依據血藥濃度檢測制定個體化用藥方案的不足,也為個體治療方案的制定提供了新思路[61]。目前臨床個體化用藥劑量調整指南涉及的藥物有限,仍然有大量藥物沒有切實可信的臨床指南和實施路徑參考。但隨著基因檢測技術不斷發展與完善,將實驗室基因檢測結果轉化為可實施的個體化用藥方案會在臨床上得到更廣泛的應用。本文搜集并整理了有關基因多態性指導個體化用藥的相關指南,系統地闡述了如何依據基因表型調整個體臨床用藥劑量,并進一步總結需要進行基因檢測的人群,旨在為臨床提供基于基因多態性的個體化用藥治療方案。實現用藥劑量個體化,不僅能夠提高藥物療效,縮短療程,還可減少藥物毒副作用,亦能降低用藥成本,促進國家藥物資源充分合理分配,節約國家醫療資源。

