自動乳腺全容積成像受激素表達水平的影響及對新輔助化療效果的評估
陳秀霞 門泉斌 黃 梅 姜秀貞 張鳳梅 駱瑞珍 劉晶晶
乳腺癌是最常見的女性惡性腫瘤,近年發病率呈上升趨勢,其侵襲性高,易復發轉移,嚴重威脅女性生命健康安全[1]。術前新輔助化療通過縮小腫瘤大小,增加保乳手術的可能性,提高病理完全緩解率,改善患者預后,在乳腺癌尤其是局部中晚期、三陰性乳腺癌患者的療效評估中已得到肯定[2]。自動乳腺全容積成像(automated breast volume scanner,ABVS)在乳腺癌診斷和療效評估中具有獨特優勢[3]。本研究旨在探討ABVS 在乳腺癌腫塊大小測量、療效評估中的應用價值,以及雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)及人類表皮生長因子受體2(human epidermal growth factor receptor 2,Her-2)表達對乳腺癌ABVS 征象的影響,以期為臨床診治和療效評估提供依據。
資料與方法
一、研究對象
選取2015 年1 月至2017 年1 月我院收治的經術后病理證實的乳腺癌患者506 例(共523 個病灶),年齡42~63 歲,平均(55.23±4.23)歲;病灶最大徑0.62~3.56 cm,平均(2.13±0.34)cm;單發490 例,多發16 例;組織學分級:Ⅰ級109例,Ⅱ級197例,Ⅲ級200例。納入標準:①均于術前行新輔助化療,化療前行ABVS 檢查,術后留取標本行免疫組化檢查,資料完整;②ABVS檢查前均未接受放療、化療及免疫治療等。排除標準:①合并其他部位惡性腫瘤;②合并血液系統、免疫系統疾病;③妊娠或哺乳期女性。本研究經我院醫學倫理委員會批準,患者及其家屬均知情同意。
二、儀器與方法
1.ABVS 檢查:使用西門子Acuson S 2000 彩色多普勒超聲診斷儀,線陣探頭,頻率5~14 MHz;配備ABVS 系統。患者取仰臥位,暴露患側乳房,先行二維超聲掃查,確定病灶位置,然后切換至ABVS 模式對乳房外側位、內側位、正中位進行掃查。將ABVS 圖像數據傳輸至后臺工作站進行三維重建,觀察乳腺腫塊形態,以及鈣化、“毛刺征”、“匯聚征”情況。使用ABVS系統自帶醫學測量軟件選取最大切面測量腫塊長、寬、高,計算腫塊面積和體積。上述超聲檢查均由我科兩位具有5年以上乳腺超聲檢查經驗的醫師共同完成。
2.臨床治療及療效評估:所有患者均接受4 個周期FEC 序貫(氟尿嘧啶500 mg/m2靜脈滴注1 次/d+表柔比星90 mg/m2靜脈滴注1 次/d+環磷酰胺500 mg/m2靜脈滴注1 次/d)聯合12 次單T(多西他賽75 mg/m2靜脈滴注1 次/d)方案治療。根據實體腫瘤療效評價標準[4]評價化療療效:①腫塊大小縮小<50%或腫塊大小增大≥25%判為進展;②腫塊大小縮小<50%或增大<25%判為穩定;③腫塊大小縮小≥50%判為部分緩解;④腫塊完全消失且持續1個月以上判為完全緩解。將部分緩解和完全緩解歸為有效組,進展和穩定歸為無效組。
3.免疫組化檢測:所有患者均手術切除腫塊,制作石蠟包埋切片,免疫組化法檢測ER、PR、Her-2表達情況。ER、PR 表達于細胞核,以黃染為陽性表達,陽性細胞數≥10%為判定陽性;HER-2 以細胞膜棕染為陽性表達,陽性細胞數≥10%為判定陽性[5]。
三、統計學處理
結 果
506例患者中,6例放棄治療或中途轉院,2例化療過程中出現嚴重并發癥給予剔除,最終498 例完成新輔助化療。498 例患者經新輔助化療后完全緩解191 例,部分緩解174例,穩定70例,進展63例,有效組365例,無效組133例。
一、新輔助化療前后腫塊大小比較
新輔助化療后乳腺腫塊長度、寬度、厚度、面積及體積均較化療前減小,差異均有統計學意義(均P<0.05)。見表1。
表1 498例患者新輔助化療前后乳腺腫塊大小比較
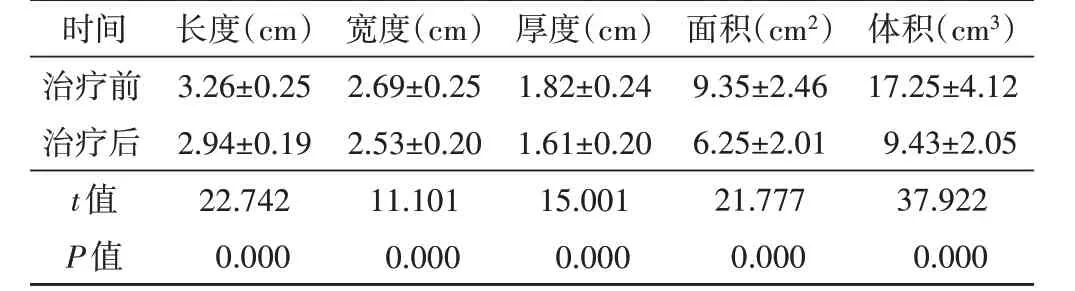
表1 498例患者新輔助化療前后乳腺腫塊大小比較
時間治療前治療后t值P值長度(cm)3.26±0.25 2.94±0.19 22.742 0.000寬度(cm)2.69±0.25 2.53±0.20 11.101 0.000厚度(cm)1.82±0.24 1.61±0.20 15.001 0.000面積(cm2)9.35±2.46 6.25±2.01 21.777 0.000體積(cm3)17.25±4.12 9.43±2.05 37.922 0.000
二、新輔助化療前后不同療效組患者腫塊大小比較
有效組、無效組化療前乳腺腫塊長度、寬度、厚度、面積及體積比較差異均無統計學意義。有效組化療后乳腺腫塊長度、寬度、厚度、面積及體積均較化療前減小,差異均有統計學意義(均P<0.05),無效組化療后乳腺腫塊長度、寬度、厚度、面積及體積較化療前無明顯變化;化療后有效組乳腺腫塊長度、寬度、厚度、面積及體積均低于無效組,差異均有統計學意義(均P<0.05)。見表2和圖1。
表2 新輔助化療不同療效組腫塊大小比較
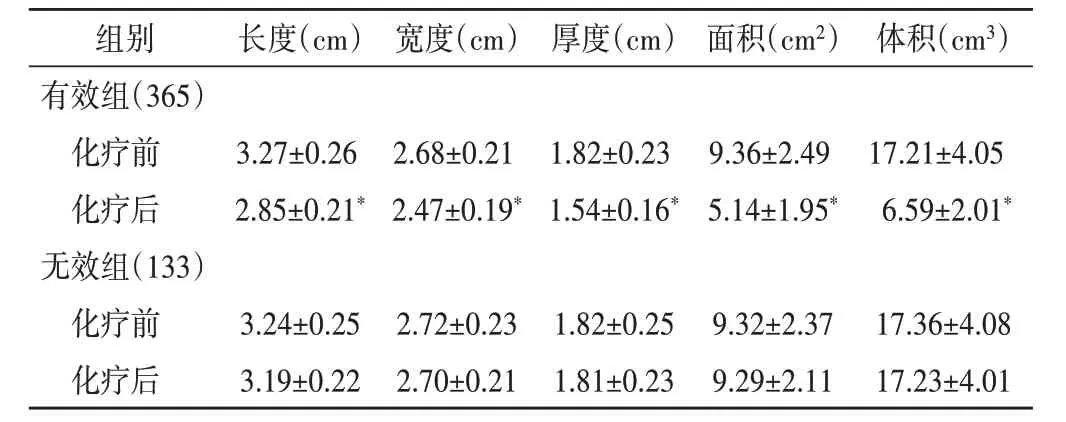
表2 新輔助化療不同療效組腫塊大小比較
與無效組化療后比較,*P<0.05
組別有效組(365)化療前化療后無效組(133)化療前化療后長度(cm)寬度(cm)厚度(cm)面積(cm2)體積(cm3)3.27±0.26 2.85±0.21*2.68±0.21 2.47±0.19*1.82±0.23 1.54±0.16*9.36±2.49 5.14±1.95*17.21±4.05 6.59±2.01*17.36±4.08 17.23±4.01 3.24±0.25 3.19±0.22 2.72±0.23 2.70±0.21 1.82±0.25 1.81±0.23 9.32±2.37 9.29±2.11
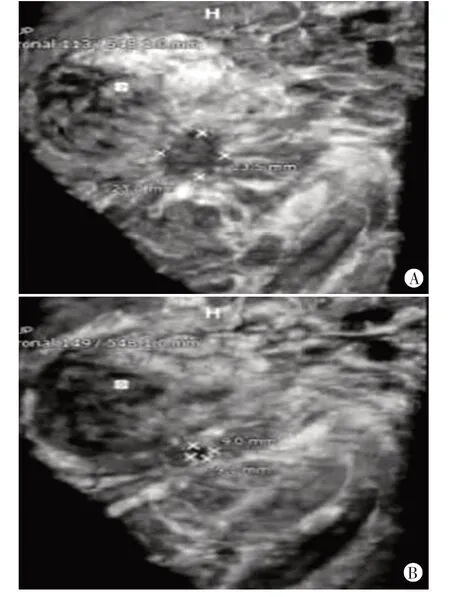
圖1 有效組乳腺癌新輔助化療前后同一腫塊ABVS圖
三、ER、PR、Her-2 不同表達患者術前ABVS 征象比較
ER、PR 陽性表達患者“毛刺征”、“匯聚征”檢出率均高于ER、PR 陰性表達患者(=10.367、13.540,=28.050、30.710,均P<0.05);ER、PR 不同表達患者乳腺腫塊形態、鈣化檢出率比較差異均無統計學意義。Her-2 陽性表達患者鈣化檢出率高于Her-2 陰性表達患者(χ2=26.646,P<0.05),Her-2 不同表達患者乳腺腫塊形態、“毛刺征”、“匯聚征”檢出率比較差異均無統計學意義。見表3。
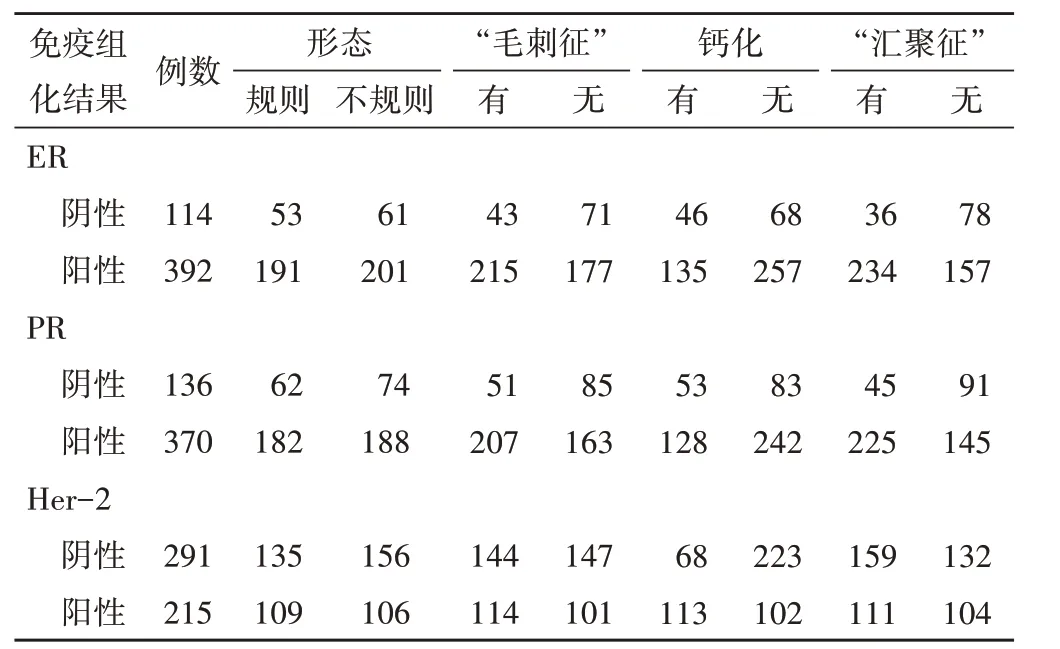
表3 ER、PR、Her-2不同表達患者術前ABVS征象比較 例
討 論
測量乳腺腫塊大小是保乳手術治療效果和預后評估的主要手段,乳腺鉬靶、常規超聲及彩色多普勒超聲均可測量乳腺腫塊大小,但乳腺鉬靶輻射性大,常規超聲分辨率和對比度低,斑點噪聲大,測量準確性不高,彩色多普勒超聲無法檢出化療后腫瘤殘留[6]。ABVS 是一種簡便的術前測量乳腺腫塊大小的影像學技術,可更清晰、直觀地觀察乳腺腫塊特征,為乳腺癌臨床診斷和療效評估提供更有價值的信息。
本研究通過ABVS 測量乳腺腫塊大小評價新輔助化療效果,發現化療后乳腺腫塊長度、寬度、厚度、面積及體積均較化療前縮小,且有效組上述指標縮小更明顯(均P<0.05),提示ABVS 可精準評價乳腺癌新輔助化療療效。Girometti 等[3]發現ABVS 在測量乳腺腫塊大小方面的準確性優于常規超聲,與MRI 測量結果相近,由于MRI 檢查過程繁瑣,禁忌癥多,費用高,故ABVS 在乳腺癌療效評估方面更具優勢。黃梅等[6]研究發現,ABVS 測量乳腺腫塊最大徑、面積及體積縮小率在評估新輔助化療治療反應性方面具有較高價值。ABVS 可以彌補常規超聲局限于某個斷面圖像的弊端,通過全容積多方位觀察圖像,多平面薄層重建圖像獲取橫切面、矢狀面、冠狀面及任意平面圖像,多層面顯示病灶情況,Workplace 系統提高了圖像辨識率,可達到MRI 斷層圖像和乳腺X 線反轉圖像的效果,清晰顯示腫塊邊界、數目,為乳腺癌臨床診斷和療效評估提供參考依據[7]。
ER、PR 陽性表達乳腺癌惡性程度高,具有高侵襲性和異質性,缺乏內分泌和靶向治療藥物,易產生化療耐受,治療反應性差[8]。Her-2 陽性表達、過度表達與乳腺癌細胞高增殖、侵襲力增強及復發轉移均有關[9]。乳腺癌ABVS常見征象包括“毛刺征”、鈣化、“匯聚征”等,其與ER、PR、Her-2表達的相關性尚不清楚。本研究以此為切入點追蹤術后免疫組化檢查結果,發現ER、PR 陰性表達患者“毛刺征”檢出率均較低,ER、PR陽性表達者“毛刺征”檢出率均較高,差異均有統計學意義(均P<0.05),提示無“毛刺征”腫塊侵襲力低,對內分泌治療敏感,預后好,有“毛刺征”者癌細胞侵襲性高[10]。另外,本研究中Her-2 陰性表達患者鈣化檢出率低,Her-2 陽性表達者鈣化檢出率高,差異有統計學意義(P<0.05),說明腫塊內鈣化與Her-2 過表達有關,提示含鈣化腫塊侵襲性高,預后較差[11]。與劉小慶等[12]研究結論一致。乳腺腫塊形態與其病變性質有關,形態規則多為良性腫瘤,形態不規則多為惡性腫瘤,本研究發現不同ER、PR、Her-2表達患者腫塊形態比較差異均無統計學意義,說明ER、PR、Her-2表達與乳腺腫塊形態均無明顯關系。“匯聚征”是乳腺癌典型征象,在乳腺腫塊性質鑒別、預后預測方面均有重要價值。本研究發現ER、PR 陰性表達患者“匯聚征”檢出率均較低,ER、PR 陽性表達者“匯聚征”檢出率均較高,差異有統計學意義(P<0.05),提示存在“匯聚征”的乳腺腫塊侵襲性高,治療反應性差。Xu等[13]發現乳腺癌“匯聚征”與腫瘤直徑、腋窩淋巴結狀態、組織學分級、ER 及PR 均有關,ER、PR 陰性表達患者缺乏“匯聚征”征象。上述結果提示通過ABVS 征象可指導臨床進行乳腺癌治療,監測治療反應性和評估預后,為靶向治療提供參考。
綜上所述,激素表達水平對ABVS 圖像特征有一定影響;ABVS 可準確評估乳腺癌新輔助化療效果,具有重要臨床應用價值。

