ACSS3基因在膠質瘤中的表達及臨床意義
高 論 劉駿輝 鄧 鋼 陳謙學
膠質瘤是成人中樞神經系統最常見的原發性顱內惡性腫瘤。其中,多形性膠質母細胞瘤(glioblastoma multiforme, GBM)預后最差,即使經過最大限度的手術切除后再輔以放化療,5年生存率不足5%,中位生存時間僅有12~15個月[1,2]。
根據2007年世界衛生組織(WHO)的分類方法,根據其惡性程度和組織學特征,膠質瘤被分為Ⅰ~Ⅳ級。雖然傳統的組織學分型方法為臨床醫師提供了不少幫助,但傳統的分類方法在早期診斷、早期治療和精確評估預后等方面存在不小的局限性。例如,即使是被診斷為同一分級的膠質瘤患者,在排除了治療方案、性別等臨床影響因素后,其患者的生存時間從數月到數年不整。因此,為實現膠質瘤的早期診斷、早期治療和改善患者預后,提高生存質量,探索和建立膠質瘤新的分類方法十分迫切[3]。在過去的數十年中,隨著高通量測序的快速發展和人類基因組計劃的順利完成,許多和膠質瘤預后相關的重要因子被發現,如MGMT、1p19q等。甲基鳥嘌呤甲基轉移酶(methyl guanine methyl transferase, MGMT)啟動子甲基化被認為是GBM對替莫唑胺(temozolomide, TMZ)化療耐藥的預測指標;1p/19q共缺失是少突膠質細胞瘤的分子學標志物,也是預測間變性膠質瘤對長春新堿(PCV)化療反應的標志物[4]。基因技術的進步使得用于膠質瘤分類的分子學標志物變得越來越重要。因此,分子學標志物和組織學特征一起被納入2016年修訂的WHO膠質瘤分類標準中。盡管新修訂的綜合診斷標準提高了膠質瘤診斷的準確性,促進了個體化治療的發展,然而目前的研究還不足以充分解釋膠質瘤的發病機制,臨床診治也不盡如人意。因此,為建立一個更加完善、精準的分類標準和改善膠質瘤患者預后,探索更多的新型膠質瘤診療相關標志物十分重要[5]。
ACSS3屬于酰基輔酶A合成酶短鏈家族成員之一,主要定位于線粒體。有文獻報道ACSS3是胃癌的預后標志物,該研究發現ACSS3在胃癌組織中表達上調,敲低ACS33抑制了胃癌細胞的增殖、遷移和侵襲。另外,ACSS3也可能通過消除細胞自噬應激而促進胃癌進展[6]。
材料與方法
1.數據獲取:本研究一共運用了6個數據集,其中,TCGA、Gravendeel和Rembrandt數據集從GlioVis數據庫下載(http:∥gliovis.bioinfo.cnio.es/)[7~9]。CGGA所使用的數據來源于中國膠質瘤基因組圖譜(http:∥www.cgga.org.cn/)中的mRNAseq_693 (batch 1)。把ACS33基因表達信息和臨床信息匹配。在所有數據集中,生存信息不完全或缺失的不被納入研究。TCGA數據集包括TCGA-GBM、TCGA-LGG和TCGA-GBMLGG。在TCGA數據庫中,膠質瘤被分為GBM和LGG(包括Ⅱ和Ⅲ級)。TCGA-GBM、TCGA-LGG 和TCGA-GBMLGG分別用于驗證ACS33在GBM、LGG和所有膠質瘤中能否作為預后標志物。從Cancer GSEA在線網站分析了ACSS3在膠質瘤和GBM中潛在的生物學功能(http:∥biocc.hrbmu.edu.cn/CancerSEA/home.jsp)[10]。
結 果
1.ACSS3在GBM中高表達:筆者從TCGA數據集中分析了GBM和正常腦組織中ACSS3的基因表達水平,與正常腦組織比較,ACSS3在GBM中的mRNA水平顯著增加,同樣的結果在Rembrandt數據集中得到證實(圖1A,P<0.01)。另外,ACSS3在GBM組中的表達水平明顯高于LGG組(圖1B,P=0.000)。ACSS3在IDH野生型和1p19q沒有共缺失的分組中表現出了較高的表達水平(圖1中C、D,P=0.000),而IDH野生型和發生1p19q缺失的膠質瘤與更差的預后相關。
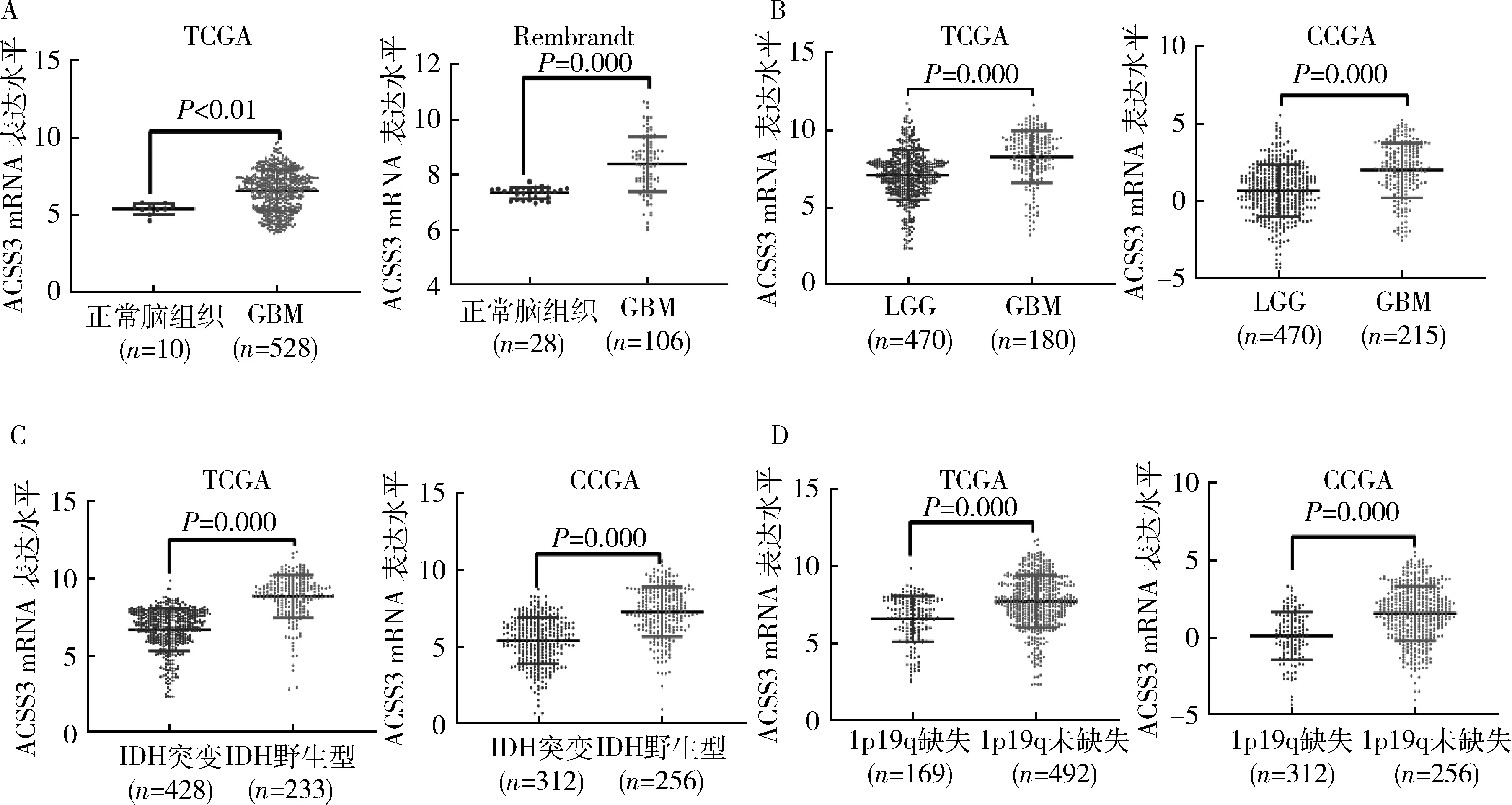
圖1 ACSS3在GBM中高表達A.TCGA和Rembrandt數據集分析顯示,ACSS3在GBM中表達水平高于正常腦組織;B.TCGA 和CGGA的數據分析表明ACSS3在GBM中的表達水平高于LGG;C.TCGA和CGGA數據分析顯示ACSS3在IDH野生型膠質瘤中表現出更高的表達水平;D.TCGA和CGGA數據分析表明ACSS3在1p19q缺失的膠質瘤中表達水平較低
2.ACSS3高表達與較差的膠質瘤預后相關:利用TCGA數據進行生存分析的結果表明,在GBM(圖2B,P=0.038)和LGG(圖2A,P=0.001)中,ACSS高表達組顯示出了更短的生存時間。同時,ACSS3也可以作為所有膠質瘤患者預后的標志物(圖2C,P=0.000)。為了進一步證實該結果,筆者利用Rembrandt和Gravendell數據集進行了生存分析,同樣證實了ACSS3是膠質瘤的預后標志物(圖2中D~I)。

圖2 ACSS3在TCGA、Rembrandt和Gravendeel數據集中的生存分析A、D、G.利用TCGA、Rembrandt和Gravendeel數據集驗證了ACSS3在LGG中與不良預后相關;B、E、H.利用TCGA、Rembrandt和Gravendeel數據集驗證了ACSS3在GBM中與更短的生存時間相關;C、F、I.利用TCGA、Rembrandt和Gravendeel數據集證明了ACSS3是膠質瘤的獨立預后因子
3.ACSS3參與了多種生物學進程: Cancer GSEA 在線網站的探究表明,ACSS3在膠質瘤中主要參與了EMT(相關系數為0.242,P=0.000)、新陳代謝(相關系數為0.176,P=0.005)和細胞分化(相關系數為0.165,P=0.009)等。在GBM中主要參與了缺氧(相關系數為-0.150,P=0.000)、細胞侵襲(相關系數為-0.180,P=0.000)和血管生成(相關系數為0.148,P=0.007)等生物學進程(圖3、表1)。

圖3 ACSS3參與了多種生物學進程紅色代表正相關,藍色代表負相關,圓圈越大,代表相關系數越大

表1 ACSS3在膠質瘤和GBM中參與的生物學進程
討 論
膠質瘤是中樞神經系統最常見的惡性腫瘤,約占原發性中樞神經系統腫瘤的50%,外科手術、化療和放療是治療神經膠質瘤的最常見形式[11]。盡管先前的組織病理學分類方法對臨床診斷和治療提供了很大的幫助,但同時也存在一定的局限性。2016年5月世界衛生組織發布了最新版本的膠質瘤分類標準,提供了比單純基于組織病理學分類更精確的分類方法。它引入了分子標記,如IDH1/2突變狀態和1p/19q共缺失,這些都是世界公認的高預測價值的分子標記。膠質瘤的分子水平研究取得了很大的進步,對臨床診斷的個體化治療提供了新的策略。筆者研究證明了ACSS3是一個有趣的預后標志物。
本研究發現,ACSS3在GBM中的表達水平明顯高于正常腦組織和LGG。另外還發現ACSS3在IDH野生型膠質瘤中的表達水平顯著高于IDH突變型膠質瘤,IDH野生型膠質瘤已被多項研究證明擁有更差的預后。同時,本研究還發現,1p19q缺失的膠質瘤的ACSS3表達水平明顯低于未發生缺失的膠質瘤。1p19q共缺失的膠質瘤往往預示著更好的預后以及對烷基化化療的不良反應增加,這些結果與筆者的研究結果一致[12]。因此,進一步確定ACSS3不僅可以作為GBM的預后標記,還能作為LGG的預后標志物,高表達的ACSS3預示著更短的生存時間。
本研究還發現ACSS3在膠質瘤中參與了EMT的生物學進程,EMT是一個動態的可逆性表型轉化過程,它能使極化的上皮細胞獲得間充質特征,從而增強細胞的遷移和侵襲的能力。EMT將良性腫瘤轉化為侵襲性、轉移性腫瘤,在調節腫瘤的進展和轉移中發揮了關鍵作用[13,14]。惡性膠質瘤容易復發的一個重要原因是腫瘤細胞會入侵周圍正常的腦組織,為了獲得這種侵襲能力,膠質瘤細胞通常會經歷幾個生物學變化,包括獲得移動性、降解細胞外基質(extracellular matrix, ECM)的能力[15]。
膠質瘤的腫瘤發生顯著提高了膠質瘤內微血管的密度,而血管生成對于膠質瘤的生長、遷移和侵襲至關重要。同時血管生成被認為是腫瘤惡性進展的一個關鍵事件,異常的血管增生也被認為是GBM不良預后的主要原因之一[16,17]。ACSS3在GBM中與血管生成密切相關,這表明ACSS3可能參與了膠質瘤的發生和發展,是導致GBM不良預后的一個關鍵點之一。GBM細胞不受控制的快速增殖導致血管遠端高度缺氧區域形成,癌細胞對這種低的氧氣分壓起反應,并通過刺激新血管形成為腫瘤細胞提供所需的氧氣和營養,從而確保腫瘤的存活和增殖。然而,這種致密的腫瘤血管網絡反過來又有助于形成缺氧區域,造成惡性循環。此外,缺氧環境限制了放療和化療藥物的有效性,對患者的預后產生負面影響,并且可能是導致腫瘤復發的機制之一[18,19]。ACSS3和缺氧存在顯著的相關性,這和其與血管生成又相互聯系起來。
綜上所述,本研究證實ACSS3是一個敏感的預后標志物,尤其對GBM的早期診斷和預測預后具有重要意義。同時,ACSS3參與了眾多的生物學過程,在腫瘤的發生、發展、預后等方面發揮著重要而復雜的作用,可能成為膠質瘤治療的新靶點。盡管本研究利用了多個數據庫,對數以千計的樣本進行研究,結果較為準確。但是本研究只是局限于對大量膠質瘤樣本的初步分析得出的結論,缺少利用自己的樣本去進一步驗證。同時,對于ACSS3在膠質瘤發生、發展中潛在的生物學功能也缺少在細胞水平和動物體內的驗證。今后筆者將在條件允許的情況下利用體內和體外實驗對ACSS3在膠質瘤發生、發展方面的分子機制進行研究。

