抑真菌伯克霍爾德氏菌Z1的分離鑒定及其抑菌物質分析
唐 瀅,雷 平*,張翠央,畢世宇,郭照輝,2,劉清術,2
(1.湖南省微生物研究院,中國湖南 長沙 410009;2.湖南省農用微生物應用工程技術研究中心,中國湖南 長沙 410009)
植物病原真菌引起的土傳病害嚴重影響農產品質量和數量,若防治不當將造成重大經濟損失[1]。目前,化學農藥仍是作物病害管理的主力軍。然而,化學殺菌劑的長期使用會污染環境,引起病原菌耐藥,甚至會導致作物根際有益菌群的丟失。而且,病原真菌能以孢子形式在土壤中長期存在,一次噴灑難以徹底清除。生防菌劑能在土壤中長期存活,可通過分泌抑菌物質等機制抑制病原菌生長,提高作物抗病能力,是綠色、環保的病害防治方法,能促進農業可持續發展,改善農產品質量。
植物根際中存在著一類能夠促進植物根系生長和礦物質吸收、增強植物抗病性的細菌,即植物促生根際菌(plant growth promoting rhizobacteria,PGPR)[2]。芽孢桿菌屬(Bacillus)、鏈霉菌屬(Streptomyces)的許多PGPR已經被開發為商業生防菌劑,如枯草芽孢桿菌(B.subtilis QST 713,Serenade?MAX)、利迪鏈霉菌(S.lydicus WYEC 108,Actinovate?AG)等[3]。通常,健康作物的根際是分離PGPR的重要來源。近年來研究表明,作物經人工馴化種植后會丟失共生有益菌群[4]。例如:野生西紅柿連續種植7年后,會丟失一部分共生菌且對鐮刀菌和鏈格孢菌的易感性增強,而施用野生西紅柿根際土壤后,其抗病能力得到恢復[5]。棉花、玉米等其他作物中也存在類似現象[6~7]。因此,在沒有作物管理的自然環境中生長的野生植物是分離新PGPR的重要來源,但目前較少被關注。
伯克霍爾德氏菌屬(Burkholderia)隸屬于變形菌門、β-變形菌綱,具有豐富的代謝多樣性及較強的適應能力,在環境中分布廣泛,于1992年從假單胞菌屬獨立出來,成為新屬。該屬第一個成員為石竹伯克氏菌,于1942年從康乃馨中分離得到,原名石竹單胞菌,后改為石竹假單胞菌。伯克霍爾德氏菌屬中的許多菌株通常在基因水平上有差異而表型沒有差異,因此該屬的新種鑒定工作非常復雜,難度大。研究人員將這些在基因序列上有差異而表型相似的菌株稱為基因組變異型(genomovar)[8]。因此,伯克霍爾德氏菌屬是一個異質性復系群,其中的許多菌株在分類學上頗具爭議。隨著序列分析技術的發展,研究人員對該屬的多個種進行了重新分類。具有固氮、降解能力且營自由生活的一部分菌株(如B.xenovorans LB400)在2014年被移至Paraburkholderia屬;生活在真菌體內且基因組非常小的菌株(如B.rhizoxinica)于2018年被移至Mycetohabitans屬。截至2020年7月,該屬已報道的菌株有143株,其中32株為正式有效發表的模式菌株[9]。許多伯克霍爾德氏菌都具有抑制植物病原菌生長、促進植物生長、修復土壤等功能,在農業生產和環境保護方面起著重要作用。
本研究從野生植株根際土壤取樣,采用針對伯克霍爾德氏菌屬的選擇性培養基進行分離[10],經多次純化后,獲得伯克霍爾德氏菌Z1,隨后探究了它對多種植物病原真菌的抑菌活性,初步分析了其分類地位及生理生化特征,并對其產生的抑菌物質進行了深入探討。這些工作為靶向性篩選新PGPR開辟了新道路,而且所得菌株Z1具有的良好抑真菌活性也為將來開發新的生防菌劑奠定了基礎。
1 材料與方法
1.1 材料
于2019年自湖南省長沙縣青山鋪鎮山丘采集野生竹子根際土樣。供試植物病原菌包括:水稻紋枯病菌立枯絲核菌(Rhizoctonia solani Kuhn)、香梨腐爛病原菌迂回殼囊孢菌(Cytospora ambiens)、西瓜枯萎病原菌腐皮鐮刀菌(Fusariums solani)、辣椒炭疽病菌(Colletotrichum capsici)和油菜核盤菌(Sclerotinia sclerotiorum),其中,立枯絲核菌為湖南省植物保護研究所惠贈,其余均為本實驗室保藏。菌株Z1已送至廣東省微生物菌種保藏中心保藏,編號為GDMCC 61058。
菌株分離純化所用培養基為針對伯克霍爾德氏菌屬的選擇性培養基,其配方由Haeckl等[10]在對多株伯克氏菌基因組序列進行分析后設計而成。病原真菌的培養采用PDA(potato dextrose agar)培養基;液體發酵培養采用NBY(nutrient broth yeast extract)培養基[11];平板培養采用CYMG(casitone yeast extract magnesium chloride glycerol)培養基,其配方如下:酪蛋白胨8 g,酵母提取物4 g,二水氯化鎂4.06 g,50%甘油10 mL,瓊脂15 g,去離子水1 L。血平板及革蘭氏染色所用試劑盒均購自廣東環凱微生物科技有限公司。
1.2 根際細菌的分離純化
將5 g含有根系的根際土壤放入裝有45 mL無菌Ringer洗液(7.5 g/L NaCl,0.35 g/L KCl,0.21 g/L CaCl2)的搖瓶中[12],于30℃、180 r/min振蕩30 min。靜置后,上清用Ringer洗液依次稀釋至10-3、10-4、10-5,取200 μL涂布平板,每個梯度3個重復[13]。待出現菌落后,用接種針挑取邊緣光滑的單菌落進行平板劃線分離。
1.3 菌株Z1抑制植物病原真菌活性的測定
采用對峙培養法[14]檢測篩選出來的細菌Z1的抑真菌活性。將在PDA平板上培養2~3 d的病原真菌用打孔器在菌絲生長外緣打若干孔,用接種針將菌絲塊取出,放置在一個新的PDA平板中央,在距離中央3 cm處用接種環點接篩選出來的細菌,28℃共培養3~5 d,觀察并測量抑菌圈大小。
1.4 菌株Z1的形態特征觀察、全基因組測序及序列分析
將菌株分別接種于CYMG及血平板上,培養2~4 d后,肉眼觀察菌落形態及周圍是否出現溶血圈。取新鮮稀釋菌液制備臨時裝片,借助蔡司相差顯微鏡(Zeiss,德國)觀察菌株細胞形態。細菌染色采用革蘭氏染色法。
取單菌落接種于NBY培養基中,培養2 d后收集菌體,無菌蒸餾水洗滌1次后再次懸浮,取1 μL作為16S rRNA基因的PCR擴增模板。PCR擴增體系(30 μL):PrimeSTAR?Max(TaKaRa公司,日本)15 μL、引物 27F/1492R(10 μmol/L)各 1 μL、模板 1 μL、ddH2O 12 μL。擴增條件:98 ℃ 5 min;94℃15 s,55℃15 s,72℃35 s,35個循環;72℃10 min。采用DNA膠回收試劑盒(上海捷瑞生物工程有限公司)回收目標PCR產物,并將其送至湖南擎科生物技術有限公司測序。從Z1的全基因組序列中調取recA基因序列。將所得recA及16S rRNA基因序列分別與EzBioCloud、NCBI數據庫中相應序列進行比對[15],經Clustal Omega多序列比對分析[16]后,利用軟件Mega 7.0構建系統進化樹[17]。Z1的16S rRNA基因及recA基因的序列均已提交至GenBank,其序列登錄號分別為MT804577和 MT798856。
用NBY培養基培養Z1,離心收集菌體,用TEN緩沖液(0.01 mol/L Tris-Cl,pH 8.0;0.001 mol/L EDTA,pH 8.0;0.1 mol/L NaCl)洗滌一遍后,離心并棄去上清,將菌體寄至武漢貝納科技服務有限公司,采用Nanopore PromethION及Illumina Nova-Seq 6000進行全基因組測序。從JGI(Joint Genome Institute,https://img.jgi.doe.gov/)和NCBI(https://www.ncbi.nlm.nih.gov/)下載同源菌株的全基因組序列,用在線工具Genome-to-Genome Distance Calculator(http://ggdc.dsmz.de/ggdc.php)計算Z1與近緣菌株的DNA-DNA雜交值(digital DNA-DNA hybridization,dDDH)[18]。采用在線平均核苷酸一致性(Average Nucleotide Identity,ANI)計算工具(https://www.ezbiocloud.net/tools/ani)算得 ANI 值[19]。采用GCK 3.0(Gene Construction Kit 3.0)進行在線限制性片段長度多態性(restriction fragment length polymorphism,RFLP)分析。采用antiSMASH bacterial version(https://antismash.secondarymetabolites.org)預測Z1基因組中的次級代謝產物生物合成基因簇[20]。Z1的基因組序列及相關信息已提交至NCBI,其BioProject、BioSample及基因組序列登錄號分別為 PRJNA649092、SAMN15658474及 JACFYL-000000000。
1.5 菌株Z1的生理生化特征分析
用法國梅里埃公司(bioMérieux)的試紙條API 20NE、API ID 32GN、API 50CH 及 API ZYM 檢測Z1的生理生化特征。其中,API 20NE用于檢測硝酸鹽還原、七葉苷檸檬酸鐵與凝膠水解及菌株對部分碳源的利用情況;API ZYM試紙條用于酶活測定;API 50CH試紙條用來檢測菌株的發酵產酸情況;API ID 32GN用來檢測菌株對32種碳水化合物的利用情況。各項操作均按照試紙條說明書進行。
1.6 代謝產物的提取及高分辨質譜分析
采用NBY培養基進行發酵,接種量為5%[11]。30℃培養72 h后,添加大孔樹脂XAD-16(Amberlite?,美國),繼續培養24 h后,離心收集菌體及XAD-16,棄上清,加入等體積甲醇浸提30 min,旋轉蒸發儀濃縮后溶于1 mL甲醇中。
發酵液提取物經最高轉速離心10 min后過濾,寄送至山東大學微生物技術國家重點實驗室進行高分辨質譜(high resolution mass spectrum,HRMS)分析。所用儀器為Bruker Impact HD microTOF QⅢ質譜儀(Bruker Daltonics,德國),采用標準的電噴霧離子源。色譜柱為Thermo Scientific Acclaim C18 column(2.1 mm × 100 mm,2.2 μm)。流動相為含有0.1%甲酸的水及乙腈。
2 結果與分析
2.1 伯克氏菌Z1的分離及其抑真菌活性
從野生禾本科植物根際中分離到一株對多種植物病原菌均有較強抑制效果的細菌,命名為Z1。其對香梨腐爛病原菌迂回殼囊孢菌(C.ambiens)、西瓜枯萎病原菌腐皮鐮刀菌(F.solani)、辣椒炭疽病菌(C.capsici)、油菜核盤菌(S.sclerotiorum)及水稻紋枯病菌立枯絲核菌(R.solani Kuhn)的抑菌圈直徑分別 14 mm、4 mm、12 mm、12 mm 和 10 mm,顯示出較廣的抑菌譜(圖1)。
2.2 菌株Z1的形態特征
菌株Z1在CYMG平板上可形成直徑1~2 mm的菌落,圓形,黃白色,表面光滑,邊緣整齊,不透明,不產生熒光,中間凸起不明顯,培養48 h后可產生紅色色素(圖2A),但隨著培養時間的延長該色素又會自行消失。這一現象在伯克霍爾德氏菌中很常見,具體機制至今不明。相差顯微鏡下菌體為桿狀(圖2B),革蘭氏染色呈陰性。在血平板上培養48 h后,菌株Z1能產生明顯的溶血圈(圖2C),且培養時間越長,溶血圈越大。

圖1 菌株Z1對5種植物病原真菌的抑菌活性(A)香梨腐爛病原菌迂回殼囊孢菌;(B)西瓜枯萎病原菌腐皮鐮刀菌;(C)辣椒炭疽病菌;(D)油菜核盤菌;(E)水稻紋枯病菌立枯絲核菌。Fig.1 The inhibitory activity of strain Z1 against five phytopathogenic fungi(A)C.ambiens,the causative agent of fragrant pear canker;(B)F.solani,the causative agent of cucurbits fusarium wilt;(C)C.capsici;(D)S.sclerotiorum;(E)R.solani Kuhn,the causative agent of rice sheath blight.

圖2 菌株Z1的菌落、菌體形態及溶血圈(A)CYMG平板上的菌落形態;(B)相差顯微鏡下的菌體特征(2 000×);(C)菌株培養48 h后,在血平板上出現明顯的溶血圈。Fig.2 The colony,cell morphology and the hemolytic zone of Z1(A)Colony of Z1 on CYMG plate;(B)Z1 under phase contrast microscope(2 000×);(C)The hemolytic zone produced by Z1 on sheep blood agar after 48 h incubation.
2.3 菌株Z1的基因型特征
16S rDNA序列同源性是進行菌種分類的重要指標。大多數情況下,98.7%的16S rDNA序列同源性為判定新種的分界點[21]。但亦有超過該值的細菌被鑒定為新種,如2013年在International Journal of Systematic and Evolutionary Microbiology上發表的微桿菌屬新種Microbacterium saccharophilum,其與同屬菌株的最高同源性達99.87%[22]。以菌株Z1的菌液為模板,用引物27F/1492R成功擴增到了1.5 kb左右的條帶(圖3),測序后其大小為1 355 bp。在EzBioCloud數據庫中比對該序列,得知其與Burkholderia contaminans LMG23-361的親緣關系最近,同源性達99.56%。選取鄰近17個菌株的同源序列構建進化樹(圖4),從圖中可知,Z1與B.contaminans LMG23361的進化距離很近。
當16S rDNA序列同源性高于97%時,需要測定同源菌株間的dDDH值,該值大于70%為同種,低于70%為不同種[21]。由表1可知,Z1與其近緣菌株B.contaminans LMG23361、B.contaminans MS14、B.pyrrocinia Lyc2、B.pyrrocinia DSM10685及B.cepacia ATCC25416的dDDH值在44.50%~52.70%,低于閾值70%,說明菌株Z1與這5株近緣菌株的差異達到種間水平,可作為判定新種的依據。

圖3 菌株Z1的16S rDNA擴增電泳檢測圖M:分子量標準DL5000;Z1:菌株Z1的16S rDNA擴增產物。Fig.3 Electrophoresis analysis of PCR products of the gene encoding 16S rRNA of strain Z1M:DL5 000 marker;Z1:The 16S rDNA PCR products of Z1.
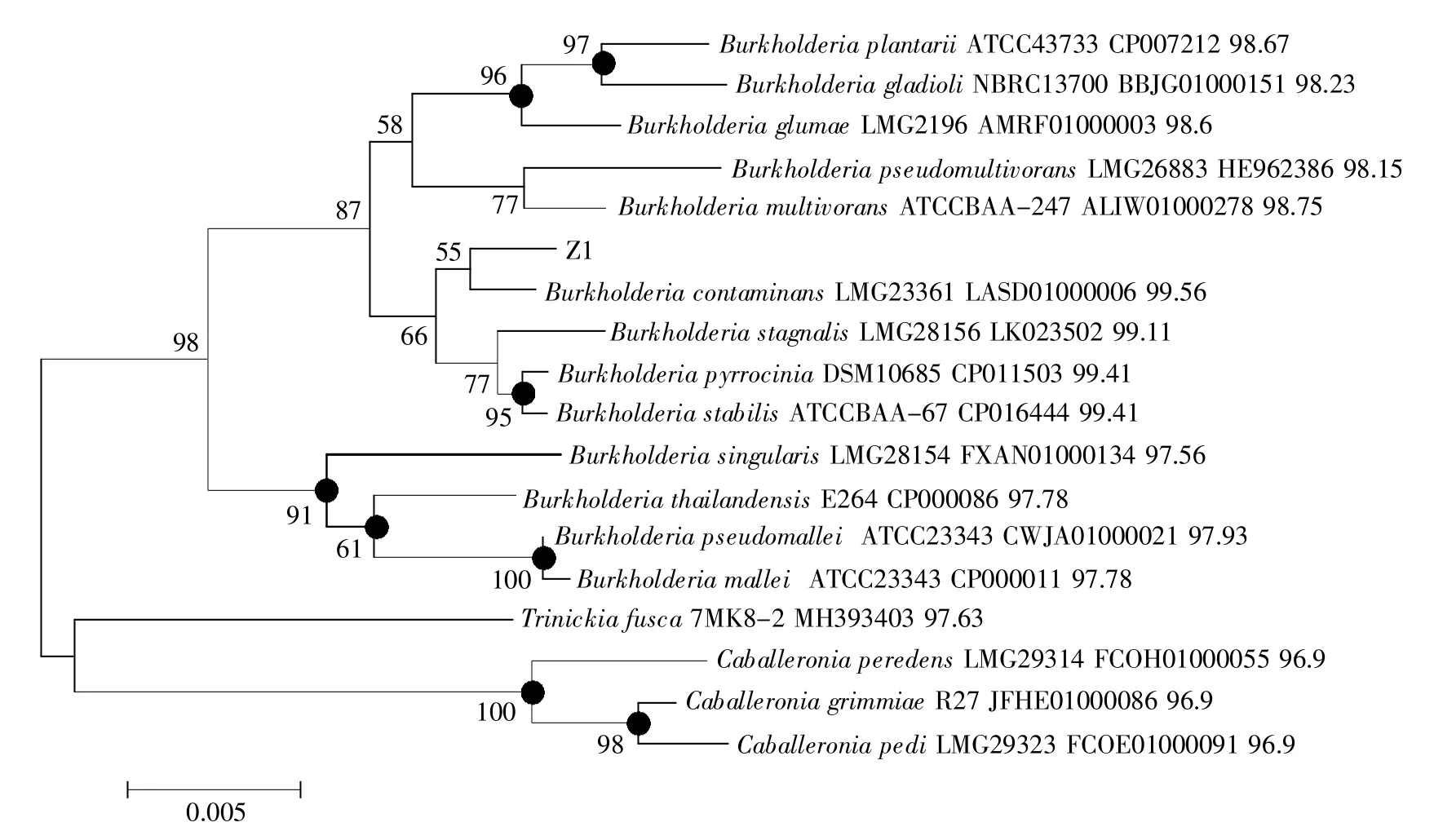
圖4 菌株Z1的16S rDNA系統進化樹(鄰接法)圖中顯示了菌株Z1及17個來自EzBioCloud數據庫的同源菌株的分類地位。替換模型為Kimura 2-parameter;分支處的數值為大于50%的步長值(重復1 000次)。黑點代表該分支與用最大可能性法構建時結果一致。菌種拉丁名后依次為菌株編號、序列登錄號及與Z1的同源性。Fig.4 Neighbor-joining phylogenetic tree based on 16S rRNA gene sequence of strain Z1The relationships between strain Z1 and members of the genus Burkholderia are shown.Substitution model is Kimura 2-parameter.Bootstrap values(expressed as percentages of 1 000 replications)above 50%are shown at the branch points.Black dots denote branches recovered using maximum likelihood method.The strain number,sequence accession number and similarity are presented in order after the strain name.
ANI值指兩個微生物基因組同源片段之間的平均堿基相似度,在近緣物種之間有較高的區分度。一項基于9萬個基因組的分析表明,不同物種間的基因組ANI小于95%,同一物種的基因組ANI大于95%[23],因此可以95%的ANI為物種劃分與物種聚類的標準。由表1可知,Z1與上述5個近緣物種的ANI值在91.54%~93.52%,均低于95%,雖達到判定新種的標準,但數值非常接近95%,故仍需更多數據才能確定其是否為新種。
由于伯克霍爾德氏菌的16S rDNA序列過于保守,為獲得更準確的分類信息,我們對Z1與其同源菌株的recA基因序列同源性進行了分析。基因recA的序列已被證實能在伯克霍爾德氏菌屬內區分70多個種,具有很好的鑒別功能[24]。在NCBI數據庫中,與Z1的recA基因同源性最高的菌株為 B.pyrrocinia DSM10685,同源性 97.75%(表1)。從基于recA基因序列構建的進化樹上亦可看出,Z1與B.pyrrocinia DSM10685的親緣關系較近,但是二者位于不同分支,分支處的步長值(bootstrap value)為 82,可信度高(圖 5)。
洋蔥伯克氏菌群(Burkholderia cepacia complex,Bcc)包含多個表型相似、基因型不同的菌株,目前已鑒定出9個基因組變異型(genomovarⅠ~Ⅸ),每個基因組變異型又包含多個表型相似、基因型不同的菌株。其中,基因組變異型Ⅲ(B.cenocepacia)和基因組變異型Ⅱ (B.multivorans)為引起囊性纖維化的主要病原菌[25];基因組變異型Ⅸ的種名為B.pyrrocinia。Bcc中不同種間的recA基因同源性在94%~95%,同種相似度在98%~99%[25]。從表1可知,Z1的recA基因與B.pyrrocinia DSM-10685的同源性為97.75%,低于界定同種的閾值,但是比較接近。采用內切酶HaeⅢ對這兩段序列進行RFLP分析,Z1的recA基因完全酶切消化后得到的DNA片段長度分別為144 bp、546 bp、583 bp、772 bp、843 bp、864 bp、876 bp、940 bp 和1 009 bp,而B.pyrrocinia DSM10685所得片段長度為 144 bp、538 bp、546 bp、583 bp、772 bp、864 bp、876 bp、940 bp和1 009 bp,兩者僅有一個酶切位點的差異,因此我們認為Z1應為基因組變異型Ⅸ的一個新成員。
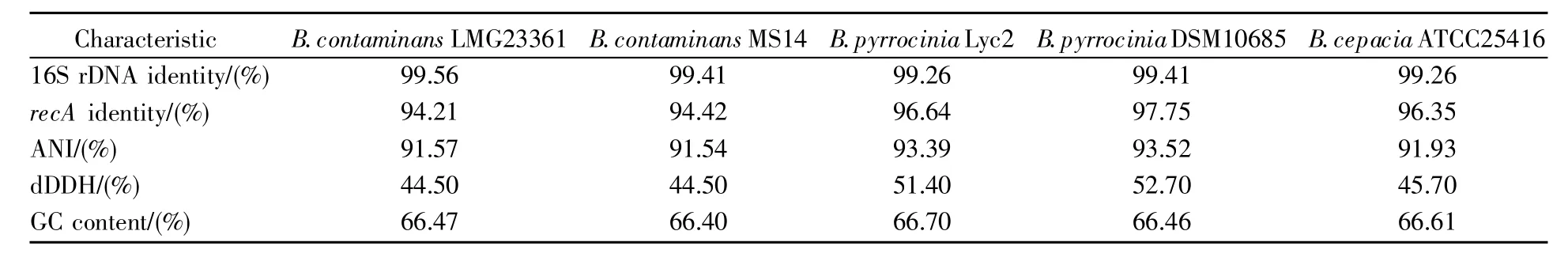
表1 菌株Z1與同屬近緣菌株間的16S rDNA同源性、recA基因同源性、ANI值、dDDH值及GC含量比較Table 1 Comparison of the 16S rDNA and recA gene identity,ANI,dDDH,and GC content between Z1 and the closely related species of the genus Burkholderia

圖5 基于recA基因序列分析構建的進化樹Fig.5 Phylogenetic tree based on gene recA sequence analysis
2.4 菌株Z1的生理生化特征
為全面了解菌株Z1對碳源的利用情況及其酶活等各項生理生化特征,我們用梅里埃試紙條對Z1進行了測定。經試紙條測定,菌株Z1能將硝酸鹽還原成亞硝酸鹽,能水解七葉苷檸檬酸鐵、凝膠及4-硝基苯-β-D-吡喃半乳糖苷,不能產生色氨酸酶、脲酶、精氨酸雙水解酶、纈氨酸芳胺酶、胱氨酸芳胺酶、胰蛋白酶、胰凝乳蛋白酶、α-半乳糖苷酶、β-半乳糖苷酶、β-糖醛酸苷酶、α-葡萄糖苷酶、β-葡萄糖苷酶、N-乙酰-葡萄糖胺酶、α-甘露糖苷酶、β-巖藻糖苷酶,能產生堿性磷酸酶、酯酶(C4)、類脂酯酶(C8)、類脂酶(C14)、亮氨酸芳胺酶、酸性磷酸酶、苯酚-AS-BI-磷酸水解酶,能發酵阿拉伯糖、木糖、D-側金盞花醇、半乳糖、葡萄糖、乳糖、纖維二糖、麥芽糖、巖藻糖產酸,能同化葡萄糖、葡萄糖酸鉀、N-乙酰葡萄糖胺、阿拉伯糖、甘露糖、甘露醇、乙酰葡萄糖胺、麥芽糖、羊蠟酸、己二酸、蘋果酸、檸檬酸鈉、苯乙酸、D-核糖、肌醇、蔗糖、辛二酸鹽、L-丙氨酸、5-酮基-葡萄糖酸鹽、L-絲氨酸、D-蜜二糖、L-巖藻糖、D-山梨醇、組氨酸、2-酮基-葡萄糖酸鹽、L-脯氨酸。經與文獻中同源菌株相應數據[26~28]比較,發現菌株Z1的大部分生理生化特征與吡咯伯克霍爾德氏菌一致,僅個別指標存在差異(表2),這支持了其為基因組變異型Ⅸ中一員的結論。
2.5 基因組分析
伯克霍爾德氏菌生活范圍廣,適應能力強,代謝種類多樣,因而其基因組也較大,平均約7.5 Mb,大小位列細菌的前5%。伯克霍爾德氏菌的大多數種都含有兩條染色體,0~6個質粒。生活在真菌體內的B.rhizoxinica(現已更名為M.rhizoxinica)例外,只含有1條染色體,其基因組大小為3.75 Mb。不同于鏈霉菌等其他細菌,大多數伯克霍爾德氏菌的必需基因與非必需基因分別位于兩條不同的染色體上[29]。
經全基因組測序及拼接獲得菌株Z1的基因組序列,其含有兩條染色體(3.7 Mb和3.5 Mb)及1個大質粒(1.2 Mb),總長8.4 M,GC含量66.28%。經在線次級代謝產物生物合成基因簇預測軟件antiSMASH分析,我們發現其基因組中含有萜類(terpene)、細菌素(bacteriocin)、非核糖體肽(nonribosomal peptide,NRP)等15個次級代謝產物的生物合成基因簇,其中一個長約94 kb的基因簇與occidiofungin的生物合成基因簇相似度達88%。
2.6 菌株Z1的抑真菌物質分析
伯克霍爾德氏菌產生的抑真菌物質種類豐富,包括 burkholdines[30]、occidiofungins[31]及 pyrrolnitrin[32]等。其中,burkholdines和occidiofungins屬于環脂肽,能夠裂解血細胞,且兩者結構非常相似,在骨架上只有一個氨基酸不同(圖6)。Occidiofungins由1個β-羥基天冬酰胺(β-hydroxy asparagine,BHN)、1 個 β-羥基酪氨酸(β-hydroxy tyrosine,BHY)、兩個絲氨酸、1個甘氨酸、1個天冬酰胺、1個2,4-二氨基丁酸(2,4-diamino butyric acid,DABA)及1個來源于脂肪酸途徑的非蛋白氨基酸脫水縮合而成。而burkholdines的骨架中沒有DABA,取而代之的是天冬酰胺。兩者均含有1個由11個碳原子組成的直鏈烷烴及1個木糖。
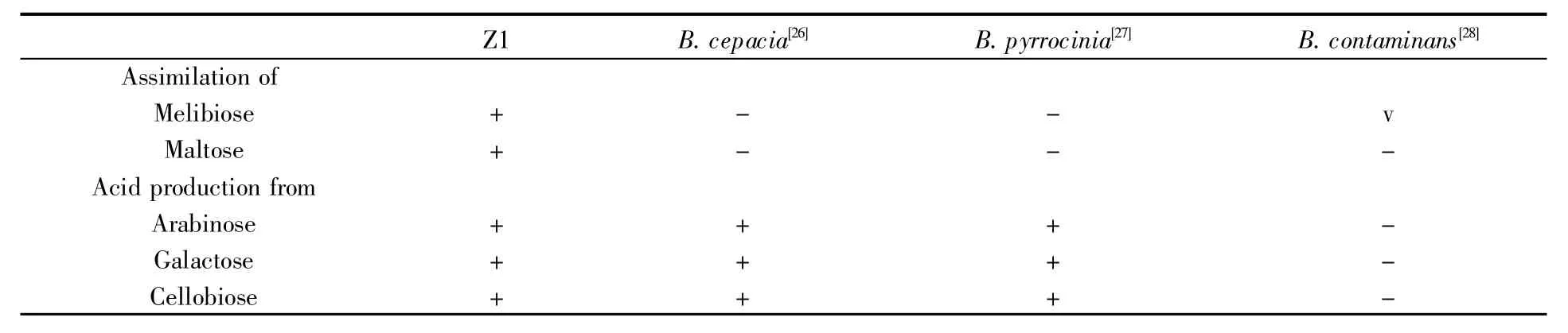
表2 菌株Z1與同屬近緣菌株的表型差異特征Table 2 Differential phenotype characteristics of strain Z1 and strains of closely related species of the genus Burkholderia
菌株Z1能抑制多種植物病原真菌及白色念珠菌,其基因組中含有與抑真菌環脂肽occidiofungin生物合成基因簇高度同源的基因簇。為進一步探討Z1抑真菌活性物質的成分,我們對該菌的發酵液進行了高分辨質譜分析。從質譜結果中可找到質荷比為1 216.588 3[M+H]+(calcd for C52H86N11O22,1 216.594 3,4.9×10-6)的峰,該值與occidiofungin B的相對分子質量非常接近;除此之外,亦能找到質荷比為1 214.571 4[M+H]+(calcd for C52H84N11O22,1 214.578 7,6.0×10-6)及 1 230.564 1[M+H]+(calcd for C52H84N11O23,1 230.573 6,7.7×10-6)的峰,這與 burkholdine-1213和 burkholdine-1229的相對分子質量也非常接近。對于1 215.556 5[M+H]+、1 083.515 3[M+H]+、1 231.550 1[M+H]+和1 099.507 4[M+H]+,目前尚未在已報道文獻中找到與其相對分子質量一致的化合物,但是它們的二級質譜碎片離子與文獻報道的burkholdine-1097的許多碎片離子[33]相同,且兩兩相差132 Da,與丟失木糖的片段吻合,木糖的相對分子質量為150 Da(圖7),因此我們推測其可能為burkholdine的新衍生物。

圖6 Occidiofungin B、burkholdine-1213及burkholdine-1229的結構、分子式和相對分子質量紅色部分為兩種環脂肽在骨架上的不同之處。Fig.6 The structure,chemical formula and monoisotopic mass of occidiofungin B,burkholdine-1213 and burkholdine-1229The red color indicates the difference between the backbones of occidiofungins and burkholdines.
據報道,某些能產生occidiofungins或burkholdines的伯克氏菌株可在血平板上產生溶血圈[34]。菌株Z1在血平板上培養48 h后,菌落周圍亦出現了非常明顯的溶血圈(圖2C)。結合高分辨質譜分析結果,我們推測菌株Z1產生的抑真菌物質很可能為 occidiofungin B、burkholdine-1213、burkholdine-1229及burkholdine的新衍生物。
3 討論
伯克霍爾德氏菌屬的細菌能以自由生活或寄生的方式廣泛存在于陸地、水域等多種環境中。許多伯克霍爾德氏菌均具有生物防治的功能,例如:B.rinojensis能抑殺節肢動物,可開發為殺蟲劑[29];B.contaminans等菌株能合成多種抗真菌物質。有些伯克霍爾德氏菌能促進植物的生長,在農業生產中可將其用作生長調節劑或復合肥料,如具有固氮功能的B.ambifaria和B.caribensis。另外,有的伯克霍爾德氏菌還可以分解土壤中殘留的農藥、凈化污水[29]。20世紀90年代,美國環保局批準用于多種植物病原真菌防治的菌劑Deny?、Blue Circle?及Intercept?等的主要成分均為伯克霍爾德氏菌[35],在我國亦有類似產品,如“亞寶”。此外,也有一些伯克霍爾德氏菌株是動植物病原菌。
本研究采用選擇性培養基從野生竹子根際靶向性篩得伯克霍爾德氏菌Z1,其具有廣譜抑真菌活性(圖1)。與其16S rRNA基因及recA基因序列同源性最高的菌株分別為B.contaminans LMG-23361 和 B.pyrrocinia DSM10685(表 1,圖 4~5)。兩者都是Bcc成員,其基因組中均含有大量抑菌活性天然產物的生物合成基因簇,但不含有主要致病因子[36]。這將大幅降低大規模應用時的安全風險。雖然Z1與多株近緣菌株間的dDDH值及ANI值均低于新種鑒定閾值,達到界定新種的標準(表1),但有差異的生理生化指標不多(表2)。鑒于伯克霍爾德氏菌屬新種鑒定的復雜性,本論文不敢貿然將該菌認定為新種。該菌與近緣菌株間確實存在差異。Bcc菌群目前已有9個基因組變異型,每個基因組變異型又包含多個菌株,它們的形態特征非常相似,但基因組水平上的差異達到新種鑒定標準[8]。綜合本文對Z1及其近緣菌株的基因組序列分析及生理生化特征的測定結果,我們認為菌株Z1極可能是Bcc基因組變異型Ⅸ(B.pyrrocinia)中的一員。

圖7 菌株Z1代謝產物的高分辨質譜分析質荷比分別為 1 230.564 1[M+H]+(A)、1 231.550 1[M+H]+(B)、1 099.507 4[M+H]+(C)、1 214.571 4[M+H]+(D)、1 215.556 5[M+H]+(E)及1 083.515 3[M+H]+(F)的衍生物的母離子的二級質譜圖。兩個或多個衍生物共有的碎片離子用紅色標出,衍生物A與B、D與E之間相差1 Da的碎片離子用藍色表示。質荷比為547.332 9[M+H]+、718.393 7[M+H]+和832.437 7[M+H]+的碎片離子與文獻[33]報道一致,其中832.437 7[M+H]+為burkholdines特有的碎片離子。Fig.7 The HRMS analysis of the metabolites of Z1Shown here are the MS2 spectrum for the masses with a m/z of 1 230.564 1[M+H]+(A),1 231.550 1[M+H]+(B),1 099.507 4[M+H]+(C),1 214.571 4[M+H]+(D),1 215.556 5[M+H]+(E)and 1 083.515 3[M+H]+(F)respectively.The numbers in red color indicate the MS2 fragments shared by two or more different derivatives,while the blue numbers highlight fragments with an increase of 1 Da compared with A and B,D and E,separately.The mass fragments with m/z of 547.332 9[M+H]+,718.393 7[M+H]+and 832.437 7[M+H]+are consistent with the ones in former publications,while the 832.437 7[M+H]+is unique for burkholdines.
結合抑菌活性、高分辨質譜、血平板試驗及基因組序列分析結果,我們認為菌株Z1產生的抑真菌活性物質應為環脂肽occidiofungins和burkholdines。盡管Z1基因組中僅存在與occidiofungin生物合成基因簇高度相似的基因簇(相似度88%),但這兩種環脂肽結構類似,考慮到腺苷酰化結構域(adenylylation domain)寬松的底物特異性,這在生物合成途徑上是完全可行的。目前已報道的能產生occidiofungins的伯克霍爾德氏菌有B.pyrrocinia Lyc2[37]、B.contaminans MS14[31];能產生burkholdines的菌有B.ambifaria 2.2N[33]。雖然兩種環脂肽結構非常相似,但既能合成occidiofungins又能合成burkholdines的菌株在國內外尚沒有文獻報道,且Z1還能合成burkholdine的新衍生物(圖7),這為研制具有自主知識產權的新生防菌劑奠定了基礎。